牡蛎脂质的超临界CO2萃取及气相色谱-质谱分析
2011-09-26佟蕾,朱蓓薇,周大勇,秦磊,迟雅丽
佟 蕾, 朱 蓓 薇, 周 大 勇, 秦 磊, 迟 雅 丽
(1.大连工业大学 海洋食品教育部工程研究中心, 辽宁 大连 116034;2.大连工业大学 农业部农产品加工技术研发贝类专业分中心, 辽宁 大连 116034)
0 引 言
牡蛎是一种世界性的海产经济贝类。牡蛎的收获季节比较集中,生鲜牡蛎易变质腐败,长期保存和远程运输都有一定的困难,因此,对牡蛎进行深加工,延长产品的贮藏期,提高产品的附加值,意义重大。目前牡蛎的研究多集中在牡蛎肽[1]、牡蛎牛磺酸[1]、牡蛎糖原[2]及牡蛎调味料[3]等。研究表明,脂质占牡蛎肉干重的6%~14%[4-6],其脂肪酸组成中多不饱和脂肪酸占40%以上[4,7],并以高含量的EPA和DHA为特征[4]。当前,在牡蛎精深加工中主要回收水溶性成分,而对牡蛎脂质并没有进行利用,造成严重的资源浪费。因此,建立合适的牡蛎脂质回收方法非常必要。关于采用超临界CO2萃取法提取牡蛎脂质的方法尚未见报道。本文旨在采用超临界CO2萃取法提取牡蛎脂质,以期寻找一种制备牡蛎脂质的绿色途径。此外,超临界CO2萃取脂质处理过程不会造成物料中蛋白质的变性[8],提取脂质后剩余残渣仍可作为原料制备水溶性深加工产品,以实现资源的综合利用。
1 材料与方法
1.1 主要试剂与仪器
脂肪酸标准品(37 Component FAME Mix)购于Sigma公司;其他试剂均为国产分析纯或色谱纯。
LG-1.0型真空冷冻干燥机,沈阳新阳速冻设备制造有限公司;HA121-50-01C超临界萃取装置,江苏南通华安超临界萃取有限公司;Agilent 6890N GC- 5973 MSD气质联用仪,美国Agilent公司。
1.2 实验方法
1.2.1 原料预处理
新鲜大连湾牡蛎(Crassostreatalienwhanensis)于2009年4月购于大连长兴水产市场,原料去壳后,洗掉附着的泥沙和盐分,沥干水分,冷冻干燥后粉碎至20目,存于-20 ℃备用。
1.2.2 牡蛎冻干粉化学组成分析
水分含量测定:AOAC(1990)标准方法952.08[9];
粗蛋白含量测定:AOAC(1990)标准方法981.10[9],N×6.25;
总糖含量测定:苯酚硫酸法(以葡萄糖为标准)[10];
粗脂肪含量测定:索氏提取法[11]。
1.3 牡蛎脂质的提取
1.3.1 超临界CO2萃取法
称取50 g牡蛎冻干粉末置于超临界装置的萃取釜中,升压升温后进行萃取,萃取条件参照文献[12]:萃取压力28 MPa,萃取温度50 ℃,CO2体积流量20 L/h,萃取时间80 min。萃取完成后,将所收集脂质称重,存于-20 ℃备用。
1.3.2 不可皂化物(甾醇)的提取
不可皂化物的提取方法参照文献[13-14]。将100 mg脂质样品置于四氟乙烯垫片旋盖小瓶中,加入2.5 mL质量浓度为0.5 g/mL氢氧化钾溶液和5 mL 95%的乙醇溶液。混匀后拧紧瓶盖,60 ℃水浴加热2 h,加热过程中不断搅动。皂化完成后,在冷水中迅速冷却至室温。使用正己烷萃取不可皂化物,每次加入4 mL,萃取6次。将正己烷合并后用去离子水洗至中性,35 ℃下氮吹至恒重,称重后存于-20 ℃备用。
1.3.3 脂肪酸的提取及甲酯化
脂肪酸的提取及甲酯化方法参照文献[13-14]。将上述萃取不可皂化物后剩下溶液用6 mol/L盐酸调至pH 1.0以下。冷却至室温后用正己烷萃取可皂化物,每次加入4 mL,萃取6次。将正己烷合并后用去离子水洗至中性,35 ℃下氮吹至恒重,并称重。取适量不可皂化物溶于正己烷中,使其质量浓度为10 mg/mL。取2 mL不可皂化物溶液置于四氟乙烯垫片旋盖小瓶中,并向小瓶中加入2 mL新配制的甲基化试剂(含1%硫酸的色谱级甲醇),70 ℃水浴加热1 h。反应完成后冷却至室温,加入1 mL去离子水,取出含有脂肪酸甲酯的正己烷层存于-20 ℃备用。
1.3.4 GC-MS分析
不可皂化物和脂肪酸甲酯均使用Agilent 6890N GC-5973 MSD气质联用仪进行分析。色谱柱:HP-5-MS毛细管柱(30 m×0.25 mm×0.25 μm),使用氦气为载气,恒压0.11 MPa(16.09 psi)。脂肪酸甲酯分析条件:初始温度140 ℃,保持5 min;以2.5 ℃/min速度升至250 ℃,保持10 min;以50 ℃/min的速度升至300 ℃,保持10 min。不可皂化物分析条件:初始温度200 ℃,保持5 min;以5 ℃/min速度升至320 ℃,保持10 min。质谱分析采用EI源(70 eV),选取Scan模式,扫描范围m/z50~550,溶剂延迟4 min。在脂肪酸的分析中,根据GC-MS中各组分保留时间以及质谱图,通过脂肪酸标准品(37 Component FAME Mix)和NIST02库检索进行鉴定,用峰面积归一法计算各脂肪酸的组成。在甾醇的分析中,根据GC-MS各组分的质谱图,通过NIST02库检索进行鉴定,用峰面积归一法计算各甾醇的组成。
2 结果与分析
2.1 牡蛎干粉的主要营养成分
新鲜牡蛎中,贝壳可占总质量的80%~85%,贝肉占10%~20%,壳内海水占5%~8%[15]。海洋贝类的营养组成受栖居地、食物及采收季节的影响很大[16]。从表1所测定的牡蛎肉冻干粉的主要营养组成来看,含有36.8%的总糖和47.3%的蛋白质,脂肪为9.2%,此结果与课题组之前所测定的一月份采收的同种属牡蛎的营养组成略有差别[6]。牡蛎干粉中含有9.2%的总脂,表明其可作为提取脂质的原料。
表1 牡蛎干粉的营养成分(干重)
Tab.1 Content of nutritive constituents in oyster meat (on dry basis)

成分粗脂肪粗蛋白总糖水分w/%9.247.336.82.4
2.2 超临界CO2萃取法提取牡蛎脂质的回收率
本实验采用的提油条件是课题组前期研究超临界CO2萃取法提取扇贝内脏脂质最优条件[12]。采用“1.3.1”所示方法提取牡蛎脂质的回收率为68.48%,说明此方法适用于牡蛎脂质的提取。
2.3 牡蛎脂质的脂肪酸组成
多不饱和脂肪酸是指含有两个或两个以上双键的脂肪酸。花生四烯酸、EPA、DHA等都是人体不可缺少而自身又不能合成的必需脂肪酸,在人体内具有广泛的生理功能和生物学效应[17]。牡蛎脂质中脂肪酸甲酯的总离子流色谱图见图1,牡蛎脂质的脂肪酸组成分析结果见表2。本研究所提取的牡蛎脂质中,花生四烯酸(C20:4n-6)、EPA(C20:5n-3)、DHA(C22:6n-3)等多不饱和脂肪酸含量较高,可占总脂肪酸的34.6%,这也与文献[4-5]报道的结果相符,说明牡蛎脂质具有很高的开发和利用价值。
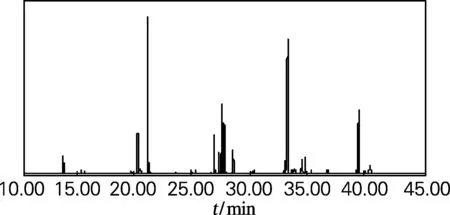
图1 脂肪酸甲酯的总离子流色谱图
Fig.1 The total ion chromatography of fatty acid methyl esters
2.4 牡蛎脂质的甾醇组成
甾醇类(sterols)化合物在自然界中广泛分布,固态时又称固醇,是以环戊烷全氢菲为骨架(又称甾核)的一种化合物。牡蛎中甾醇的总离子流色谱图见图2,牡蛎脂质中甾醇组成分析结果见表3。由表3可知,经超临界CO2萃取法提取的牡蛎脂质的不可皂化物主要由甾醇类化合物组成,其胆甾醇质量分数较高(接近40%),还含有较多的麦角甾醇衍生物、豆甾醇衍生物以及岩藻甾醇。牡蛎甾醇中胆固醇相对含量较低,说明其是一种健康脂质。麦角甾醇主要分布在菌类中,豆甾醇主要分布在植物中,而岩藻甾醇主要分布在藻类中,牡蛎脂质中含有的这些甾醇可能来源于其摄入的食物。软体动物一般不能自行合成甾醇,其体内的甾醇都是通过食物摄取的[18]。
表2 超临界CO2萃取牡蛎脂质中脂肪酸组成分析
Tab.2 Fatty acids compositions (%) of lipids extracted by SC-CO2method

脂肪酸w/%C14:02.6C16:1n-76.3C16:022.5C17:00.7C18:2n-63.0C18:1n-910.3C18:1n-77.8C18:03.7C20:4n-61.7C20:5n-320.4C20:2n-70.3C20:1n-93.0C20:1n-72.6C22:6n-39.1未鉴定5.9饱和脂肪酸29.4单不饱和脂肪30.1多不饱和脂肪酸34.6

图2 甾醇的总离子流色谱图
表3 超临界CO2萃取牡蛎脂质中甾醇组成分析
Tab.3 Sterols compositions (%) of lipids extracted by SC-CO2methods

甾醇w/%(22Z)-26,27-二降-麦角甾-5,22-二烯-3β-醇1.9胆甾-5,22-二烯-3β-醇4.4胆甾醇39.4胆甾烷醇4.9(22E,24S)-麦角甾-5,22-二烯-3β-醇16.1麦角甾-5,24-二烯-3β-醇13.3豆甾醇0.922,23-二氢-豆甾醇12.2豆甾烷醇0.7岩藻甾醇6.4
传统的提取脂质(有机溶剂萃取)过程中,大部分的有机溶剂都可以回收再利用,但是此过程仍然会不可避免的排放少量有机溶剂。与传统的有机溶剂萃取法相比,超临界CO2萃取法虽然在提取效率上相对较低,但由于其提取过程不用有机溶剂,可以防止提取产品中对人体有害溶媒的残留和对环境的污染。此外,由于超临界CO2萃取温度相对较低,不会造成提取原料中的蛋白质变性[8],提取的剩余残渣还可以继续加以利用,也值得更进一步的研究。
3 结 论
(1)采用超临界CO2萃取法制备牡蛎脂质,其回收率为68.48%。
(2)超临界CO2萃取法制备的牡蛎脂质的EPA和DHA含量高,分别占总脂肪酸的20.4%和9.1%;胆固醇含量低,占甾醇的39.4%,有一定的开发利用价值。
[1] 叶盛权. 牡蛎产品的开发研究[J]. 食品研究与开发, 2003, 24(6):83-85.
[2] 李青选. 牡蛎保健食品及国外开发的概况[J]. 中国海洋药物, 1989(2):47-52.
[3] 吴永沛. 酶法加工牡蛎调味品的研究[J]. 厦门水产学院学报, 1989, 11(1):52-58.
[4] ANNE L P, CAROLE P, JOEL H, et al. Comparison of two microalgal diets. 1. Influence on the biochemical and fatty acid compositions of raw oysters (Crassostreagigas)[J]. Journal of Agricultural and Food Chemistry, 2003, 51(7):2006-2010.
[5] SALWA D, MOHAMD S R, M’HAMED E. Seasonal variation in weight and biochemical composition of the Pacific oyster, Crassostrea gigas in relation to the gametogenic cycle and environmental conditions of the Bizert lagoon, Tunisia [J]. Aquaculture, 2007, 263:238-248.
[6] DONG Xiu-ping, ZHU Bei-wei, ZHAO Hong-xia, et al. Preparation and in vitro antioxidant activity of enzymatic hydrolysates from oyster (Crassostreatalienwhannensis) meat[J]. International Journal of Food Science & Technology, 2010, 45(5):978-984.
[7] PEDNEAUIT K, ANGERS P, AVIS T J, et al. Fatty acid profiles of polar and non-polar lipids of Pleurotus ostreatus and P. cornucopiae var. ‘citrino-pileatus’ grown at different temperatures[J]. Mycological Research, 2007, 111(10):1228-1234.
[8] WANG S S S, CHAO H S, LIU H L, et al. Stability of hen egg white lysozyme during denaturation is enhanced by pretreatment with supercritical carbon dioxide[J]. Journal of Bioscience and Bioengineering, 2009, 107(4): 355-359.
[9] HORWITZ W. Official methods of Analysis of the association of official analytical chemists[S]. 15thEd. Association of Official Analytical Chemists.Virginia:Arlington, 1990.
[10] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956, 28(3):350-356.
[11] 宁正祥. 食品成分分析手册 [M]. 北京:中国轻工业出版社, 1998:163-165.
[12] 马媛,王璐,孙玉梅,等. 超临界萃取法提取扇贝内脏脂质的研究[J]. 食品与发酵工业, 2006, 32(9):156-159.
[13] JEONG W S, LACHANCE P A. Phytosterols and fatty acids in fig (Ficuscarica, var. Mission) fruit and tree components [J]. Journal of Food Science, 2001, 66(2):278-281.
[14] KOVACS M I P, ANDERSON W E, ACKMAN R G. A simple method for the determination of cholesterol and some plant sterols in fishery-based food products[J]. Journal of Food Science, 1979, 44(5):1299-1301.
[15] 滕瑜,王彩理. 牡蛎的营养和降糖作用研究[J]. 海洋水产研究, 2005, 26(6):39-44.
[16] 黎辉,何慧,金启增. 大亚湾三种经济贝类的营养生态位及潜在产量评估[J]. 热带海洋, 1999, 18(4):53-59.
[17] 王镜岩,朱圣庚,徐长法. 生物化学:上册[M]. 3版. 北京:高等教育出版社, 2002:82, 88.
[18] MATTHEL M N, DAVID L L, CHARLES F P, et al. Comparison of growth and lipid composition in the green abalone, Haliotis fulgens, provided specific macroalgal diets[J]. Comparative Biochemistry and Physiology, 2002, 131:695-712.
