清热化瘀方对脑缺血再灌注大鼠GDNF mRNA及其蛋白表达的影响1)
2011-09-14胡跃强刘尊敬祝美珍胡玉英范立雷
胡跃强,唐 农,刘 泰,刘尊敬,祝美珍,胡玉英,范立雷
脑缺血损伤后,除了存在一种主动性的程序性细胞死亡(凋亡)过程,在耐受细胞内还存在一种平行的主动性神经元存活过程,而神经营养因子就参与了这种主动性神经元存活过程。胶质细胞源性神经营养因子(GDNF)是转化生长因子超家族成员,是一个最有效的营养因子[1],对多种神经元具有营养作用。它有促进多巴胺能神经元的存活,促进神经元轴突的定向生长以及促进运动神经元损伤修复和神经再生等作用。本实验通过研究清热化瘀方对脑缺血后GDNF mRNA及其蛋白表达的影响,以探讨脑缺血后GDNF的表达变化规律及清热化瘀方治疗脑缺血的脑保护作用机制。
1 材料与方法
1.1 动物分组及处理 SD大鼠96只,雌雄各半,体重250g±20g,随机分为正常对照组(A组)、假手术组(B组)、模型组(C组)和清热化瘀组(D组),后3组按处死时间分为术后3h、6h、12h、24h、3d、7d6个时间点,每个时间点5只动物。正常组大鼠不处理;假手术组线栓只插入颈内动脉9mm,使大脑中动脉起始部不致阻塞;模型组造模后灌胃等体积的生理盐水;清热化瘀组动物造模后,以清热化瘀汤(由水牛角、丹参、赤芍、地龙、石菖蒲等10味中药组成)14g/(kg·d)灌胃。各组均在术前6 h灌胃一次,且6h、12h、24h、3d、7d时间点的动物在手术后清醒时开始灌胃,每天上、下午各一次,每次1.4mL/100g大鼠,其浓度及等效剂量按体表面积折算。
1.2 动物模型制作 参考Longa的线栓法制备局灶性大脑中动脉脑缺血模型。试验过程和动物苏醒期间,保持动物的体温正常。
1.3 组织处理 将大鼠常规麻醉后,经左心室先后用生理盐水和4%的多聚甲醛进行灌注。然后取脑组织固定、脱水、石蜡包埋,按4μm厚度连续切片。
1.4 缺血半暗带脑皮质GDNF mRNA表达测定 原位杂交法,按试剂盒说明进行操作。
1.5 缺血半暗带脑皮质GDNF蛋白表达测定 免疫组化法。切片以1%H2O2灭活内源性过氧化物酶,滴加正常山羊血清封闭液室温下孵育30min,接着分别滴加1∶100稀释的小鼠抗大鼠GDNF单克隆抗体(Santa Cruz,USA),4℃过夜,然后以PBS洗涤。再滴加1∶100的二抗生物素化兔IgG(武汉博士德),PBS冲洗,切片以ABC试剂盒,按厂家说明进行处理。
1.6 结果观察 在生物光学显微镜下观察脑缺血周围区的GDNF的阳性神经元,采用HPIAS-1000彩色病理图像分析系统进行分析,测定原位杂交和免疫组化阳性细胞染色的光密度(OD)值。每张切片测定4个视野(×400),取平均值作为测定值。
2 结 果
2.1 缺血半暗带GDNF mRNA的表达变化 原位杂交显示,正常对照组与假手术组可检测到极弱的GDNF mRNA阳性染色细胞,脑缺血再灌注后3h其顶叶皮层表达水平开始增高(P<0.05),6h达到高峰(P<0.05),12h表达开始减弱(P<0.05),3d后降至正常水平;清热化瘀组其表达信号在缺血再灌注后3h、6h、12h、1d明显强于模型组。详见表1。
表1 各组大鼠GDNFmRNA表达的光密度值比较(±s)

表1 各组大鼠GDNFmRNA表达的光密度值比较(±s)
组别 3h 6h 12h 24h 3d 7d A组0.202±0.042 B组 0.210±0.049 0.206±0.060 0.195±0.054 0.198±0.046 0.211±0.048 0.213±0.058 C组 0.248±0.0641) 0.369±0.0661)2) 0.320±0.0601) 0.264±0.0531) 0.225±0.062 0.204±0.059 D组 0.272±0.0573) 0.398±0.0753) 0.357±0.0643) 0.302±0.0653) 0.233±0.061 0.218±0.063与B组和A组比较,1)P<0.05;与其他时间点比较,2)P<0.05;与C组比较,3)P<0.05
2.2 缺血半暗带GDNF蛋白的表达变化 正常对照组与假手术组可检测到较弱的GDNF蛋白染色阳性细胞,脑缺血再灌注后3h其顶叶皮层表达水平开始增高(P<0.05),6h达到高峰(P<0.05),12h表达开始减弱(P<0.05),3d后降至正常水平;清热化瘀组其表达信号在缺血再灌注后3h、6h、12h、1d三个时间点明显强于模型组。详见表2。
表2 各组大鼠GDNF蛋白表达的光密度值比较(±s)
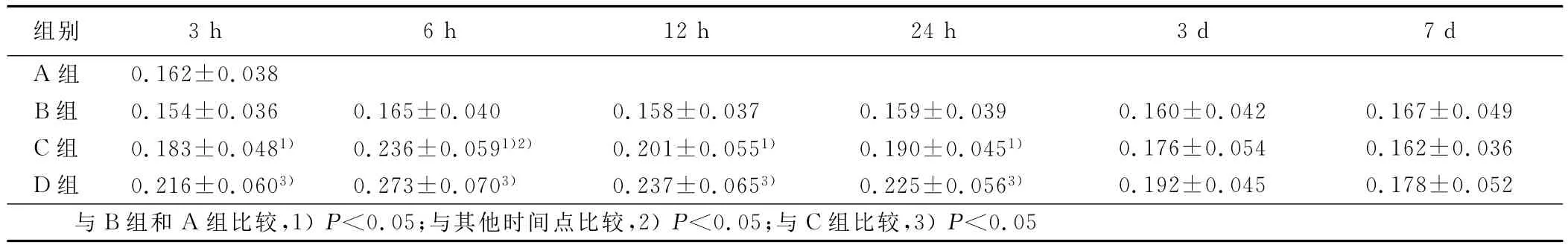
表2 各组大鼠GDNF蛋白表达的光密度值比较(±s)
组别 3h 6h 12h 24h 3d 7d A组0.162±0.038 B组 0.154±0.036 0.165±0.040 0.158±0.037 0.159±0.039 0.160±0.042 0.167±0.049 C组 0.183±0.0481) 0.236±0.0591)2) 0.201±0.0551) 0.190±0.0451) 0.176±0.054 0.162±0.036 D组 0.216±0.0603) 0.273±0.0703) 0.237±0.0653) 0.225±0.0563) 0.192±0.045 0.178±0.052与B组和A组比较,1)P<0.05;与其他时间点比较,2)P<0.05;与C组比较,3)P<0.05
3 讨 论
GDNF是转化生长因子β超家族成员,具有多种重要的生物学活性,不仅特异性地促进多巴胺能神经元的存活,还对外周神经系统及非神经系统具有广泛的作用。在胚胎发育过程中GDNF促进神经元的存活、轴突的生长、控制神经元的分化、调节突触传递。此外,GDNF可减少神经变性疾病中神经元的变性坏死,同时也是该类疾病基因治疗的候选神经营养因子之一。
脑缺血损伤后,GDNF表达增加,以抑制迟发性神经元损伤。在大鼠MCAO模型中,缺血30min再灌1h诱导GDNF表达,3h达高峰,24h后明显减少,在再灌注72h后其表达出现第二次高峰[2]。Miyazaki等[3]报道短暂前脑缺血后,海马GDNF的受体Ret表达升高,12h达高峰,给予GDNF脑室注射可显著减少海马CA1区迟发性神经元死亡。脑缺血后GDNF蛋白及受体的表达上调可能在脑缺血损伤后脑保护中起着重要的作用。GDNF对脑缺血后的神经保护作用可能是通过以下几条途径来实现的:①抑制脑缺血损伤后半胱氨酸蛋白酶(Caspase)-1、3的表达,减少神经元凋亡[4];②减轻脑缺血后脑水肿[5];③GDNF可减少NO的合成与释放,通过抑制神经元型NOS活性而发挥脑保护作用[6]。
脑梗死是临床危重急症之一,脑缺血后,引起多种炎症反应因子以及兴奋性氨基酸大量释放,激活NMDA受体,引起缺血级联反应,同时上述损伤也激活了神经元的自我保护机制。由于GDNF是蛋白质,不能通过血脑屏障,所以增加内源性神经营养因子分泌的治疗手段显得尤为重要,中药作为体内微环境的调节剂,可能在此方面具有重要的作用。依据“毒邪致病”理论而设的清热化瘀方由水牛角、丹参、川芎、地龙等中药制成,其功能为清热祛风化痰、活血化瘀通络、利水消肿,是治疗脑梗死的有效方剂,一系列研究表明其通过不同途径对脑缺血损伤组织具有保护作用,作为脑神经功能保护剂在临床运用有较好的疗效[7-9]。
本研究从神经营养因子的角度进一步研究清热化瘀方对脑缺血损伤的保护作用。结果表明,缺血半暗带GDNF mRNA及其蛋白均在脑缺血后3h出现明显表达,6h表达达到高峰,以后逐渐降低。提示清热化瘀方可能通过上调脑缺血后GDNF mRNA及蛋白的表达水平,从而保护受损神经元。
[1]Saarma M,Sariola H.Other neurotrophic factors:Glial cell line-derived neurotrophic factor(GDNF)[J].Microsc Res Tech,1999,45(4-5):292-302.
[2]Wei G,Wu G,Cao X.Dynamic expression of glial cell line-derived neurotrophic factor after cerebral ischemia[J].Neuro Report,2000,11(6):1177-1183.
[3]Miyazaki H,Nagashima K,Okuma Y,etal.Expression of ret receptor kinase after transient forebrain ischemia is modulated by glial cell line-derived neurotrophic factor in rat hippocampus [J].Neurosci Lett,2002,318(1):1-4.
[4]Yu LY,Saarma M,Arumäe U.Death receptors and caspases but not mitochondria are activated in the GDNF-or BDNF-deprived dopaminergic neurons[J].J Neurosci,2008,28(30):7467-7475.
[5]Chen B,Gao XQ,Yang CX,etal.Neuroprotective effect of grafting GDNF gene-modified neural stem cells on cerebral ischemia in rats[J].Brain Res,2009,1284:1-11.
[6]Lin SZ,Chiou AL,Wang Y.Keramine antagonizers nitric oxide release from cerebral cortex after middle cerebral artery ligation in rats[J].Stroke,1996:27:747-752.
[7]胡国恒,龙华君,陈北阳,等.清热化瘀方预处理对大鼠局灶性脑缺血再灌注损伤的保护作用[J].湖南中医学院学报,2006,26(2):7-9.
[8]胡跃强,胡国恒,吴云虎,等.清热化瘀颗粒治疗急性脑梗死临床观察[J].辽宁中医杂志,2003,20(7):65-67.
[9]吴云虎,叶萍,胡跃强.清热化瘀颗粒对局部脑缺血模型海马内IL-1β及ICAM-1的影响[J].现代中西医结合杂志,2004,13(16):2133-2135.
