吸氧预处理对大鼠局灶性脑缺血再灌注损伤后神经细胞凋亡及CHOP/GADD153表达研究
2011-08-11巴晓红潘凤英
巴晓红, 潘凤英
研究发现,大鼠持续吸入纯氧气24h可以诱导明显的脑缺血耐受称为OIP[1],目前在动物模型上研究证明脑缺血再灌注后有大量神经细胞凋亡,凋亡是脑缺血再灌注损伤后神经死亡的重要方式[2]。目前已知的凋亡途径有:死亡受体(death receptor 5,DR)介导的凋亡通路、线粒体/细胞色素c介导的凋亡通路、内质网应激(endoplasmic reticulum stress,ERS)途径。ERS是引起凋亡的重要机制之一,目前机制仍未完全阐明。目前OIP对脑缺血再灌注损伤的保护作用在凋亡调控基因Bcl-2、Bax、原癌基因cfos、星形胶质细胞的激活、SOD的活性增强等方面已有报道,但OIP是否对大鼠局灶脑缺血再灌注模型ERS及其诱导的细胞凋亡影响的研究未见报道。CHOP/GADD153是ERS的两个经典标志物之一[3]。本实验通过观察OIP对大鼠脑缺血再灌注损伤后ERS途径导致的细胞凋亡及经典标志物CHOP/GADD153的表达,全面动态阐明OIP对局灶性脑缺血再灌注损伤具有保护作用。
1 材料与方法
1.1 材料
(1)动物:狼褰嗉禨D大鼠180只,雌雄各半,体重250~300g,由辽宁医学院实验动物中心提供。饲养条件25℃,相对湿度为60%,光照时间12h/d,清洁饮水,标准饲养。(2)仪器和试剂:麻醉气体分析仪,兔抗大鼠GADDl53免疫组化试剂盒(北京博奥森生物工程公司),TUNEL细胞凋亡原位检测试剂盒(美国promega公司),CIAS-1000型细胞图像分析仪,ECL试剂(上海普飞公司)。
1.2 方法
1.2.1 动物分组 将健康SD大鼠随机分为模型组、假手术组和OIP组。每组按再灌注时间点(从线栓拔出时算起)不同再分为3h组、12h组、24h组、48h组、72h组,每组随机选12只大鼠,到相应时间点立即处死。模型组和OIP组大鼠均用线栓法造成右侧MCAO模型,2h后开放灌注。OIP组大鼠于术前置于OIP密闭吸氧箱内,内置钠石灰吸收二氧化碳,输入100%医用氧气,用麻醉气体分析仪监测氧气浓度达100%开始计时,持续吸氧24h,间隔24h后造模(方法同模型组)。
1.2.2 动物模型的制备 线栓法[4]制作大脑右侧 MCAO 模型[5,6],缺血2h 后将栓线拔出使其血流恢复,假手术组将栓线插入后随即拔出。
1.2.3 脑片制作及组织保存 OIP组将动物持续吸100%氧24 h,间隔24 h后行大脑中动脉缺血再灌注模型,造模成功并于再灌注后3h、12h、24h、48h、72h时间点每组随机取6只大鼠用4%多聚甲醛局部灌注内固定,断头取脑,自额区至枕区分为A、B、C、D、E五等分,取C脑片常规酒精脱水,石蜡包埋制成5μm厚防脱切片,分别行tunel检测、GADD153免疫组化染色。另外,每组随机取6只大鼠于相应时间点麻醉后立即处死,在冰台上迅速分离出海马组织立刻置于液氮中保存,以备行Western-Blot检测。
1.2.4 神经功能评分 参照文献[7]对大鼠进行神经功能评分,0分:无明显神经功能缺损表现;1分:不能伸展左侧前肢;2分:行走时向左侧旋转;3分:行走时向左侧倾斜;4分:行走时向左侧倾倒,意识丧失。
1.2.5 Tunel染色 采用TUNEL法原位标记DNA片断,检测凋亡细胞,试剂盒由美国promega公司提供,严格按照说明书进行操作。每例大鼠随机选取6张相同部位切片,在缺血再灌注侧海马CA1区随机选取6个不重叠高倍镜视野(×200),计算阳性细胞 (胞核含棕黄色颗粒)率[(阳性细胞数/计数细胞总数)×100%]。
1.2.6 免疫组化染色 GADD153免疫组化染色试剂盒购于北京博奥森生物工程公司,采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)免疫组化染色检测GADD153,切片常规脱蜡水化后放入新鲜配制的3%H2O2溶液中室温下孵育10min,微波抗原修复后,滴加羊血清封闭液15min,滴加兔抗GADD153抗体室温孵育15min,于4℃过夜,滴加生物素化羊抗鼠IgG 15min,辣根酶标记链霉卵白素工作液室温下孵育15min,以上各步骤除了滴加羊血清封闭液一步外均用PBS洗3min×3次,最后用DAB显色。每例大鼠随机选取6张相同部位切片,在缺血再灌注侧海马CA1区随机选取6个不重叠高倍镜视野(×200),计数阳性细胞数(胞核含棕黄色颗粒)。
1.2.5 Western-Blot检测 采用胞核-胞浆蛋白裂解液裂解蛋白,BCA法蛋白定量(PIERCE公司)。上样后SDS-PAGE凝胶电泳;湿转法转PVDF膜;一抗(1∶200)4℃孵育过夜后二抗孵育;ECL试剂(上海普飞公司)发光显影成像;光片于凝胶成像系统白光下扫描,进行吸光度分析,用同一标本内参进行校正,并按公式相对值=目的条带表达强度/tubulin表达强度计算出相对值。
1.2.6 统计学方法 采用spss13.6软件统计分析,检测数据用表示,多组间比较采用析因设计的方差分析法,组间和组内差异性比较在方差齐性检验后,采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 OIP对大鼠局灶脑缺血再灌注后的神经功能评分比
大鼠麻醉清醒后神经功能缺损症状和体征:假手术组大鼠自由活动、进食,无明显的症状和体征;模型组大鼠活动和进食均减少、出现右侧Horner征、精神萎靡,左上肢瘫痪,肌力减退,行走时向左侧偏斜或旋转,有的跌倒或完全瘫痪,大鼠神经行为学评分:假手术组各时间点大鼠分别为3.00±0.48、3.01 ±0.44、2.99 ±0.50、3.01 ±0.42、3.02 ±0.41,差异无显著性(P>0.05)。模型组与假手术组比较,差异显著(P<0.05),评分明显增加,24h时间点与组内其它时间点比较,差异显著(P<0.05),评分显著增加。OIP组与模型组比较,差异显著(P<0.05),评分明显减少(见表1)。
2.2 Tunel法检测细胞凋亡结果
假手术组各时间点偶见凋亡细胞,组内各时间点比较,差异无显著性(P>0.05)。模型组与假手术组比较,差异显著(P<0.05),再灌注3h偶见少量凋亡细胞(4.17% ±1.11%),12h后凋亡细胞开始明显增多(24.54% ±3.10%);至 24h,凋亡细胞数量达高峰(51.90% ±8.29%),细胞核浓缩,呈棕色或棕褐色,核形不规则,致密,形状不规则;再灌注48h凋亡细胞减少(36.93% ±5.63%),至72h凋亡细胞明显减少(15.04% ±2.29%)。24h时凋亡率最高,与组内其它时间点比较,差异显著(P<0.05)。OIP组凋亡率与模型组比较,差异显著(P<0.05),各时间点较模型组均减少(见图1、表2)。
2.3 GADD153免疫组化结果
假手术组大鼠各时间点GADD153极少见阳性表达,阳性细胞平均灰度值为 144.67±7.30、145.00 ± 18.49、143.82 ± 13.54、146.96 ± 6.35、143.78±10.58,各时间点比较,差异无显著性(P >0.05)。模型组与假手术组比较,差异显著(P<0.05),缺血再灌注3h,可见少量阳性细胞,阳性表达主要位于细胞核,核呈棕黄色,胞浆可有黄染,平均灰度值为126.60±5.65,再灌注12h阳性细胞开始增多,平均灰度值为111.41 ±14.44,至 24h,阳性细胞数量达高峰,平均灰度值为97.75±16.12,48h阳性细胞开始减少(112.40±10.25),至再灌注72h阳性细胞明显减少(124.94±9.66),再灌注24h与组内其它时间点比较,差异显著(P<0.05),阳性细胞数量最多。OIP组与模型组比较,差异显著(P<0.05),OIP组阳性表达明显减少(见图2、表3)。
2.4 Western-blot检测结果
Western-blot检测示 GADD153目的条带为29Kda。各组3h时间点和假手术组 GADD153均未见明显蛋白条带,模型组于再灌注12h后可见少量表达,至再灌注24h达高峰,48h之后逐渐下降,72h仅有少量表达。12h,24h,48h,72h时间点 OIP组与模型组比较,差异显著(P<0.05),表达大幅度减少(见图3、表4)。
表1 OIP对局灶脑缺血再灌注大鼠神经行为学评分的影响(,n=6)
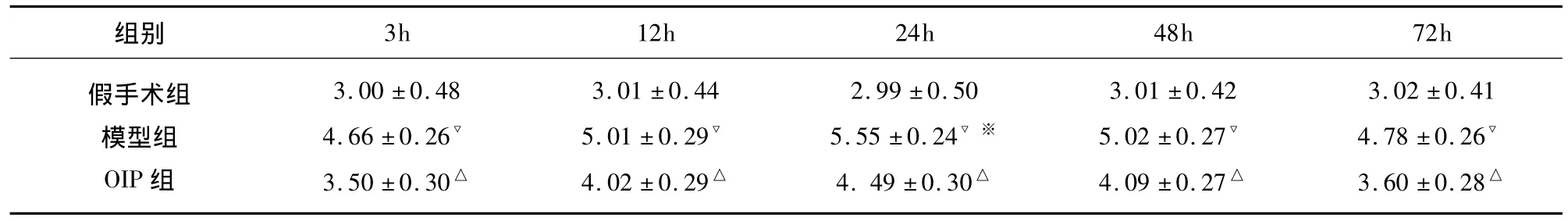
表1 OIP对局灶脑缺血再灌注大鼠神经行为学评分的影响(,n=6)
与模型组比较△P<0.05;与假手术组比较▽P<0.05;与组间不同时间点比较※P<0.05
组别3h 12h 24h 48h 72h假手术组模型组OIP组3.00 ±0.48 4.66 ±0.26▽3.50 ±0.30△3.01 ±0.44 5.01 ±0.29▽4.02 ±0.29△2.99 ±0.50 5.55 ±0.24▽※4.49 ±0.30△3.01 ±0.42 5.02 ±0.27▽4.09 ±0.27△3.02 ±0.41 4.78 ±0.26▽3.60 ±0.28△
表2 各组各时间点右侧海马CA1区细胞凋亡率(%)(,n=6)
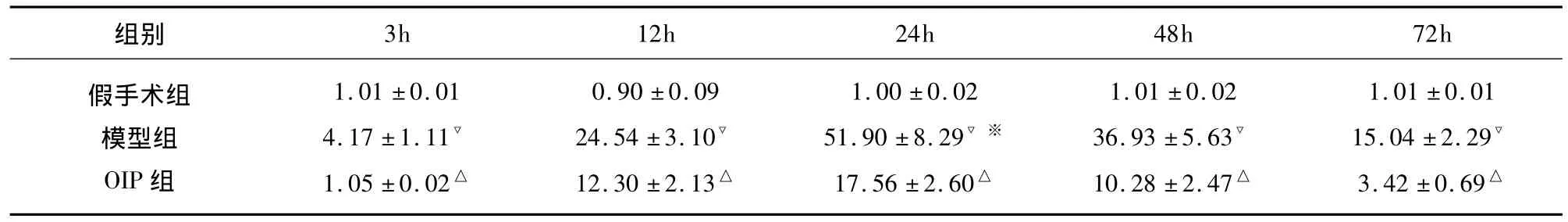
表2 各组各时间点右侧海马CA1区细胞凋亡率(%)(,n=6)
与模型组比较△P<0.05;与假手术组比较▽P<0.05;与组间不同时间点比较※P<0.05
组别3h 12h 24h 48h 72h假手术组模型组OIP组1.01 ±0.01 4.17 ±1.11▽1.05 ±0.02△0.90 ±0.09 24.54 ±3.10▽12.30 ±2.13△1.00 ±0.02 51.90 ±8.29▽※17.56 ±2.60△1.01 ±0.02 36.93 ±5.63▽10.28 ±2.47△1.01 ±0.01 15.04 ±2.29▽3.42 ±0.69△
表3 各组大鼠海马右侧CA1区GADD153表达平均灰度值(,n=6)

表3 各组大鼠海马右侧CA1区GADD153表达平均灰度值(,n=6)
与模型组比较△P<0.05;与假手术组比较▽P<0.05;与组间不同时间点比较※P<0.05
组别3h 12h 24h 48h 72h假手组模型组OIP组144.67 ±7.30 126.60 ±5.65▽136.28 ±16.44△145.00 ±18.49 111.41 ±14.44▽130.05 ±9.31△143.82 ±13.54 97.75 ±16.12▽※112.07 ±6.53△146.96 ±6.35 112.40 ±10.25▽125.73 ±11.93△143.78 ±10.58 124.94 ±9.6▽135.30 ±9.18△
表4 各组大鼠缺血侧海马CA1区GADD153表达相对值(,n=6)

表4 各组大鼠缺血侧海马CA1区GADD153表达相对值(,n=6)
与模型组比较△P<0.05;与假手术组比较▽P<0.05;与组间不同时间点比较※P<0.05
组别3h 12h 24h 48h 72h假手术组模型组OIP组000 0 0.1776 ±0.04▽0.071 ±0.01△0 0.6081 ±0.05▽※0.2432 ±0.01△0 0.5179 ±0.03▽0.2072 ±0.01△0 0.3563 ±0.04▽0.1425 ±0.01△
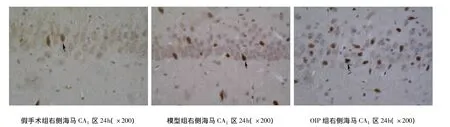
图1 Tunel法检测细胞凋亡结果

图2 GADD153免疫组化结果
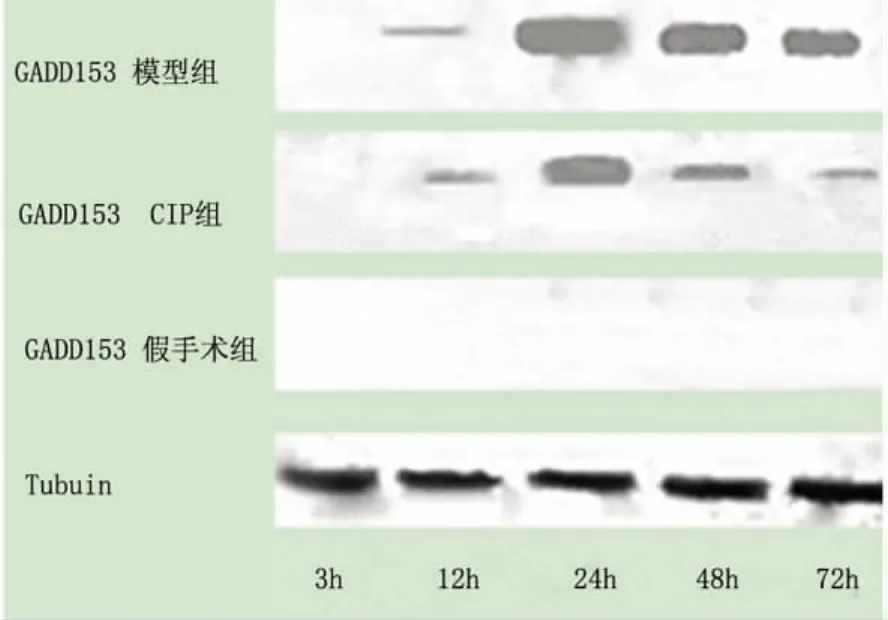
图3 GADD153(29KD)Western-blot条带
3 讨论
巴晓红[8]、张西京[9]等实验显示,OIP 后脑缺血再灌注模型得以增强超氧化物岐化酶的活性,清除氧自由基,诱导凋亡相关基因 Bax、Bcl-2表达,但OIP对大鼠脑缺血再灌注模型过度ERS中未折叠蛋白反应及其诱导的细胞凋亡的影响尚未见报道。
脑缺血再灌注后存在钙稳态失衡和过氧化损伤,由此可引起ERS,激活未折叠蛋白反应(unfoldprotein response,UPR),使蛋白折叠能力提高、蛋白合成抑制以适应应激,但是长时间过强的ERS则启动细胞凋亡。本实验中模型组GADDl53表达上调表明缺血再灌注启动了ERS,激活UPR,使蛋白折叠能力提高、蛋白合成抑制以适应应激,GADD153是ERS的经典标志物[10],GADD153在正常情况下位于胞浆,表达水平极低;然而在应激情况下可移位至胞核,表达显著增加。本实验结果表明,在相应时间点模型组与假手术组比较,GADD153免疫组化结果阳性细胞平均灰度值和 Western-blot检测结果GADD153蛋白含量相对值及细胞凋亡率均明显增加(P<0.05),GADD153在 24h时表达最高,凋亡在24h达到高峰,且GADD153上调与神经细胞凋亡保持一致。
现己知,哺乳动物的UPR信号转导形成了3条相互联系的通路:内质网转膜蛋白激酶通路:(ER transmembrane protein kinase,IREI);双链 RNA 激活蛋白激酶样内质网激酶(double-stranded RNA-activatedprotein kinase-like endoplasmic reticulum kinase,PERK)通路和活化转录因子6(activating transcription factor 6,ATF6)通路。ERS时,UPR反应通过下调翻译和上调内质网伴侣分子等减少ERS,达到保护细胞的目的;但持续或过强的UPR效应可诱导原本与IREI、PERK、ATF6紧密结合的 GRP78与之解离,进而激活GADD153和caspase-12等的活性,诱导细胞的凋亡。3条通路的之间的联系:通路之间的功能重叠现象:虽然IRE1,PERK和ATF6的激活是各自独立的,但是在UPR的过程中却存在广泛的交流。这3条信号通路都可以诱导GADD153转录,但是这其中 PERK 通路最重要[11,12]。GADD153 是一个由抗凋亡向促凋亡转换的重要信号分子,可以抑制BCL-2并可以使线粒体对BH3-only蛋白敏感,使细胞谷胱甘肽耗竭引起细胞凋亡。过表达GADD153可以导致细胞周期停滞并最终使细胞凋亡,但对其下游认识还十分有限[13]。GADD153是一个b-ZIP转录因子,属于CCAATP增强子连接蛋的转录因子C/EBP家族.正常情况下它表达非常低:在ERS时,通过以下机制上调表达:(1)内质网跨膜蛋白 IREI和 ATF6活化[14]。其胞浆活性部分(XBP1和ATF6)进入核内,与ERS反应元件序列中的CCAAT N9-CCACG中的CACG相连,在NF-Y的协同作用下,启动GADD153转录与表达;(2)通过PERK-6172a途径活化,导致转录因子ATF4和ATF3表达,前者结合氨基酸调控元件,再诱导GADD153表达。GADD153可能通过下调Bcl-2表达、耗竭谷胱甘肽、促进活性氧族产生等,活化caspase-3,最终导致细胞凋亡[15]。GADD153基因敲除可增强细胞对抗ERS所致凋亡的能力;与此相反,GADD153过度表达的细胞则对ERS所致凋亡更为敏感。
我们实验结果表明,在脑缺血再灌注术前24 h,给予大鼠吸入100%纯氧24h,各时间点可以发现模型组与假手术组比较,GADD153阳性细胞灰度值、蛋白含量相对值和凋亡细胞率均明显增加(P<0.05),OIP组较模型组均减少(P < 0.05)。GADD153阳性细胞灰度值、蛋白含量相对值和Tunel检测凋亡细胞率结果在24h时表达最高,证实GADD153上调与神经细胞凋亡一致。OIP可以抑制GADD153上调,证实OIP对大鼠局灶脑缺血再灌注损伤有保护作用,其机制可能是:(1)直接对抗缺血神经元缺氧及自由基的产生,减轻ERS。(2)可降低PERK通路相关基因GADD153及GADD34在缺血半暗带的表达,从而抑制缺血再灌注诱发的内质网应激,发挥减轻神经细胞凋亡的作用减轻了经由GADD153途径诱导的凋亡。(3)通过抑制某些促凋亡基因(如 caspase-3、c-fos、c-Jun、p53)和/或促进某些抑凋亡基因(如Bcl-2、HSP70)等的表达,抑制GADD153的表达。
本实验证实OIP对大鼠局灶脑缺血再灌注损伤有保护作用,从而为治疗缺血性脑血管疾病提供一个重要的新思路。
[1]张西京,熊利泽,王 曦,等.吸氧预处理对大鼠局灶性脑缺血损伤的保护作用[J].中国临床康复,2003,7(10):1506-1507.
[2]Dell’Anna E,ChenY,Engidawork E,et al.Delayed neuronal death following perinatal asphxia in rat[J].Exp Brain Res,1997,115(1):105-115.
[3]Yoshida H,Haze K,Yanagi H,et al.Identification of the cis-acting endoplasmic reticulum stress responsible for transcriptional induction of mammalian glucose-regulated proteins.Involvement of basic leucine zipper transcription factors[J].Biol Chem,1998,273(50):33741-33749.
[4]林竹贞,皮荣标.啮齿类脑缺血动物模型的研究进展[J].中国神经精神疾病杂志,2007,33(9):574-576.
[5]Craft TK,Glasper ER,McCullough L,et al.Social interaction improves experimental stroke outcome[J].Stroke,2005,36(9):2006-2011.
[6]Prieto R,Carceller F,Roda JM,et al.The intraluminal thread model revisited:rat strain differences in local cerebral blood flow[J].Neural Res,2005,27(1):47-52.
[7]Zhu Y,Prehn J,Culmsee C,et al.The beta2-adrenoceptor against clenbuterol moduiates bcl-2,bcl-xl and bax protein expression following transient forebrain ischemia[J].Neuroscience,1999,90(4):1255-1263.
[8]巴晓红,刘 英,曹俊芳.OIP对大鼠局灶脑缺血神经细胞凋亡及Bcl-2、Bax的影响[J].中国神经精神疾病杂志,2010,36(3):178-180.
[9]张西京,熊利泽,王 曦,等.吸氧预处理诱导的大鼠脑内Fos表达[J].第四军医大学学报,2003,24(7):610-613.
[10]Marx J.Molecular biology.Cancer’s perpetual source[J].Science,2007,31(5841):1029-1031.
[11]Oda Y,Okada T,Yoshida H,et al.Derlin-2 and Derlin-3 are regulated by the mammalian unfolded protein response and are require for ER-associated degradation[J].Cell Bio,2006,172(3):383-393.
[12]Sriburi R,Jackowski S,Mori K,et al.XBP1:a link between the unfolded protein response,lipid biosynthesis,and biogenesis of the endoplasmic reticulum[J].Cell Biol,2004,167(1):35-41.
[13]Faitova J,Krekac D,Hrstk R,et al.Endoplasmic reticulum stress and apoptosis[J].Cell Mol Biol Lett,2006,11(4):488-505.
[14]Jousse C,Bruhat A,Carrao V,et al.Inhibitiono of CHOP translation by a peptide encoded by an open reading frame localized in the CHOP 5’UTR[J].Nucleic Acids Res,2001,29(21):4341-4351.
[15]Kogler H,Schott P,Toischer K,et al.Relevance of brain natriuretic peptide in preload-dependent regulation of cardiac sarcoplasmic reticulum Ca2+ATPase expression[J].Circulation,2006,113(23):2724-2732.
