表皮生长因子影响人羊膜间充质干细胞迁移的机制
2011-08-09李彩虹庞希宁
李彩虹,施 萍,庞希宁
中国医科大学 1细胞生物学卫生部重点实验室干细胞与再生医学研究室2附属第一医院全科医学教研室,沈阳 110001
人羊膜间充质干细胞 (human amniotic mesenchymal stem cells,hAMSCs)在羊膜中含量丰富,分化能力强,能在体外进行分离、培养,且生物性能稳定,可以为实验和临床提供充足的细胞来源。表皮生长因子 (epidermal growth factor,EGF)可与EGF受体 (epidermal growth factor receptor,EGFR)结合并激活EGFR信号通路,在促进细胞增殖、存活、迁移等方面发挥重要作用[1]。笔者以往研究发现,EGF能促进hAMSCs的增殖和迁移[2]。
研究显示,磷脂酰肌醇激酶-3(phosphatidylinositol 3-kinases,PI3K)家族参与了多种信号通路,通过转录调控降低或促进其表达,可以调节细胞生理活动。Jak/STAT和细胞外调节蛋白激酶 (extracellular regulated protein kinases,ERK)通路可调节细胞增殖、分化和凋亡,对肠道病理生理过程起着重要的调控作用[3-5]。Sheng等[6]研究证实,ERK和PI3K/AKT信号通路在调节肠上皮细胞的生长、迁移、分化和凋亡中均发挥十分重要的作用。在多种病理生理过程中,PI3K/AKT和ERK通路之间可产生多样的相互作用[7-8],两者可协同调节细胞周期和凋亡等病理生理过程[9-10]。
基质金属蛋白酶-2 (matrix metalloproteinase-2,MMP-2)是降解细胞外基质骨架蛋白Ⅳ型胶原的主要酶之一,主要参与伤口愈合等生理功能,在正常成人组织中水平较低,只有在系统接受一个刺激或病理状态下才会升高。研究表明,肿瘤细胞侵袭过程中首先需要水解细胞外基质,多种肿瘤细胞的侵袭均伴随MMP-2表达升高,EGF促进小鼠胚胎干细胞迁移时,MMP-2表达也有升高[11]。
转录组学研究是基因功能研究的基础和出发点,通过在整体水平研究基因的表达,揭示特定生物学过程以及疾病发生过程的分子机制,是连接基因组遗传信息与蛋白质组功能信息的必然纽带[12]。目前关于细胞迁移机制的研究主要集中在具体某条信号通路上,缺少整体水平的研究。本研究观察了EGF对体外培养hAMSCs迁移的影响,并在转录组水平上检测了基因表达的差异,探讨了EGF影响hAMSCs迁移的机制。
材料和方法
材料 DMEM/F12培养基购自美国Gibco BRL公司,FBS购自美国Hyclone公司,Transwell小室购自美国Corning公司,EGF、AG1478、LY294002、U0126购自美国Sigma公司,磷酸化表皮生长因子 (phosphorylated Epidermal growth factor,P-EGFR)、磷酸化蛋白激酶B (phosphorylated protein kinase B,P-AKT)、磷酸化细胞外调节蛋白激酶 (phosphorylated extracellular regulated protein kinases,P-ERK1/2)、MMP-2 抗体购自美国Cellsignaling公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自中国Kangchen公司,山羊抗兔二抗、山羊抗小鼠二抗、Trizol购自美国Invitrogen公司,RTPCR试剂盒、Realtime-PCR试剂盒购自大连Takara公司。
hAMSCs迁移能力的测定 采用带有8μm微孔聚碳酸酯膜的Transwell小室测定细胞的迁移能力,具体为:hAMSCs用无血清的DMEM/F12饥饿12 h,胰酶消化并用无血清培养基制成密度为2×105/ml的细胞悬液,然后分为对照组 (未处理)、EGF组、抑制剂AG1478+EGF组、抑制剂LY294002+EGF组和抑制剂U0126+EGF组5组;将100μl细胞悬液分别加入各孔上室,下室加入600μl含10%FBS的DMEM/F12培养基;培养24 h后取出小室,以棉签拭去小室滤膜上的细胞,小室滤膜下的细胞于4%多聚甲醛中固定10 min,DAPI染色。由于DAPI能将细胞核染成蓝色,1个细胞只有1个细胞核,所以通过计数蓝色的细胞核数目就可以得到穿过膜的细胞数。在荧光显微镜下随机取5个高倍视野,计数穿过滤膜的细胞数目,取平均值,实验重复3次。
Western blot 取等量细胞总蛋白,用10%聚丙烯酰胺凝胶电泳分离后,将蛋白转印到PVDF膜上。用TBST[10 mmol/L Tris-HCl(pH 7.6),150 mmol/L NaCl,0.05%Tween-20]洗3次,然后用5%的脱脂奶粉封闭1 h,一抗杂交过夜,TBST洗3次,再用辣根过氧化物酶标记的二抗杂交1 h,TBST洗3次,最后用ECL plus(GE Healthcare)检测。
Real-time PCR 采用ABI Prism 7500(美国ABI公司),用SYBR Green法进行检测,每个样品做3个副孔,以GAPDH做对照,具体为:用Trizol试剂提取细胞总RNA,以RNA为模板反转录成cDNA,用特异性引物做q-PCR,检测基因的相对表达量。引物采用Primer 5设计,GAPDH上游引物5'-GCA CCG TCA AGG CTG AGA AC,下游引物5'-TGG TGA AGA CGC CAG TGG A;MMP-2上游引物5'-CTC ATC GCA GAT GCC TGG AA,下游引物5'-CAG CCT AGC CAG TCG GAT TTG。
RNA-Seq技术 提取生物样品的总 RNA,从中纯化出mRNA;利用二价阳离子处理mRNA使其片段化,然后将片段化的mRNA反转录合成双链cDNA,构成cDNA文库,并用高保真聚合酶进行PCR扩增以富集所得到的cDNA文库;利用Illumina Genome Analyzer平台对得到的cDNA文库进行测序,对测序数据进行生物信息学处理及后续分析。
统计学处理 采用SPSS 13.0统计软件,数据以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用q检验,P<0.05为差异有统计学意义。
结 果
各组hAMSCs的迁移情况 对照组、EGF组、抑制剂AG1478+EGF组、抑制剂LY294002+EGF组和抑制剂U0126+EGF组穿过的细胞数目分别为41.13 ±2.862、60.33 ±5.482、35.73 ±0.8110、37.40±1.943和40.97±1.977,其中,EGF组是对照组的1.5倍 (P=0.0361),抑制剂AG1478+EGF组 (P=0.0113)、抑制剂 LY294002+EGF组 (P=0.0169)和抑制剂 U0126+EGF组 (P=0.0293)明显低于对照组。
各组P-EGFR、P-AKT和P-ERK1/2的表达情况 Western blot检测结果显示,EGF处理10 min后,EGF组的P-EGFR、P-AKT和 P-ERK1/2表达水平增加;60 min后,P-EGFR恢复至原来的水平,P-AKT和P-ERK1/2仍低于原来的水平。抑制剂AG1478+EGF组的P-EGFR表达未见升高、P-AKT和P-ERK1/2表达也未升高。抑制剂LY294002+EGF组的P-AKT表达水平显著下降,P-ERK表达水平较EGF组有所降低,但较对照组有所升高。抑制剂U0126+EGF组的P-ERK1/2显著降低 (图1)。
EGF作用后MMP-2的表达情况 Western blot检测结果显示,EGF作用24 h后,MMP-2蛋白表达水平升高,MMP-9表达没有变化。Real-time PCR检测结果,EGF处理12 h后,MMP-2 mRNA表达水平增高,之后下降 (图2)。
差异表达基因的筛选情况 对EGF组和对照组细胞中差异表达基因的GO功能富集分析和KEGG代谢途径分析结果表明,EGF组细胞中发生转录上调的基因主要参与转录调节、蛋白质修饰、凋亡抑制等生命过程,其中与MAPK信号通路有关的基因为DUSP5、IL1B、DUSP6、NGF和HSPA2。
讨 论
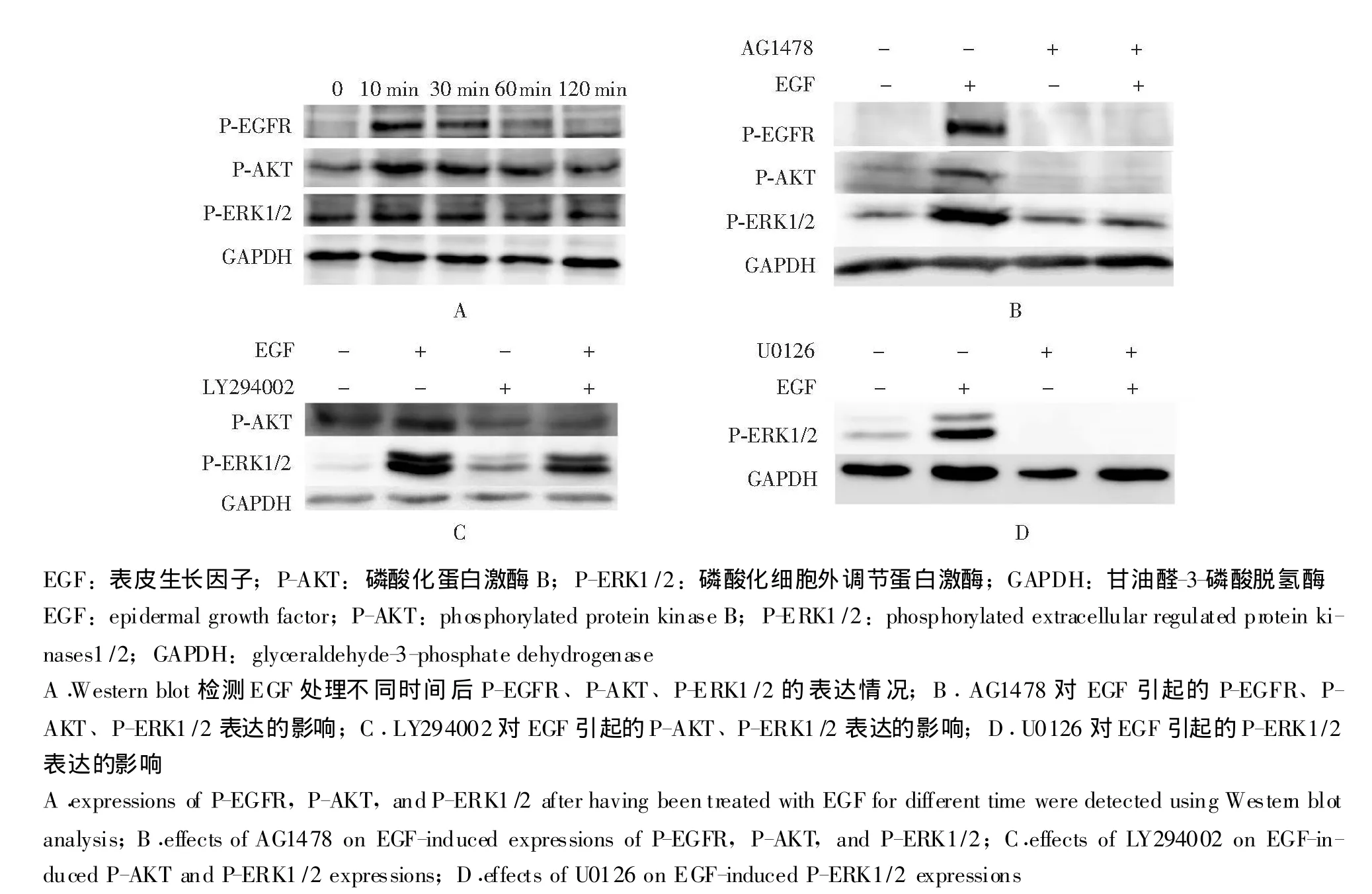
图1 各组P-EGFR、P-AKT和P-ERK1/2的表达情况Fig 1 Expressions of P-EGFR,P-AKT,and P-ERK1/2 in each group

图2 EGF作用不同时间后MMP-2和MMP-9的变化情况Fig 2 Expressions of MMP-2 and MMP-9 after having been treated with EGF for different time
为了评估EGF作用于hAMSCs后对其迁移的影响以及其中可能涉及的信号通路,本研究首先采用Transwell小室检测了不同处理条件下hAMSCs的迁移情况,此外还检测了EGFR、AKT、ERK等信号分子的磷酸化水平,并采用AG1478、LY294002、U0126等一系列信号分子的抑制剂来进一步验证各信号分子的活性受到抑制后对EGF作用所产生的影响。结果显示EGF处理后hAMSCs迁移能力增强,并且PI3K/AKT通路中的AKT磷酸化水和ERK信号通路中的ERK1/2磷酸化水平增高。用EGFR的抑制剂AG1478作用后,EGFR、AKT、ERK1/2的磷酸化水平均下降;PI3K的抑制剂LY294002作用后,AKT和ERK1/2的磷酸化水平下降,细胞的迁移能力也下降。由此推测,EGF与EGFR构成的信号通路可能是经过PI3K、ERK等信号分子,进一步将迁移信号传导致核内,引起基因转录,编码细胞生长、细胞骨架变化所必需的蛋白质,促进细胞的迁移。
研究表明,基质金属蛋白酶,特别是MMP-2和MMP-9可通过降解细胞外基质使得细胞-基质和细胞-细胞间的连接降解,从而参与内皮细胞和肿瘤细胞的迁移[13]。干细胞与肿瘤细胞一样,具有分化程度低的特点,两者在一些基因调节方面也有相似之处。有研究证实,MMP-2的过表达与肿瘤侵袭程度密切相关,小鼠胚胎干细胞中可表达MMP-2和MMP-9,但其表达是否与细胞的迁移有关目前尚不清楚[11]。本研究检测了EGF作用不同时间后MMP-2和MMP-9的蛋白表达量,发现MMP-2在EGF作用24 h后显著升高,MMP-9表达没有变化;之后用Real-time PCR技术检测EGF作用后MMP-2在mRNA水平的表达,发现EGF作用12 h后MMP-2表达增高;由此推测MMP-2可能参与了EGF对hAMSCs的调控,与细胞迁移有关。
鉴于单独研究某条信号通路的局限性,本研究采用RNA-Seq技术对hAMSCs基因组、基因匹配情况进行了统计分析,并对EGF组和对照组差异表达基因进行GO功能富集分析,结果显示EGF组细胞发生转录上调的基因主要参与转录调节、蛋白质修饰、抑制凋亡等生命过程,与MAPK信号通路有关的基因为DUSP5、IL1B、DUSP6、NGF和HSPA2。其中,DUSP5是一种双特异性蛋白质酪氨酸磷酸酶,酪氨酸磷酸化在控制正常细胞的生长、分化、代谢、细胞周期、细胞-细胞通信、细胞迁移、基因转录、离子通道、免疫应答及生存方面非常重要,因此DUSP5基因有望成为调节hAMSCs迁移的靶点。
综上,本研究结果显示,EGF可以促进体外培养hAMSCs的迁移,其可能是通过PI3K/AKT、ERK信号通路介导的,需要MMP-2的表达,及其参与转录调节、蛋白质修饰和凋亡抑制等基因的协同表达。由于EGF在干细胞治疗过程中可能通过促进有丝分裂、新生血管生成、抗炎、细胞保护、抗凋亡、调节免疫等旁分泌机制来发挥作用[14],因此可望在hAMSCs的临床治疗中发挥重要作用。
[1]Koizumi NJ,Inatomi TJ,Sotozono CJ,et al.Growth factor mRNA and protein in preserved human amniotic membrane[J].Curr Eye Res,2000,20(3):173-177.
[2] 李彩虹,施 萍,庞希宁 .表皮生长因子干预人羊膜间充质干细胞的增殖和迁移 [J].中国组织工程研究与临床康复,2011,5(23):4312-4315.
[3]Tebbutt NC,Giraud AS,Inglese M,et al.Reciprocal regulation of gastrointestinal homeostasis by SHP2 and STAT-mediated trefoil gene activation in gp130 mutant mice[J].Nat Med,2002,8(10):1089-1097.
[4]Naka T,Kishimoto T.Joint disease caused by defective gp130-mediated STAT signaling[J].Arthritis Res,2002,4(3):154-156.
[5]Ernst M,Inglese M,Waring P,et al.Defective gp130-mediated signal transducer and activator of transcription (STAT)signaling results in degenerative joint disease,gastrointestinal ulceration,and failure of uterine implantation [J].J Exp Med,2001,194(2):189-203.
[6]Sheng H,Shao J,Townsend CM Jr,et al.Phosphatidylinositol 3-kinase mediates proliferative signals in intestinal epithelial cells[J].Gut,2003,52(10):1472-1478.
[7]Marino M,Acconcia F,Trentalance A.Biphasic estradiolinduced AKT phosphorylation is modulated by PTEN via MAP kinase in HepG2 cells[J].Mol Biol Cell,2003,14(6):2583-2591.
[8]Bradley EW,Ruan MM,Vrable A,et al.Pathway crosstalk between Ras/Raf and PI3K in promotion of M-CSF-induced MEK/ERK-mediated osteoclast survival[J].J Cell Biochem,2008,104(4):1439-1451.
[9]Shelton JG,Steelman LS,White ER,et al.Synergy between PI3K/AKT and Raf/MEK/ERK pathways in IGF-1R mediated cell cycle progression and prevention of apoptosis in hematopoietic cells[J].Cell Cycle,2004,3(3):372-379.
[10]Steelman LS,Pohnert SC,Shelton JG,et al.JAK/STAT,Raf/MEK/ERK,PI3K/AKT and BCR-ABL in cell cycle progression and leukemogenesis[J].Leukemia,2004,18(2):189-218.
[11]Park JH,Han HJ.Caveolin-1 plays important role in EGF-induced migration and proliferation of mouse embryonic stem cells:involvement of PI3K/AKT and ERK [J].Am J Physiol Cell Physiol,2009,297(4):C935-C944.
[12]Wang B,Guo G,Wang C,et al.Survey of the transcriptome of Aspergillus oryzae via massively parallel mRNA sequencing[J].Nucleic Acids Res,2010,38(15):5075-5087.
[13]EliceiriBP,Cheresh DA.The role of alphav integrins during angiogenesis:insights into potential mechanisms of action and clinical development[J].J Clin Invest,1999,103(9):1227-1230.
[14]Xu YX,Chen L,Wang R,et al.Mesenchymal stem cell therapy for diabetes through paracrine mechanisms[J].Med Hypotheses,2008,71(3):390-393.
