蛋白连接组织生长因子表达腺病毒的构建及其基因功能
2011-08-09章华兵方福德常永生
宫 宁,章华兵,方福德,常永生
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京 100005
蛋白连接组织生长因子 (connective tissue growth factor,CTGF),是一个相对分子质量为36000~38000的富含半胱氨酸的肝素结合蛋白,一个高度保守的CCN家族成员,CCN是由这个家族3个主要成员CTGF、富含半胱氨酸-61(Cysteine-rich 61,Cyr-61)、肾胚细胞瘤过表达基因 (nephroblastoma overexpressed gene,Nov)的英文首字母衍生出来的缩写[1]。研究表明,在肾小球系膜上CCN2能够激活Wnt途径[2]。体外研究发现,CTGF在几种细胞中都能被转化生长因子 -β1(transforming growth factor-β1,TGF-β1)所诱导,包括人的真皮细胞[3]。在体外TGF-β1能够高亲和力结合到3T3-L1细胞的原生质膜上,并且能够抑制脂肪细胞的转化[4]。在纤维化症中,CTGF是 TGF-β1下游的介质[5]。糖尿病型心肌病被定性为间质纤维化、心肌肥大和细胞凋亡,而CTGF参与纤维化过程[6]。在链唑霉素诱导的糖尿病肾病大鼠中,CTGF表达量上升。高浓度葡萄糖能够刺激TGF-β1表达,而肾小球系膜细胞的TGF-β1引发了 CTGF的表达。高糖诱导的CTGF表达能够被抗TGF-β1抗体和蛋白激酶C抑制剂GF109203X所抑制[7]。在糖尿病小鼠心肌细胞中CTGF表达量升高[8]。到目前为止,CTGF在糖脂代谢方面的作用研究比较少,功能尚不清楚。对CTGF基因的深入研究将有望成为肥胖、糖尿病、脂肪肝等代谢疾病的治疗靶点。本研究构建及鉴定了CTGF基因过表达腺病毒,初步探究了CTGF在糖脂代谢方面的功能。
材料和方法
材料 CTGF扩增序列引物 (美国Invitrogen公司),扩增序列:5′-CTGCTGTGCATCCTCCTACC-3′(正向),5′-AATGAGTTCGTGTCCCTTACTTC-3 ′(反向);两端分别添加Kpn I和Xba I酶切位点,C端加Flag标签。Kpn I和Xba I酶、T4 DNA连接酶、pyrobest Taq DNA聚合酶、dNTP(日本Takara公司),T-easy质粒、实时定量 PCR试剂盒 (美国 Promega公司),Lipofectamine2000、细胞培养所用培基 (美国Invitrogen公司),pAdTrack-CMV和pAdTrack-U6由本实验室保存,逆转率试剂盒 (美国ABI公司)。C57/BL6小鼠20只,7~8周龄,体重22 g~25 g,购自维通利华公司。
CTGF基因重组质粒的构建及腺病毒包装 将测序正确连在T-easy质粒上的CTGF酶切下来,定向连入穿梭载体pAdTrack-CMV。提取穿梭质粒,取5 ug经Pme I酶切7 h充分线性化,酚氯仿抽提,溶于20μl去离子水中。取100 ~500 ng酶切质粒,转化E.coli BJ5183感受态细菌。以500μl LB培养基重悬细菌,涂于卡那霉素抗性的LB平板,置于37℃孵箱内培养16~20 h。挑取较小的克隆摇床过夜,提质粒,经Pac I酶切可得30 kb和4.5 kb两条带或者30 kb和3.0 kb两条带,即为阳性克隆。将阳性克隆的质粒转化大肠杆菌DH5a,挑菌培养提质粒。取12μg所得的重组质粒用 Pac I酶切 7~9 h,经酚氯仿抽提,乙醇沉淀后,溶于去离子水。将回收质粒转染密度50%~70%接种于T-25培养瓶的293A细胞,按Lipofectamine2000转染试剂说明书转染。孵箱中培养10~15 d,不用换培养基,每天或隔天补500μl DMEM完全培养基。一般转染5~7 d后可以通过荧光显微镜观察到GFP斑。
CTGF腺病毒的扩增 转染后10~12 d,将细胞吹下来,转入50 ml离心管 (或15 ml),如果转染效率低 (<30%),可在15 d以后再收集细胞,重悬于PBS中,液氮-37℃,反复冻融4次,收集病毒裂解液。第2轮扩增,加病毒裂解液到2个T-25瓶子 (接种293A细胞,汇合度90%),细胞全部呈绿色且30%~50%细胞悬浮时,收集细胞,重悬于PBS中,液氮-37℃,反复冻融4次,收集病毒裂解液。第3轮扩增,加病毒于10个100 mm大皿中(接种293A细胞,汇合度90%),其余步骤同第2轮扩增。
细胞培养及用腺病毒感染小鼠肝原代细胞 采用含10%胎牛血清的DMEM培养基培养293A细胞,培养基中添加100 U/ml青霉素和0.1 mg/ml链霉素。细胞在37℃、5%CO2的孵箱中培养,实验时取对数生长期细胞。用经典的灌流-胶原酶消化法获取成活率为90%以上的小鼠肝脏原代细胞,铺至6孔板中,用1640(10%的血清,100 U/ml青霉素和0.1 mg/ml链霉素)培养,感染病毒前换新鲜的培养基。每个孔加120感染复数的病毒。
总RNA提取和Real-time PCR 按照TRIzol(美国Invitrogen公司)说明书提取细胞总RNA,紫外分光光度计定量,取2μg RNA加入random primer用Multi Scribe反转录酶 (美国ABI公司)反转录成cDNA。在IQ5仪器 (美国BIO-RAD公司)上进行扩增反应。条件为:95℃10 min,95℃30 s、58℃30 s、72℃30 s(捕捉荧光值),循环40次,并作溶解曲线。CTGF:上游引物 5′-TCTCCACCCGAGTTACCAATG-3′,下游引物 5′-CACCCCGCAGAACTTAGCC-3 ′。PGC1 α:上游引物 5′-GACATAGAGTGTGCTGCTCTG-3′,下游引物5′-CATTGTTGTACTGGTTGGATATG-3 ′。
Western blot 等量蛋白样品以SDS-PAGE(分离胶浓度为10%)分离;电泳结束后将凝胶中的蛋白样品电转至PVDF膜上,电转1.5 h,封闭液室温封闭PVDF膜1.5 h;PVDF膜置于一抗 (anti-Flag:1∶8000)溶液中,4℃摇床过夜;TBST洗PVDF膜4次,每次10 min;PVDF膜与辣根过氧化物酶标记的二抗 (用TBST配制的2.5%BSA以1∶5000稀释)室温作用1~2 h;TBST洗PVDF膜4次,每次10 min;将ECL液体以0.1 ml/cm2膜的用量滴加在PVDF膜上,室温1 min。迅速吸去多余的ECL液体,用保鲜膜包好PVDF膜,暗室曝光。
小鼠禁食处理 10只C57/BL6小鼠分别进行如下处理:编号1、2小鼠正常喂食3 d,处死,取肝脏提RNA;编号3、4小鼠饥饿12 h,处死,取肝脏提RNA;编号5、6小鼠饥饿12 h,重新喂食12 h,处死,取肝脏提RNA;编号7、8小鼠饥饿48 h,处死,取肝脏提RNA;编号9、10小鼠饥饿48 h,重新喂食12 h,处死,取肝脏提RNA。
统计学处理 采用SPSS 11.0统计软件,数据以3次以上结果的平均数 ±标准差表示,差异比较采用t检验,P<0.05为差异有统计学意义。
结 果
CTGF基因克隆、过表达质粒的构建及重组质粒的构建及鉴定 PCR扩增约1000 bp左右片段,连接T-easy载体,经过测序与NCBI上报导的序列一致,扩增过表达质粒带有Kpn I和Xba I两个酶切位点,N端加kozak序列,C端加Flag标签。过表达质粒通过Kpn I和Xba I两个酶切位点定向连入pAdTrack-CMV中,Pme I消化质粒,线性化的质粒电转入感受态的E.coli BJ5183(带有pAdEasy-1)。挑菌培养提质粒经Pac I酶切,发现阳性重组菌产生30.0 kb和4.5 kb左右的两条带 (图1)。
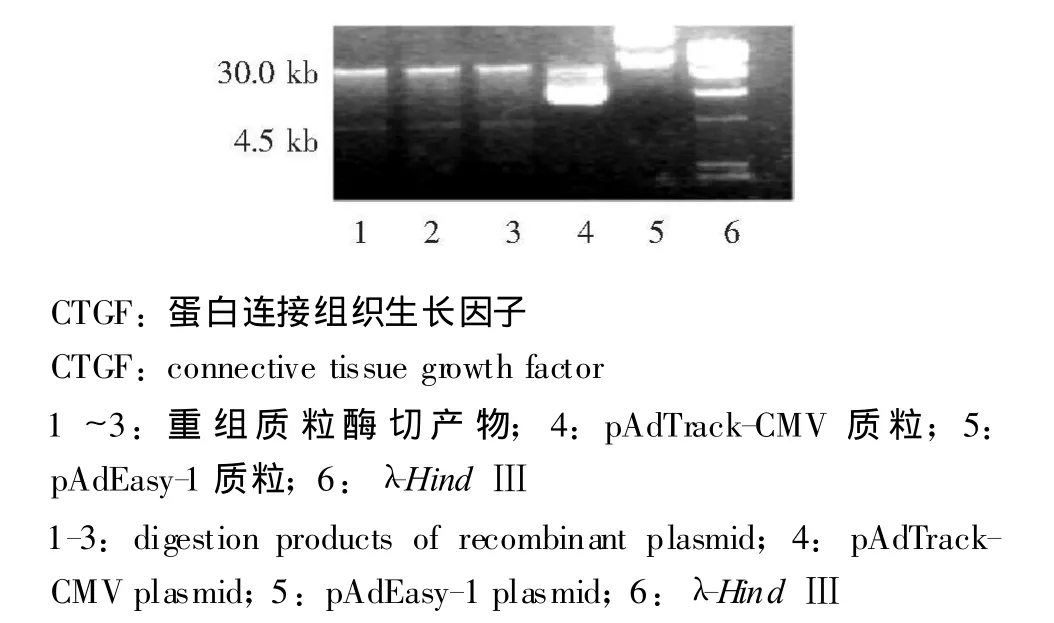
图1 CTGF重组质粒Pac I酶切鉴定Fig 1 Identification of the recombinant plasmid ofCTGF after Pac I digestion
CTGF基因过表达腺病毒的包装及肝原代水平验证其表达 Pac I线性化部分质粒,转染293A细胞,约7~10 d可见明显的扩增斑;待细胞30%~50%悬浮时,收集细胞,反复冻融4次,收集病毒;经过3轮扩增,感染小鼠肝脏原代细胞 (图2),感染效率达90%以上。48 h后收集肝原代细胞,Western blot实验用抗Flag标签抗体检测感染Ad-CTGF的肝脏原代细胞,发现在相对分子质量38000处有1条非常特异的带,而感染Ad-GFP的对照则没有条带(图 3)。
不同禁食条件下CTGF表达量变化情况 饥饿24 h和48 h后,CTGF表达量都是上升的,禁食后重新喂食CTGF的表达量又开始下降,这种变化情况与过氧化物酶体增值激活受体 γ共激活因子1 α(peroxisome proliferators-activated receptor γcoactivator 1 α,PGC1 α)变化情况类似;其中,饥饿48 h后CTGF和PGC1 α的表达量明显高于进食组 (P均 <0.05)(图4)。
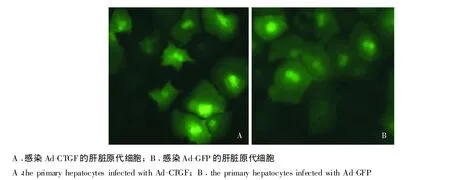
图2 Ad-CTGF和Ad-GFP感染肝脏原代细胞48h的荧光照片 (×250)Fig 2 Fluorescence photos of mouse primary hepatocytes infected with Ad-CTGF and Ad-GFP(×250)
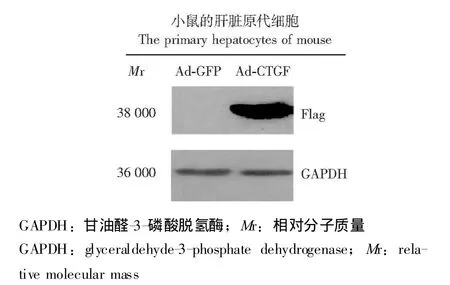
图3 小鼠肝原代细胞感染 Ad-GFP和 Ad-CTGF 48 h后的Western blot验证表达Fig 3 Identification of the expression of CTGF in mouse primary hepatocyes infected with Ad-GFP and Ad-CTGF using the antibody of Flag-tag
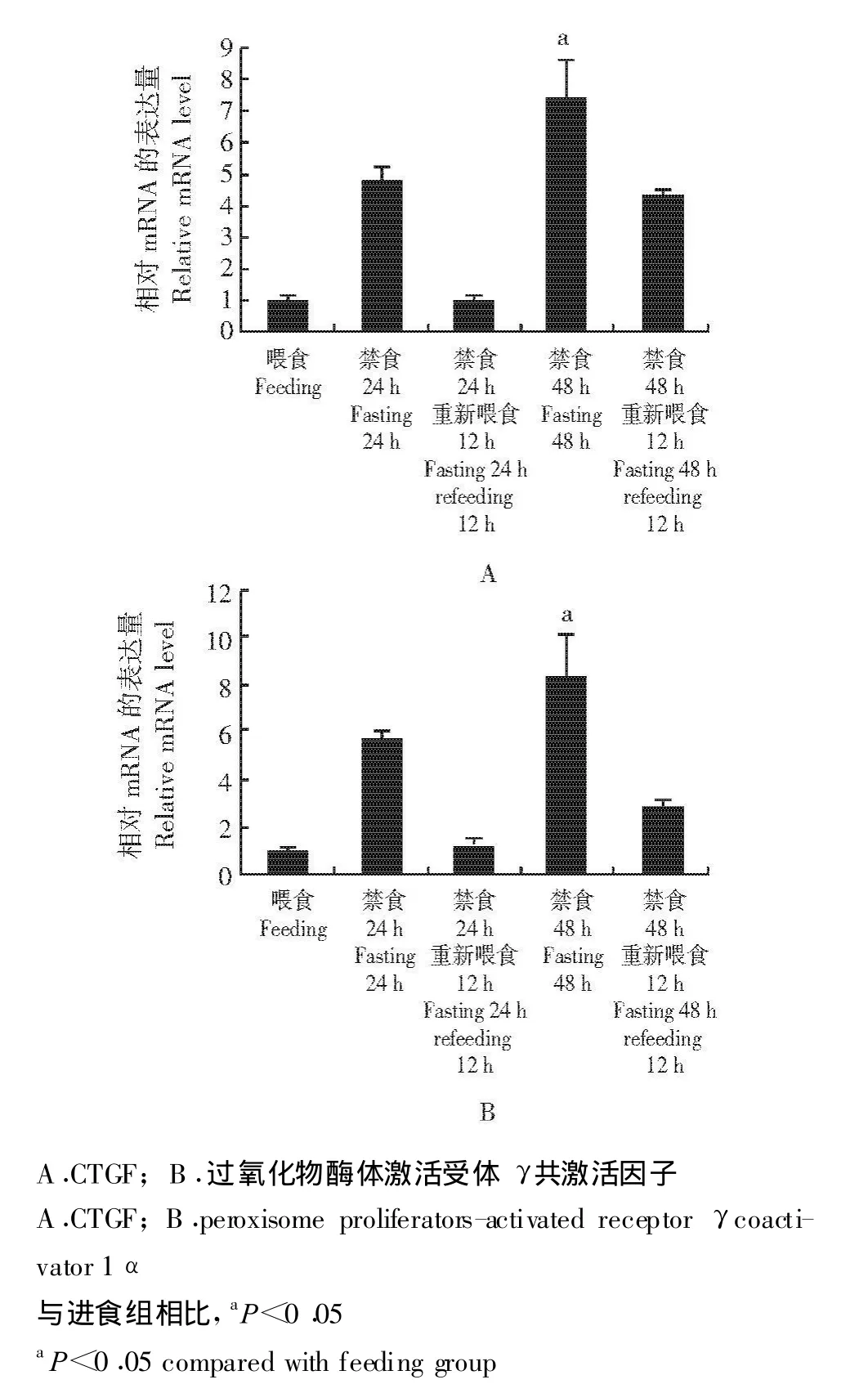
图4 不同禁食条件下PGC1 α和CTGF的表达情况Fig 4 Expressions of CTGF and PGC1 αunder different starving conditions
讨 论
PGC1 α转录共激活子是肝脏饥饿代谢活动的重要中介子,能够在饥饿条件下,通过调控cAMP反应元件结合蛋白1转录共激活子2(cAMP responsive element binding protein 1 regulated transcription coactivator 2,CRTC2)应答胰高血糖素/cAMP的诱导和维持糖异生基因的表达[9]。在肝原代水平上,过表达PGC1 α能够模拟Fsk+Dex的作用。在喂食情况下,胰岛素/蛋白激酶B (protein kinase,PKB)能够通过多种途径抑制PGC1 α的作用,AKT能够直接磷酸化PGC1 α的 丝氨酸 -精氨 酸 (Serine-Arginine,SR) 结构域里的S570[10]。此外,PGC1 α的SR结构域能够以胰岛素/AKT依赖的方式与Foxo1相互作用。研究发现,PGC1 α在糖脂代谢过程中有着重要的作用。转录共激活因子PGC1 α在多种组织中可促进线粒体生物合成及氧化代谢。禁食后,其在肝脏中被诱导表达并促进糖异生、脂肪酸氧化;PGC1 α在褐色脂肪组织中被诱导表达以对抗低温环境;机体运动时,其还能在骨骼肌中被诱导表达以促进氧化磷酸化。本研究结果显示,CTGF在禁食后表达量是上升的,与PGC1 α变化趋势相同,并且变化明显,提示CTGF可能参与了糖脂代谢。
腺病毒载体系统能够实现基因在哺乳动物和细胞中高效表达,该实验方法目前应用非常广泛。本研究包装成功的腺病毒感染肝原代细胞效率可以达到90%以上,为CTGF在细胞水平功能的研究提供了有力手段。而通过鼠尾静脉注射高滴度的腺病毒,能够特异且高效地感染肝脏细胞,实现CTGF基因在肝脏中过表达,同样为CTGF的在肝脏中糖脂代谢功能的研究提供有力手段,并且为CTGF可能基因治疗提供了保证。
[1]Tan JT,McLennan SV,Song WW,et al.Connective tissue growth factor inhibits adipocyte differentiation[J].Am J Physiol Cell Physiol,2008,295(3):C740-C751.
[2]Rooney B,O'Donovan H,Gaffney A,et al.CTGF/CCN2 activates canonical Wnt signalling in mesangial cells through LRP6:Implications for the pathogenesis of diabetic nephropathy[J].FEBS Lett,2011,585(3):531-538.
[3]Blalock TD,Yuan R,Lewin AS,et al.Hammerhead ribozyme targeting connective tissue growth factor mRNA blocks transforming growth factor-beta mediated cell proliferation[J].Exp Eye Res,2004,78(6):1127-1136.
[4]Croissandeau G,Chr étien M,Mbikay M.Involvement of matrix metalloproteinases in the adipose conversion of 3T3-L1 preadipocytes[J].Biochem J,2002,364(Pt3):739-746.
[5]Kim KH,Park GT,Lim YB,etal.Expression ofconnective tissue growth factor,a biomarker in senescence of human diploid fibroblasts,is upregulated by a transforming growth factor-β-mediated signalling pathway[J].Biochem Biophys Res Commun,2004,318(4):819-825.
[6]Wang X,McLennan SV,Allen TJ,et al.Adverse effects of high glucose and free fatty acid on cardiomyocytes are mediated by connective tissue growth factor[J].Am J Physiol Cell Physiol,2009,297(6):C1490-C1500.
[7]Murphy M,Godson C,Cannon S,et al.Suppression subtractive hybridization identifies high glucose levels as a stimulus for expression of connective tissue growth factor and other genes in human mesangial cells[J].J BiolChem,1999,274(9):5830-5834.
[8]He Z,Way KJ,Arikawa E,et al.Differential regulation of angiotensin II-induced expression of connective tissue growth factor by protein kinase C isoforms in the myocardium[J].J Biol Chem,2005,280(16):15719-15726.
[9]Koo SH,Flechner L,Qi L,et al.The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism[J].Nature,2005,437(7062):1109-1111.
[10]Claret M,Smith MA,Batterham RL,et al.AMPK is essential for energy homeostasis regulation and glucose sensing by POMC and AgRP neurons[J].J Clin Invest,2007,117(8):2325-2336.
