一种吡喃并噻吩并嘧啶酮衍生物与牛血清白蛋白的相互作用研究
2011-07-27孙绍发宋功武
陈 莉,孙绍发,宋功武
(1.咸宁学院药学院,湖北 咸宁 437100;2.湖北大学化学化工学院,湖北 武汉 430062)
蛋白质是生物体内一类最重要的生物大分子,药物进入人体后需要通过血浆的储运才能发生药理作用。因此,研究以血清白蛋白为代表的蛋白质与生物活性小分子间的相互作用,有助于认识药物的作用机制,了解药物在体内的运输、分布,也有助于对药物的药效和不良反应进行评估,具有重要的理论指导意义。
吡喃并噻吩并嘧啶酮衍生物是一类具有良好生物活性的杂环化合物,如抗菌、抗病毒[1,2]、抑制肥胖[3,4]、消炎镇痛[5]、抗焦虑以及抗心律不齐[6]等。
作者采用荧光光谱法研究了不同温度下3-对氯苯基-2-(四氢吡咯-1-基)-5,6,8-三氢吡喃并[3′,4′:4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮(PPTP)(图1) 与牛血清白蛋白(BSA) 的相互作用,计算了二者之间相互作用的热力学参数、结合常数和结合位点数,确定了作用力类型,并采用同步荧光技术考察了PPTP对BSA构象的影响。

图1 PPTP的结构
1 实验
1.1 试剂与仪器
PPTP,自制[7]:m.p.234~235 ℃。IR(KBr),ν,cm-1:3054(=CH),1687(C=O),1582(C=C),1521(C=N),1492、1458(C=C),1221(C-N),1089(C-O-C)。1HNMR(300 MHz,CDCl3),δ,ppm:1.73(s,4H,2CH2),2.98(s,2H,CH2),3.06(t,4H,2CH2),3.96(t,2H,CH2),4.73(s,2H,CH2),7.26~7.45(m,4H,C6H4)。MS:m/z,%:387(100,[M+]),358(24),287(17),165(34),111(24),70(32)。
牛血清白蛋白(BSA,中国科学院化学研究所),BSA溶解在Tris-HCl(0.05 mol·L-1Tris+0.10 mol·L-1NaCl,pH=7.4) 缓冲溶液中,其它试剂均为分析纯,实验用水为超纯水。
F-4500型荧光分光光度计(带恒温系统)、UV-2300型紫外可见分光光度计,日本日立;PHS-3C型pH计,江苏江分;BS124S型电子分析天平,北京赛多利斯。
1.2 方法
分别配制5.0×10-3mol·L-1的PPTP贮备液(DMF为溶剂)及不同温度(T=298 K、302 K、306 K、310 K)下pH值为7.4的Tris-HCl缓冲溶液。
在1 cm比色皿中分别加入2 mL 1×10-5mo1·L-1的BSA溶液和不同量的PPTP,得到不同物质的量比的PPTP与BSA系列溶液。在λ=282 nm下激发,激发和发射狭缝均为5 nm,绘制系列溶液在不同温度下300~500 nm 的荧光光谱图。
2 结果与讨论
2.1 荧光光谱
由于蛋白质中色氨酸、酪氨酸的存在使其具有内源荧光,当激发波长为282 nm时,BSA在366 nm附近有荧光发射峰。而以同样激发波长激发各浓度PPTP溶液,在366 nm附近则没有荧光,证明在366 nm附近PPTP不会产生与BSA相互干扰的荧光。图2为PPTP对BSA荧光猝灭光谱。
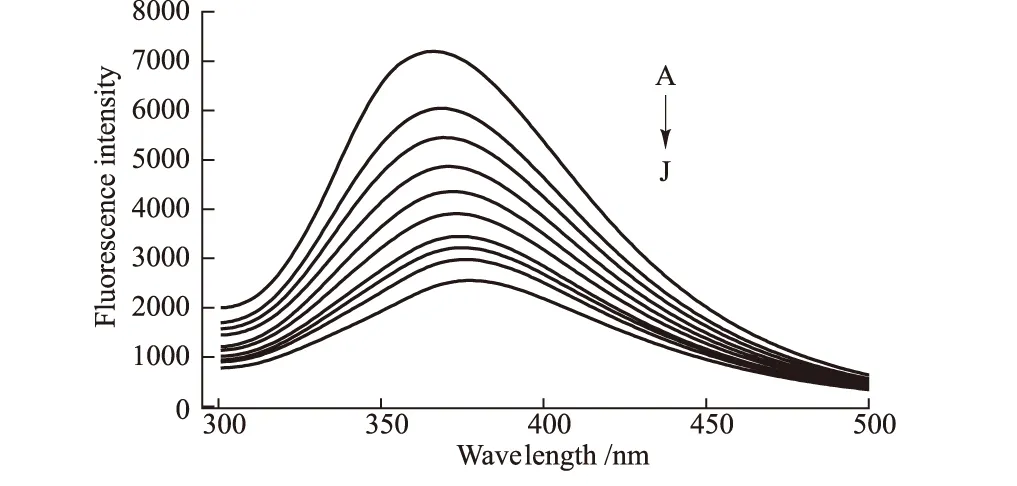
c(BSA)=1×10-5mol·L-1;A→J,PPTP(×10-5mol·L-1):0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5
由图2可知,随着PPTP浓度的增大,BSA 的内源荧光产生有规律的猝灭,且发射波长略有红移。
2.2 猝灭机理
BSA荧光猝灭的原因通常有动态猝灭和静态猝灭两种。动态猝灭是猝灭剂分子与荧光物质的激发态之间有能量转移或电子转移,生成瞬时的激发态复合物而引起的猝灭。动态猝灭的猝灭常数随温度升高而增大,其过程遵循Stern-Volmer方程[8]。
(1)
式中:F、F0分别是有、无猝灭剂时的荧光强度;Kq是双分子猝灭过程速率常数;KSV是Stern-Volmer猝灭常数;τ0是无猝灭剂时生物大分子的平均寿命(生物大分子的平均寿命约为10-8s);cq为猝灭剂浓度。而KSV=Kqτ0,故可由猝灭曲线斜率求得猝灭常数。通常各类荧光猝灭剂对生物大分子的最大动态猝灭速率常数为2.0×1010L·mol-1·s-1。
根据Stern-Volmer 方程,作不同温度下(T=298 K、302 K、306 K和310 K)的[(F0/F)-1]~cq关系图,如图3所示。

图3 不同温度下,[(F0/F)-1]~cq关系
由图3得到298 K、302 K、306 K和310 K时的猝灭速率常数Kq分别为3.631×1012L·mol-1·s-1、3.154×1012L·mol-1·s-1、2.899×1012L·mol-1·s-1、2.565×1012L·mol-1·s-1。显然,4个温度下的猝灭速率常数Kq都远大于2.0×1010L·mol-1·s-1,且随着温度的升高,Kq值减小。表明形成复合物所引起的静态猝灭是引起BSA溶液体系荧光猝灭的主要原因。
2.3 作用力类型
运用公式Lineweaver-Burk双倒数函数关系(式2)[9]探讨PPTP与BSA的静态猝灭作用:
(2)
式中:KLB为静态荧光猝灭结合常数,用于描述静态猝灭过程中生物大分子与猝灭剂的结合反应达到平衡时的量效关系。
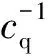

表1 不同温度下PPTP与BSA结合的Lineweaver-Burk常数、相应直线关系
根据Van′t Hoff方程,在温度变化不大时可以近似认为ΔHθ为一常数,由结合常数KLB,求得ΔGθ、ΔHθ、ΔSθ,见表2。

表2 不同温度下,PPTP与BSA结合的热力学参数
活性小分子与生物大分子之间的相互作用力包括氢键、范德华力、静电引力、疏水作用力。根据反应前后热力学焓变ΔHθ和熵变ΔSθ的相对大小,可以判断活性小分子与蛋白质之间的主要作用力类型[9]:ΔHθ>0、ΔSθ>0为疏水作用力;ΔHθ<0、ΔSθ<0为氢键和范德华力;ΔHθ≈0、ΔSθ>0为静电引力。
从表2可以看出,PPTP与BSA的相互作用是自发的(ΔGθ<0);ΔHθ>0、ΔSθ>0,可以认为,PPTP与BSA之间的作用力主要是熵增加驱动的疏水作用力。
2.4 结合常数及结合位点数
静态猝灭过程中,静态猝灭荧光强度与猝灭剂的关系可由荧光-猝灭剂分子间的结合常数表达式导出[10]:
(3)
式中:Ka为猝灭剂与BSA之间的结合常数;n为结合位点数。
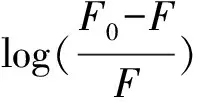

表3 不同温度下的结合常数(Ka)和结合位点数(n)
由表3可知,不同温度下、pH值为7.4时,PPTP与BSA的结合位点数n均接近1,Ka大于10 000 L·mol-1,说明PPTP与BSA两者间有较强结合作用,且形成一个结合位点。
2.5 PPTP对BSA 构象的影响
Δλex=15 nm所得同步荧光光谱反映酪氨酸残基的光谱特性;而Δλex=60 nm所得同步荧光光谱反映色氨酸残基的光谱特性。采用同步荧光技术,固定BSA的浓度,逐渐增加PPTP的浓度,记录Δλex=15 nm 和Δλex=60 nm 时的同步荧光光谱,结果见图4。

c(BSA)=1.0×10-5mol·L-1;A→J,PPTP(×10-5mol·L-1):0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5
由图4可以看出,酪氨酸残基同步荧光光谱(Δλex=15 nm)的最大发射波长基本不变,色氨酸残基同步荧光光谱(Δλex=60 nm)的最大发射波长红移,表明PPTP与BSA发生相互作用后,导致色氨酸近邻区域环境的极性增大,使得处于BSA中疏水区域的色氨酸残基更多地暴露于介质溶液的亲水区,这与荧光光谱的分析结果一致。另外,BSA色氨酸残基所处周围环境由于小分子的插入引起局部构象改变,也可能导致BSA构象的变化。
3 结论
采用荧光光谱法,研究了不同温度下、pH值为7.4时,3-对氯苯基-2-(四氢吡咯-1-基)-5,6,8-三氢吡喃并[3′,4′:4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮(PPTP)与牛血清白蛋白(BSA)的相互作用。结果表明,PPTP主要以静态猝灭方式使BSA荧光强度显著降低;PPTP与BSA之间的作用力主要为疏水作用力;PPTP与BSA之间有较强结合作用,且形成一个结合位点;PPTP与BSA发生相互作用后,导致色氨酸近邻区域环境的极性增大,使得处于BSA中疏水区域的色氨酸残基更多地暴露于介质溶液的亲水区,BSA色氨酸残基所处周围环境由于小分子的插入引起局部构象改变,从而导致了BSA构象的变化。
[1] Rashad A E,Shamroukh A H,Abdel-Megeid R E,et al.Synthesis,reactions,and antimicrobial evaluation of some polycondensed thienopyrimidine derivatives[J].Synthetic Communications,2010,41(40):1149-1160.
[2] Shetty N S,Lamani R S,Khazi I A M.Synthesis and antimicrobial activity of some novel thienopyrimidines and triazolothienopyrimidines[J].J Chem Sci,2009,121(3):301-307.
[3] Carpenter A J,Al-Barazanji K A,Barvian K K,et al.Novel benzimidazole-based MCH R1 antagonists[J].Bioorganic & Medicinal Chemistry Letters,2006,16(19):4994-5000.
[4] Hertzog D L,Witty D R.Biphenyl amides and isosteres as MCH R1 antagonists[J].Current Topics in Medicinal Chemistry,2007,7(15):1455-1470.
[5] Castro A,Jerez M J,Gil C,et al.CODES,a novel procedure for ligand-based virtual screening:PDE7 inhibitors as an application example[J].European Journal of Medicinal Chemistry,2008,43(7):1349-1359.
[6] Alagarsamy V,Meena S,Ramseshu K V,et al.Synthesis,analgesic,anti-inflammatory,ulcerogenic index and antibacterial activities of novel 2-methylthio-3-substituted-5,6,7,8-tetrahydrobenzo (b) thieno[2,3-d]pyrimidin-4(3H)-ones[J].European Journal of Medicinal Chemistry,2006,41(11):1293-1300.
[7] 孙绍发,毛艳平,古文杰.2-烷氨基噻吩并[2,3-d]嘧啶-4(3H)-酮的合成[J].咸宁学院学报,2008,28(3):92-94.
[8] Cyril L,Earl J K,Sperry W M.Biochemists Handbook[M].London:Epon Led Press,1961:84.
[9] Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[10] 邓世星,杨季冬.荧光法研究酚藏花红与牛血清白蛋白的相互作用[J].分析测试学报,2007,26(3):360-364.
