响应面法优化枯草芽孢杆菌BS-1101原生质体制备条件
2011-07-04姚建波吴志军陈志宝
姚建波,吴志军,陈志宝
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
原生质体融合是近年来迅速发展的一项有效的育种技术,通过细胞内染色体遗传物质的转移实现基因重组[1-2]。该技术首先通过酶解作用除去细胞壁,使细胞成为原生质体,然后利用物理、化学或生物手段将两种不同亲株的原生质体融合,使细胞内的遗传物质发生重组交换,并经筛选获得集双亲优良性状于一体的稳定融合子[3]。原生质体融合技术与传统的诱变技术相结合,极大地促进了微生物育种技术的提高。基于原生质体融合的基因组重排技术[4]在育种领域得到广泛的应用[5-6]。
中心组合试验设计(Central Composite Design,CCD)[7]采用科学的试验设计方法,可以减少试验次数并且提高了试验的精密度。响应面分析方法(Response Surface Methodology)[8]是将统计学与数学相结合一种有效的的手段,在微生物、化工、食品、工程等方面有广泛的应用[9-10]。T.Suzuki等人[11]通过析因设计探索了三个不同的因素对(变形杆菌)Prototheca zopfii原生质体制备条件的影响。Muralidhar等人[12]利用响应面设计方法对影响灰黄青霉(Penicillium griseofulvum)原生质体的因素进行了优化,获得了制备其原生质体的最佳条件。Deb等人[13]利用溶菌酶除去枯草芽孢杆菌细胞壁的方法,制备了枯草芽孢杆菌原生质体,并通过原生质体融合的方法,获得了产木聚糖酶的融合子。
通过中心组合试验设计和响应面分析的方法对影响枯草芽孢杆菌BS-1101原生质体形成的关键因素进行优化,为原生质体融合育种方法和基因组重排技术提供参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种
枯草芽孢菌BS-1101:本实验室保存。
1.1.2 培养基
LB培养基:蛋白胨10 g,牛肉膏5 g,NaCl 10 g,琼脂 20 g,加 H2O 定容至 1000 mL,pH7.2,121 ℃灭菌15 min。
发酵培养基成分:葡萄糖20 g,蛋白胨2 g,Na2HPO44 g,KH2PO42 g,MgSO40.5 g,营养琼脂 45 g,加水定容至1000 mL,pH7.2,121℃灭菌15 min。
1.1.3 试剂
溶菌酶(BR):上海生化所
高渗缓冲溶液:称取5.96 g KCl溶于100 mL、pH8.0的磷酸缓冲液中,形成0.8 moL·L-1的高渗缓冲液。
溶菌酶溶液:称取20.0 mg溶菌酶溶于1 mL高渗缓冲液中,0.2 μm过滤除菌。稀释得到不同浓度的溶菌酶溶液。
1.2 实验方法
1.2.1 培养方法
从LB培养基固体斜面挑取一环接入含50 mL发酵培养基的500 mL三角瓶中,37℃恒温培养箱活化12 h,以5%接种量接入50 mL新鲜发酵培养基中,37℃、170 rpm恒温振荡培养8 h进入对数期。
1.2.2 原生质体制备方法[14]
取收集适量对数期菌液,3500 r·min-1条件下离心10 min。弃去上清液,保留菌丝体。用磷酸缓冲液洗涤离心2次,待用。按照CCD试验设计方案用不同的条件的溶菌酶高渗溶液处理一定时间制备原生质体。用去离子水稀释、涂布于发酵固体培养基上,37℃培养36 h,用菌落计数法计算原生质体制备率。
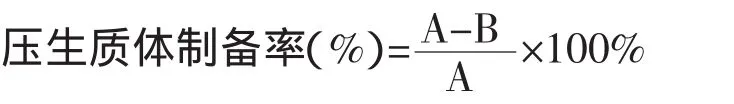
A为溶菌酶处理前培养基上的菌落数;B为溶菌酶处理后培养基上的菌落数;
1.2.3 响应面试验设计
实验选取原生质体制备过程中的酶解温度(X1)、溶菌酶浓度(X2)、酶解时间(X3)三个因素进行考察。对不同因素所选用的水平进行编码,如表1所示:

表1 响应面分析因素及水平Table 1 Variables and their levels for CCD
按照中心组合试验的设计方案,以原生质体制备率(%)为目标,选取3因素5水平的20组试验设计(表2)。利用Design-Expert7.0.0软件作出响应面图和等高线图,并对试验结果结果进行二次回归分析,得到带有交互作用和平方项的回归方程。对模型进行方差分析,找出原生质体的最佳制备条件,并进行实验验证。
2 结果与讨论
2.1 CCD试验结果
中心组合试验共20次试验,结果见表2,利用Design-Expert7.0.0对试验结果进行回归分析并建立二次模型,方差分析结果见表3所示。
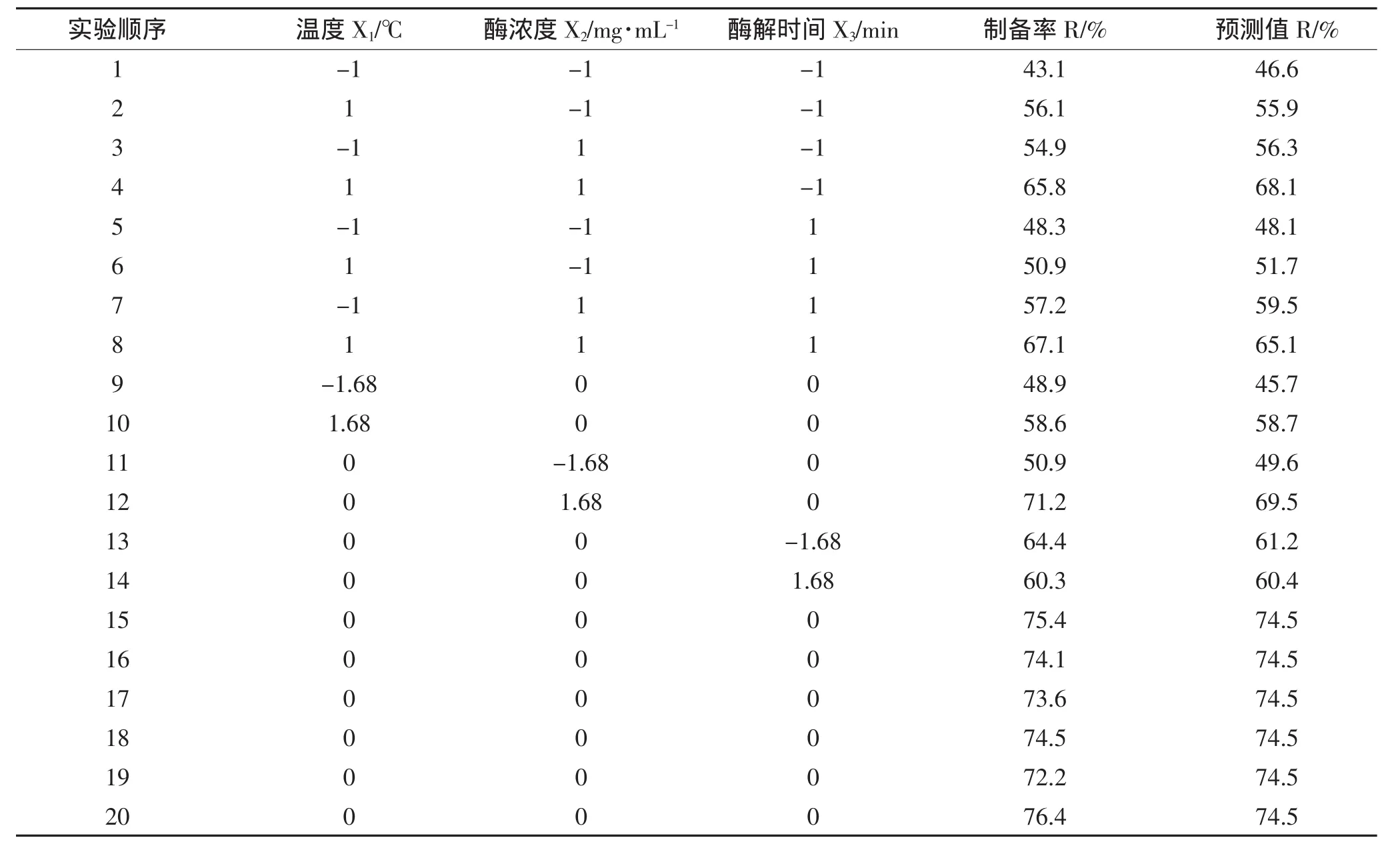
表2 CCD试验设计与结果Table 2 CCD matrix of three variables with experimental values of yield of protoplast

表3 CCD试验设计方差分析结果Table 3 Analysis of variance(ANOVA)for the CCD experimental results
对表2结果进行分析得到如下的二次回归模型为:
R=74.5+3.86A+5.91B-0.241C+0.650AB-1.42AC+0.450BC-7.86A2-5.28B2-4.82C2
从表3可以看出,在选择的试验范围内,该模型显著,失拟项不显著,决定系数R2=0.970说明该模型拟合效果良好,从表3还可以看出,酶解温度(X1)、酶浓度(X2)的一次项及三个因素的平方项都对提取率有显著影响,它们之间的交互作用则不显著。这些也可以从3维响应面图和等高线图(图1~图3)中看出。
2.2 最佳制备条件的优化
根据回归方程,求得最佳制备条件为:X1=0.272;X2=0.576;X3=-0.0391。在此条件下,通过模型预测出最佳制备率为76.7%,实际条件为:酶解温度37.27℃;酶浓度为5.152 mg·mL-1;酶解时间88.8 min。通过实验验证,在此条件下,得到最优制备率为77.02%,与模型预测的最大值非常接近,说明该模型能很好的解释枯草芽孢杆菌BS-1101原生质体实际制备情况。
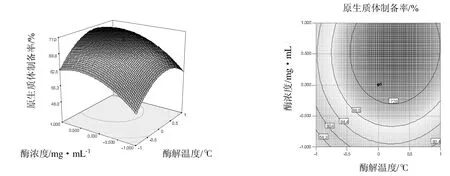
图1 酶浓度与酶解温度对提取率的3维响应面图与等高线图Fig.1 Effects of temperature and enzyme concentration on the protoplast yield
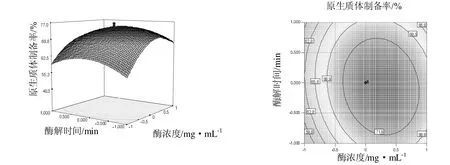
图2 酶浓度与酶解时间对提取率的3维响应面图与等高线图Fig.2 Enzyme concentration and contact time on the protoplast yield
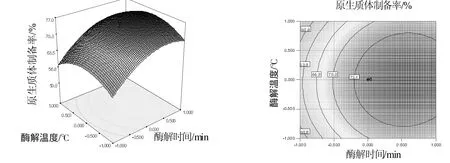
图3 酶解温度与酶解时间对提取率的3维响应面图与等高线图Fig.3 Effects of temperature and contact time on the protoplast yield
3 结论
实验以枯草芽孢杆菌BS-1101原生质体的制备率为考察对象,利用中心组合试验设计与响应面分析方法相结合,优化了枯草芽孢杆菌BS-1101的原生质体制备条件,原生质体的制备率达到77.02%,实验值与模型预测的结果吻合良好,说明响应面法是提高原生质体制备率的有效途径,为进一步进行原生质体融合与基因组重排奠定了基础。
[1]Gokhale D V,Puntambekar U SDeobagkar D N,Protoplast fusion:A tool for intergeneric gene transfer in bacteria[J].Biotechnology Advances,1993,11(2):199-217.
[2]Saul S,Protoplast fusion as a means of producing new industrial yeast strains[J].Biotechnology Advances,1983,1(2):289-300.
[3]Kavanagh KWhittaker P A,Application of protoplast fusion to the nonconventional yeast [J].Enzyme and Microbial Technology,1996,18(1):45-51.
[4]Gong J,Zheng H,Wu Z,et al.,Genome shuffling:Progress and applications for phenotype improvement[J].Biotechnology Advances,27(6):996-1005.
[5]Gong G,Wang C,Chen M,et al.,Genome shuffling to improve the ethanol production of Saccharomyces cerevisiae[J].Journal of Biotechnology,2008,136 (Supplement 1):S311-S312.
[6]Zhang Y,Liu J-Z,Huang J-S,et al.,Genome shuffling of Propionibacterium shermanii for improving vitamin B12 production and comparative proteome analysis[J].Journal of Biotechnology,148(2-3):139-143.
[7]Box G E PWilson K B,Experimental attainment of optimum conditions[J].Journal of the Royal Statistical Society 1951,13:1-45.
[8]Montgomery D C,Design and Analysis of experiments[M].5th ed.2000:John Wiley&Sons,Inc.
[9]Edwards I MJutan A,Optimization and control using response surface methods[J].Comput.Chem.Eng.,1997,21(4):441-453.
[10]Keung W MVallee B L,Kudzu root:An ancient chinese source of modern antidipsotropic agents[J].Phytochemistry,1998,47(4):499-506
[11]Suzuki T,Yamaguchi TIshida M,Effects of some factors on protoplast formation of a microalga,Prototheca zopfii[J].World Journal of Microbiology and Biotechnology,1997,13(3):355-356
[12]Muralidhar R,Gummadi S N,Dasu V V,et al.,Statistical analysis on some critical parameters affecting the formation of protoplasts from the mycelium of Penicillium griseofulvum [J].Biochemical Engineering Journal,2003,16(3):229-235.
[13]Deb J K,Malik S,Ghosh V K,et al.,Intergeneric protplast fusion between xylanase producing Bacillus subtilis LYT and Corynebacterium acetoacidphilum ATCC 21476[J].FEMS Microbiology Letters,1990,71(3):287-292.
[14]Puyet A,Sandoval H,López P,et al.,A simple medium for rapid regeneration of Bacillus subtilis protoplasts transformed with plasmid DNA [J].FEMS Microbiology Letters,1987,40(1):1-5.
