MMP-2和TIMP-2 mRNA在大鼠颈动脉粥样硬化中的动态表达*
2011-06-19王庆林郭向东万光瑞
王庆林, 郭向东, 邵 坤, 贾 娟, 万光瑞
(1.河南职工医学院儿科教研室,郑州451191;2.河南中医学院第一附属医院耳鼻喉科,郑州450000;3.新乡医学院 生理教研室,河南 新乡453003)
细胞外基质合成减少和降解增加是颈动脉粥样硬化(artery atherosclerosis,AS)斑块不稳定主要原因,而基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)是细胞外基质降解的重要因素[1]。本实验通过血管钳夹术和高脂饮食 (钳-脂法)建立大鼠颈AS模型[2],并检测MMP-2和基质金属蛋白酶组织抑制剂-2(tissue inhibitor of metalloproteinase-2,TIMP-2)表达的动态变化,旨在观察斑块生长过程中斑块稳定性的变化。
1 材料与方法
1.1 动物和试剂 健康雄性SD大鼠40只,体重(200±10)g,由新乡医学院实验动物中心提供。主要试剂有 PrimeScriptTMRT-PCR Kit试剂盒、Trizol(大连宝生物工程公司)、PCR引物(由上海生物工程合成)。
1.2 实验动物分组 动物随机分为2组,正常对照组(n=10),喂基础饲料;钳-脂组(n=30),先实施颈总动脉钳夹术,术后高脂饲料喂养(含10%蛋黄、8%猪油、0.2% 丙基硫氧嘧啶、0.5% 胆盐、4.8% 食盐),根据喂养的时间分为3个亚组:喂养2周组(n=10)、喂养6周组(n=10)和喂养10周组(n=10)。所有动物均单笼喂饲,饮水不限,每日每只进食25 g饲料。
1.3 动物模型制备 参考王庆林等的实验方法建立大鼠颈AS模型[2]。实验动物术前12 h禁食,不禁水,腹腔注射水合氯醛(0.3 ml/100 g)麻醉,去毛备皮(颈部下正中),仰卧固定于手术台上。消毒颈部皮肤,沿颈部正中切开皮肤5.0 cm左右,于甲状软骨平面向下分离左侧颈总动脉3.0 cm,使用自制血管钳钳夹一侧颈总动脉,钳夹长度为1.5 cm,强度一扣,时间20 min,缝合皮肤。术后连续3 d每日肌注青霉素80万单位。
1.4 RT-PCR半定量法测定颈总动脉组织中MMP-2、TIMP-2 mRNA表达 实验动物于各时间点处死,取左侧颈总动脉,剥离血管外周结缔组织,加入1 ml Trizol,提取组织中 RNA。分光光度法(A260/A280)检测RNA纯度与含量,置于-70℃保存。
从Gene Bank上下载鼠MMP-2和TIMP-2 mRNA序列全长,利用引物设计软件Primer Premier 5.0设计引物如下:MMP-2(长度434 bp):上游5'-ATGGAGGCACGATTGGTCTG-3',下游 5'-GCAAAGGCATCATCCACTGTC-3';TIMP-2(长度 519 bp):上游 5'-AAAGCAGTGAGCGAGAAGGAG-3',下游 5'-CGGGTCCTCGATGTCAAGAAA-3';对照引物 β-actin(长度 242 bp):上游:5'-ATGGATGACGATATCGCTGCG-3',下 游:5'-TCGTCCCAGTTGGTGACAATG-3'。PCR扩增条件为:94℃预变性2 min,94℃变性45 s,55℃退火1min,72℃延伸1 min,30个循环,最后72℃延伸5 min。用1.8%的琼脂糖凝胶电泳,以Bander leader 3.0凝胶图像处理软件进行灰度分析,以同一样品的β-actin信号值作校正,以对照组的灰度值为1,实验组数据与对照组相比取值。1.5统计学处理数据以均数±标准差(±s)表示,应用SPSS 13.0统计软件进行分析,多组之间显著性检验用方差分析,两两均数比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
RNA样品的A260/A280值均大于1.8,提示样品的纯度较高,RNA无降解,并无明显蛋白质的污染。PCR产物琼脂糖凝胶电泳结果显示,钳-脂各组的MMP-2和TIMP-2 mRNA逐渐增高,与正常对照组相比差异有统计学意义(P<0.05)。MMP-2/TIMP-2 mRNA水平:正常对照组<钳-脂2周组<钳-脂10周组,钳-脂6周组较其他三组低,见表1、图1~2。
表1 大鼠颈总动脉组织MMP-2和TIMP-2 mRNA的表达(±s)
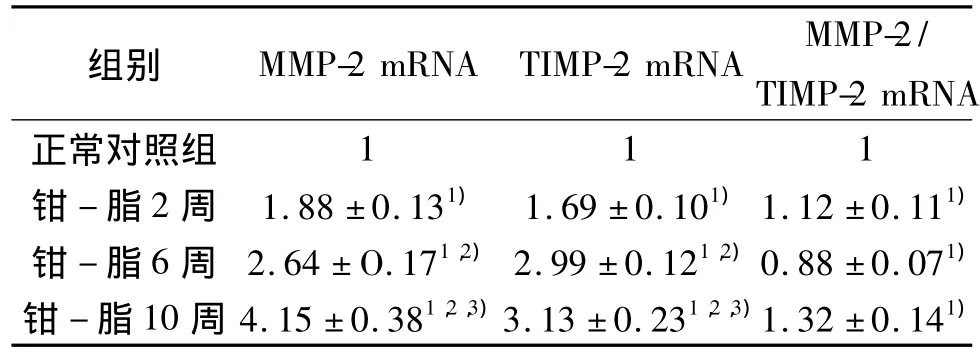
表1 大鼠颈总动脉组织MMP-2和TIMP-2 mRNA的表达(±s)
注:与正常组比较,1)P<0.05;与钳-脂2周比较,2)P<0.05;与钳 -脂6 周比较,3)P <0.05。
TIMP-2 mRNA正常对照组组别 MMP-2 mRNA TIMP-2 mRNA MMP-2/1 1 1钳 -脂2周 1.88±0.131) 1.69 ±0.101)1.12 ±0.111)钳 -脂6 周 2.64 ± O.171,2)2.99 ±0.121,2)0.88 ±0.071)钳 - 脂 10 周 4.15 ±0.381,2,3)3.13 ± 0.231,2,3)1.32 ±0.141)
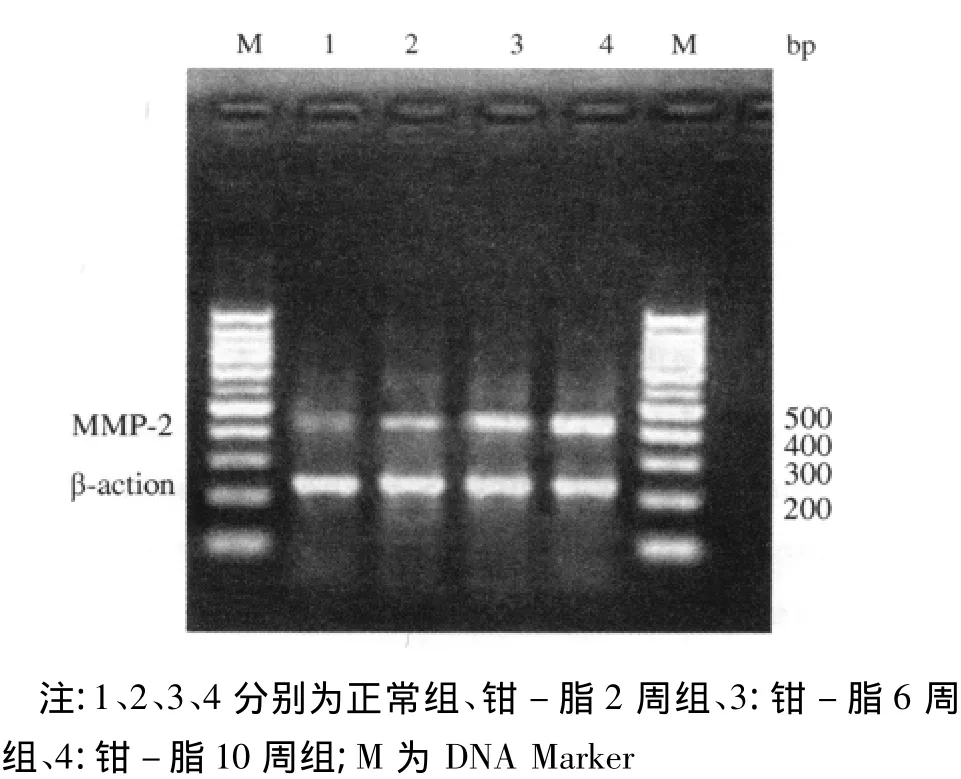
图1 各组大鼠颈总动脉组织MMP-2 mRNA的表达变化
3 讨论
MMPs与TIMPs的平衡共同调节细胞外基质的降解与合成,成为动脉粥样硬化斑块研究的热点,而MMP-2和其内源性特异性抑制因子TIMP-2是关键酶。本实验结果发现:随着 AS的进展,MMP-2 mRNA的表达程度逐渐增强,与已有的研究相一致[3]。有关TIMP的实验不多且结论不一致。有实验显示,动脉粥样硬化TIMP-2的表达减弱[4];另一组实验显示,大鼠去内膜损伤模型的TIMP-2较正常对照组明显增高[5]。本实验RT-PCR结果显示:随着AS的进展,TIMP-2 mRNA的表达逐渐增强。Woessner JF[6]的研究表明:TIMP-2多随MMP-2表达而表达;Turu MM等的研究表明:在MMP-2高表达的同时,TIMP-2表达也有所增加,只是部分抵消了MMP-2增加的活性[7],这些与本实验的结论相一致。TIMPs的高表达可能与机体在各种刺激下,对增生内膜表达MMPs增加的一种代偿性反应有关。
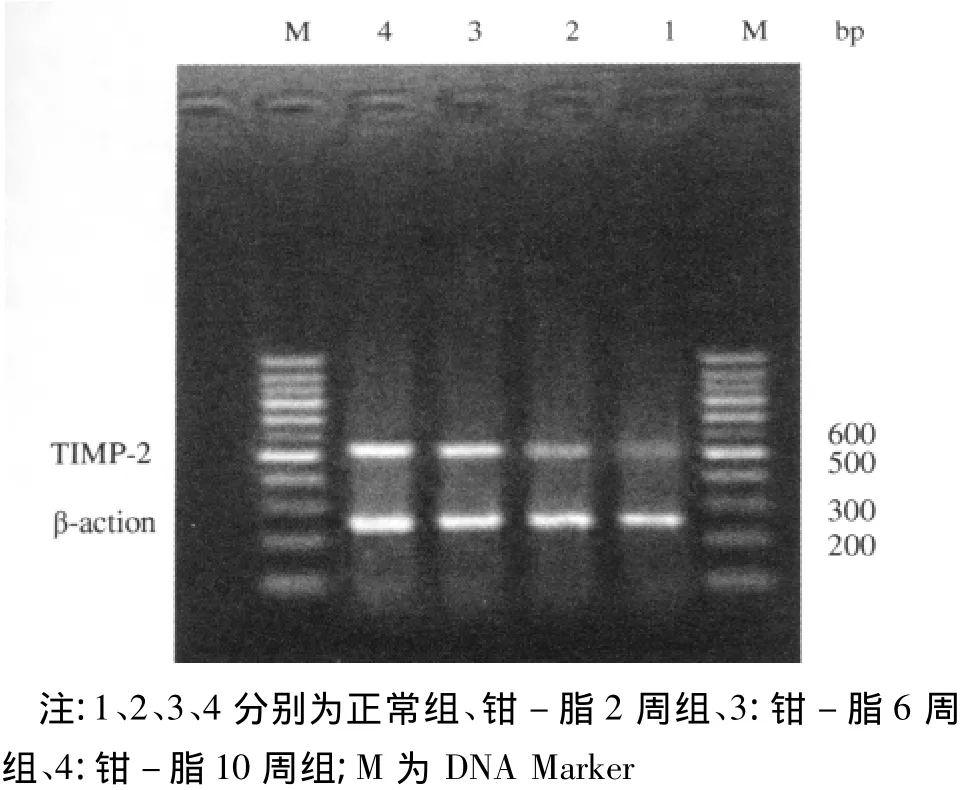
图2 各组大鼠颈总动脉组织TIMP-2 mRNA的表达变化
有关MMPs和TIMPs的大部分研究割裂两者之间的关系,或仅从AS的某一阶段进行研究,未能将MMPs和TIMPs结合起来,从AS的整个过程进行动态研究,结论具有片面性。因此本实验又将RTPCR法半定量数值进行MMP-2/TIMP-2 mRNA处理比较,旨在研究这一对相互抑制的物质,究竟哪一个占主导。该研究发现:MMP-2/TIMP-2 mRNA水平依次为正常对照组<钳-脂2周组<钳-脂10周组,钳-脂6周组较其他三组低。笔者推测MMP-2/TIMP-2 mRNA比例失衡导致AS的机制可能是:在早期,由于多种致AS因素的作用,导致受累血管MMP-2的表达升高,虽特异性抑制物TIMP-2也升高,但不及 MMP-2,导致 MMP-2/TIMP-2比例失衡。虽然基质降解、合成代谢均增强,但降解强于合成,利于中层平滑肌细胞向内膜下的迁移和增殖,造成内膜增厚;在中期,TIMP-2增高的程度超过MMP-2,Jo Y等发现:TIMP-2只有在较高浓度时才会对MMP-2有抑制作用[8],故推测在 6周时可能是TIMP-2达到了较高浓度,抑制明胶酶活性,基质合成强于降解,促进纤维增生,形成纤维增生斑块;到后期,随着 AS的进展,MMP-2增高程度又强于TIMP-2,降解强于合成,促进纤维斑块的降解,致使斑块破裂。
斑块的稳定性是个多因素参与的复杂过程,通过MMPs/TIMPs系统的活性调节延缓动脉粥样硬化的发生、防止斑块破裂,具有重要的临床意义。本实验仅从MMP-2和TIMP-2两个方面进行判断,存在一定的局限性,尚待结合其他分子生物学手段深入研究。
[1]Vigetti,Rizzi M,Viola M,et al.The effects of 4-methylumbelliferone on hyaluronan synthesis,MMP-2 activity,proliferation and motility of human aortic smooth muscle cells[J].Glycobiology,2009,19(5):537-546.
[2]王庆林,陈文捷,万 佳,等.颈总动脉钳夹术加高脂饮食建立大鼠颈动脉粥样硬化模型[J].实用医学杂志,2010,26(4):562-564.
[3]Fiotti N,Xiong W,Giansante C.MMP-2 genetic variant and plaque features of instability[J].Atherosclerosis,2010,210(1):43-44.
[4]Matsumoto T,Watanabe H,Ueno T,et a1.Appropriate doses of granulocyte colony stimulating factor reduced atherosclerotic plaque formation and increased plaque stability in cholesterol-fed rabbits[J].J Atheroscler Thromb,2010,17(1):84-96.
[5]Dollery CM,Libby P.Atherosclerosis and proteinase activation[J].Cardiovasc Res,2006,69:625-635.
[6]Woessner JF.Matrix metalloproteinase inhibition,From the Jurassic to the third millennium[J].Ann N Y Acad Sci,2008,878:388-403.
[7]Turu MM,Krupinski J,Catena E,et a1.Intraplaque MMP-8 levels are increased in asymptomatic patients with carotid plaque progression on ultrasound[J].Atberoscl Erosis,2006,187(1):161-169.
[8]Jo Y,Kim HJ.Analysis of tissue inhibitor of metalloproteinase-2 effet on promatrix metalloproteinas-2 activation by membrane type 1 Matrix Metalloproteinas using baculovirus insect expressionsystem[J].Biochem J,2008,345:511-519.
