低浓度亚硝酸钠预处理对乙醇损伤PC12细胞的保护作用
2011-06-09李延红周占业皇甫超申
李延红,周占业,史 齐,皇甫超申
(河南大学医学院环境医学研究所,河南开封 475004)
人体亚硝酸盐不仅是一氧化氮(nitric oxide,NO)代谢过程中的一种惰性产物[1],而且在细胞信号传导以及维持内环境NO稳态中起重要的作用[2]。通常情况下,组织氧含量正常,体内NO由一氧化氮合成酶(nitric oxide synthase,NOS)产生;但是在组织缺氧时,体内NO则来自于亚硝酸盐还原途径[3]。有实验证实低浓度的亚硝酸盐及其还原产生的NO共同通过抑制细胞线粒体活性氧(Reactive oxygen species,ROS)的产生、减少氧的消费、激活NO/cGMP通路等一系列事件发挥细胞保护、血管再生、舒张血管的功能,从而拮抗缺血/再灌注(ischemia-reperfusion,I/R)诱导的组织损伤[4]。低剂量亚硝酸钠不仅对细胞无明显毒害,而且对细胞增殖有促进作用[5]。乙醇对脑组织的损伤主要是通过ROS实现的,从理论上分析,用低浓度的亚硝酸盐预处理,神经元可以拮抗乙醇诱导的细胞凋亡。为此,本实验选用大鼠嗜铬细胞瘤细胞(rat pheochromoeytoma cells,PC12)[6]探讨亚硝酸盐对乙醇诱导的细胞过氧化损伤的拮抗作用,为科学评价亚硝酸盐药理作用提供实验依据。
1 材料与方法
1.1主要试剂与仪器
1.1.1主要试剂PC12细胞系购自中国医学科学院基础医学研究所。亚硝酸钠(NaNO2),天津市晨福化学试剂厂(分析纯);DMEM培养基(Gibco,with high glucose);胎牛血清,杭州四季青生物公司产品;一氧化氮清除剂c-PTIO(2-(4-carboxyphenyl)-4,4,5,5-tetramathylimidazoline-1-oxyl-3-oxide)、二甲基亚砜(DMSO)、噻唑蓝(MTT)、Hoecheste 33258 和PI购自Sigma公司。FITC-AnnexinⅤ/PI细胞凋亡检测试剂盒购于美国Bender公司;可见光法测丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)含量,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力测定试剂盒购自南京建成生物工程研究所。兔抗Caspase-3、Caspase-9多克隆抗体,Bcl-2、Bax单克隆抗体(Santa Cruz生物技术公司)。β-actin抗体、兔抗 HIF-1α抗体、enhanced chemiluminescence(ECL)显色试剂盒、辣根过氧化物酶标记的羊抗兔IgG(HRP-polymer goat anti-rabbit IgG)(碧云天公司)。
1.1.2主要仪器Multiskan MK3型酶标仪(赛默飞世尔仪器有限公司)。FACS Salibur流式细胞仪(BD,美国);BX51荧光显微镜(OLYMPUS,日本);UV-540紫外-可见分光光度计(UNICAM,美国)。DYY-7C型电泳仪(北京市六一仪器厂)。WD-9413B凝胶成像分析仪(北京市六一仪器厂)。
1.2方法
1.2.1细胞培养PC12细胞培养于含体积分数为10%的灭活胎牛血清、青霉素(1×105IU·L-1)和链霉素(100 mg·L-1)的DMEM培养液中,培养温度为37℃,含5% 二氧化碳(CO2)的细胞培养箱,取对数生长期的细胞进行实验,以0.25% 胰蛋白酶消化传代,调整细胞数为1×107·L-1,备用。
1.2.2实验分组及处理预处理PC12细胞的亚硝酸钠浓度选用课题组前期MTT结果,即亚硝酸钠最低促PC12细胞增殖效应(高于对照组15%)浓度为 0.14 mmol·L-1,预处理时间为 24 h[7]。实验分4组:对照组加等量培养液;单纯乙醇处理组加400 mmol·L-1(IC50值)乙醇作用 2 h;预处理组先用0.14 mmol·L-1亚硝酸钠预处理 24 h,再加 400 mmol·L-1乙醇作用 2 h;NO 清除组用0.14 mmol·L-1亚硝酸钠和 40 μmol·L-1c-PTIO 共同预处理24 h,再加 400 mmol·L-1乙醇作用 2 h。
1.2.3MTT法检测细胞增殖活力取1×107·L-1PC12细胞接种到96孔细胞培养板(每孔0.2 ml)培养24 h后换液,按照实验分组经不同处理后,每孔加入20 μl MTT,4 h后,吸去培养液,每孔加入150 μl DMSO于振荡器上振摇,待蓝色晶体完全溶解后,在酶标仪上测定570 nm处的吸光度值(A值)并计算细胞活力。以含有等体积的培养液和DMSO的无细胞孔测得的A为空白对照。实验重复3次,结果取平均值。细胞活力/%=(处理组A值/对照组A值)×100%。
1.2.4Hoechst 33258/PI活细胞联染判定细胞生存状态将对数生长期细胞以1×107·L-1浓度接种于预置盖玻片的6孔培养板中,按实验分组处理后,倾去培养液,预冷PBS洗3次,特异结合DNA的荧光染料Hoechst 33258和PI进行活细胞联染。加Hoechst 33258 10 mg·L-1及 PI 10 mg·L-1,37℃染色15 min后,紫外光激发,荧光显微镜观察,电荷耦合器拍片。活细胞呈蓝色,凋亡细胞呈亮白色,坏死细胞呈红色。荧光显微镜下随机选择5个视野,每张爬片计数细胞不少于1 000个,实验重复3次,以凋亡细胞数与总细胞数比值的百分数表示细胞凋亡率。
1.2.5流式细胞术测定细胞凋亡采用FITC-AnnexinⅤ/PI双染法,分别收集各组细胞到10 ml的离心管中,每样本细胞数为1×109·L-1,1 000×g离心5 min,弃去培养液,用孵育缓冲液洗涤1次,1 000×g离心5 min,用100 μl的标记溶液重悬细胞,室温下避光孵育15 min,1 000×g离心5 min,沉淀细胞用孵育缓冲液洗1次,加入FITC-AnnexinⅤ/PI溶液5 μl 4℃下孵育20 min,最后补PBS 400 μl,以流式细胞仪检测细胞凋亡情况,每个样品检测1万个细胞,用Cellquest软件进行细胞凋亡分析。
1.2.6脂质过氧化产物与抗过氧化酶活力或含量的测定对数生长期细胞以1×107·L-1浓度接种于培养瓶中,培养至对数生长期,按实验分组处理后,收集细胞,按照试剂盒说明书,采用比色法测定细胞内SOD、CAT活力和GST-Px、MDA含量。实验重复3次,结果取平均值。
1.2.7Western blot检测相关蛋白表达细胞于对数生长期进行分组处理,作用24 h后用RIPA 200 μl充分裂解提取蛋白,考马斯亮蓝G-250法测样品蛋白浓度,均衡每组蛋白浓度后,以12%SDS-PAGE凝胶电泳分离。电转移蛋白至NC膜,5%脱脂奶粉封闭过夜,加入各种一抗(1∶200)于4℃封闭袋中孵育过夜,二抗(辣根过氧化物酶标记的羊抗鼠抗体,1∶4 000)孵育1 h。化学发光法显示结果,压片曝光。凝胶图像分析系统拍照,检测蛋白质印迹条带。
1.3 统计学分析数据均采用±s表示,应用SPSS 13.0软件包处理,进行直线相关分析,t检验,单因素方差分析及LSD-t检验。
2 结果
2.1亚硝酸钠预处理对PC12细胞增殖活力的影响由Fig 1可见:单纯乙醇处理组细胞增殖活力与对照组相比明显下降(P<0.05);预处理组细胞增殖活力与单纯乙醇作用组相比明显增加(P<0.05);NO清除组细胞增殖活力与预处理组相比有所下降(P<0.05)。
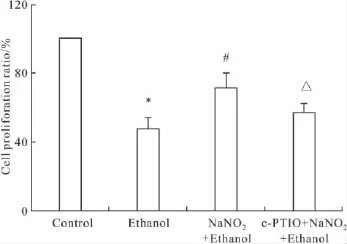
Fig 1 Cell viability in PC12 cells pretreated 0.14 mmol· L-1 NaNO2for 24 h,then exposed to ethanol for additional 2 h(±s,n=3)
2.2亚硝酸钠预处理对乙醇损伤PC12细胞生存状态的影响Fig 2所示,正常活细胞核呈蓝色,染色均一;坏死的细胞核肿大,呈红色;凋亡的细胞核固缩,染色质凝集,呈亮白色。对照组(Fig 2A)细胞生存状态良好,有少数细胞死亡,死亡率约(1.58±0.33)%;单纯乙醇处理组(Fig 2B)有大量细胞坏死和凋亡,两者占死亡细胞的比例基本相同,计数细胞死亡率为 (52.4±6.84)%,明显高于空白对照组(P<0.05);预处理组(Fig 2C)坏死细胞明显减少,细胞死亡的主要形式是细胞凋亡 ,计数死亡率为(28.1±3.74)% ,与单纯用乙醇处理组相比 ,死亡率明显减少(P<0.05)。NO清除组(Fig 2D)细胞凋亡率为(37.98±4.19)%,与预处理组相比凋亡和坏死细胞有所增加(P<0.05,Fig 2E)。
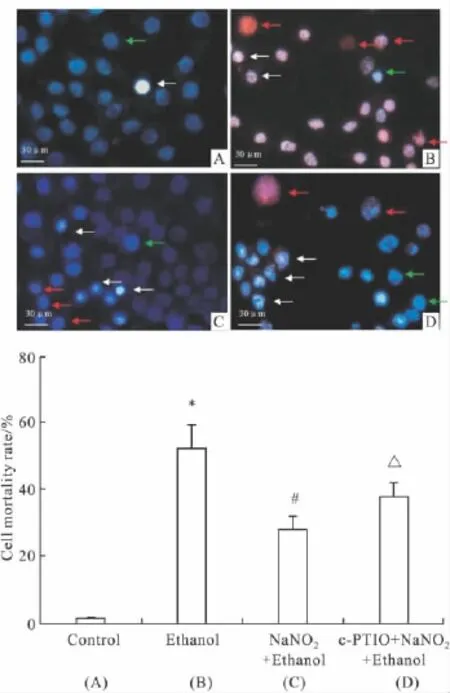
Fig 2 0.14 mmol·L-1NaNO2preconditioning inhibited PC12 cells death induced by high dose ethanol(±s,n=3)
2.3亚硝酸钠预处理对乙醇损伤PC12细胞凋亡的拮抗作用流式细胞术检测结果如Fig 3,NaNO2预处理对乙醇损伤的PC12细胞凋亡拮抗的统计结果见Fig 3E。对照组(Fig 3A)有少量细胞凋亡;单纯乙醇处理组(Fig 3B)有大批细胞凋亡,与对照组相比差异有显著性(P<0.05);预处理组(Fig 3C)细胞凋亡率与单纯用乙醇处理组相比明显减少(P<0.05);NO清除组(Fig 3D)细胞凋亡率与预处理组相比有所增加(P<0.05)。
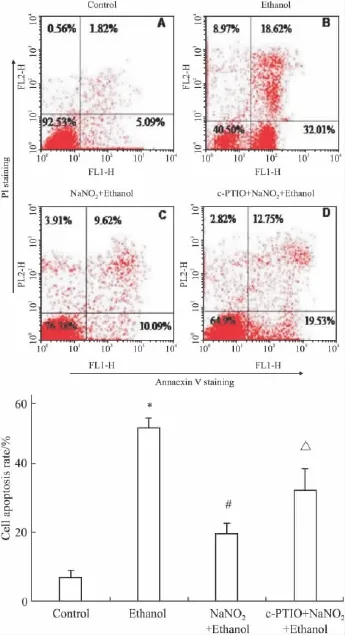
Fig 3 Inhibition of ethanol-treated apoptosis of PC12 cell by NaNO2preconditioning(±s,n=3)
2.4亚硝酸钠预处理对乙醇损伤PC12细胞MDA含量和抗氧化酶活性的影响Tab 1所示,单纯乙醇处理组与对照组相比,细胞内 CAT、SOD活性GSH-Px含量明显降低,MDA含量升高(P<0.05);预处理组与单纯乙醇处理组相比,细胞内CAT、SOD活性和GSH-Px含量明显升高(P<0.05),而MDA含量明显下降(P<0.05)。NO清除组与预处理组相比,细胞内CAT、SOD活性和GSH-Px含量明显降低,MDA含量升高(P<0.05)。
Tab 1 Effect of NaNO2preconditioning on the contents of antioxidant enzyme and MDA in ethanol injury PC12 cells(±s,n=3)
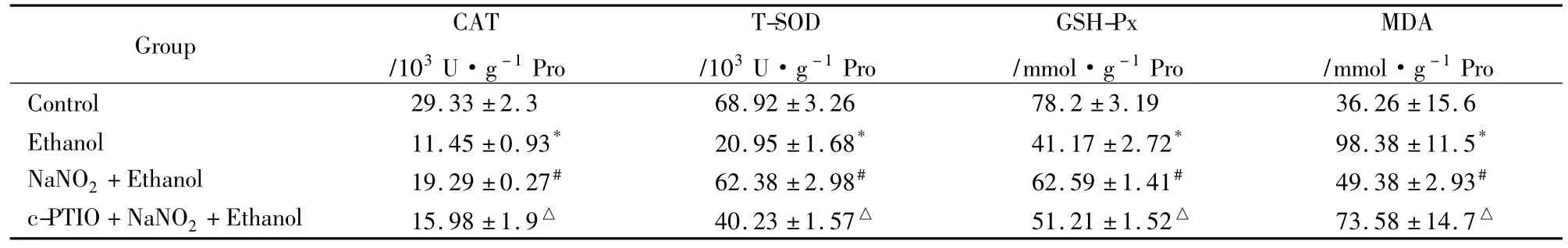
Tab 1 Effect of NaNO2preconditioning on the contents of antioxidant enzyme and MDA in ethanol injury PC12 cells(±s,n=3)
*P<0.05 vs control;#P<0.05 vs Ethanol group;△P<0.05 vs NaNO2+Ethanol group
Group CAT/103U·g-1Pro T-SOD/103U·g-1Pro GSH-Px/mmol·g-1Pro MDA/mmol·g-1Pro Control 29.33 ±2.3 68.92 ±3.26 78.2 ±3.19 36.26 ±15.6 Ethanol 11.45 ±0.93* 20.95 ±1.68* 41.17 ±2.72* 98.38 ±11.5*NaNO2+Ethanol 19.29 ±0.27# 62.38 ±2.98# 62.59 ±1.41# 49.38 ±2.93#c-PTIO+NaNO2+Ethanol 15.98 ±1.9△ 40.23 ±1.57△ 51.21 ±1.52△ 73.58 ±14.7△
2.5亚硝酸钠预处理对乙醇诱导PC12细胞线粒体凋亡途径相关蛋白表达水平的影响Fig 4显示:单纯乙醇处理组与对照组相比,细胞促凋亡蛋白Bax、Caspase-9、Caspase-3 表达增加,而凋亡抑制蛋白Bcl-2表达减少(P<0.05);预处理组与单纯乙醇处理组相比,Bax、Caspase-9、Caspase-3表达量下降,而Bcl-2表达量增加(P<0.05);NO清除组与预处理组相比,Bax、Caspase-9、Caspase-3表达量有所增加,而Bcl-2表达量有所减少(P<0.05)。
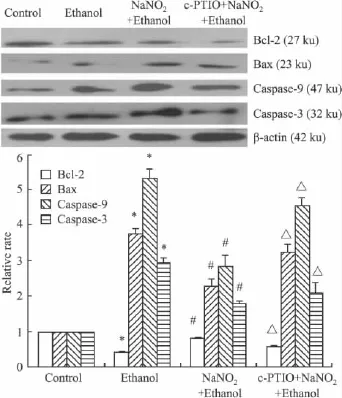
Fig 4 The Caspase-9/Caspase-3 signal pathway involved in PC12 cells apoptosis induced by NaNO2preconditioning and then exposed to 400 mmol·L-1ethanol(±s,n=3)
2.6NaNO2预处理对乙醇损伤PC12细胞HIF-1α蛋白表达的影响Fig 5显示:乙醇处理组细胞HIF-1α表达量与对照组相比有所增加(P<0.05);预处理组HIF-1α表达量较乙醇组相比明显增加(P<0.05);NO清除组HIF-1α表达量较预处理组有所下降(P<0.05)。
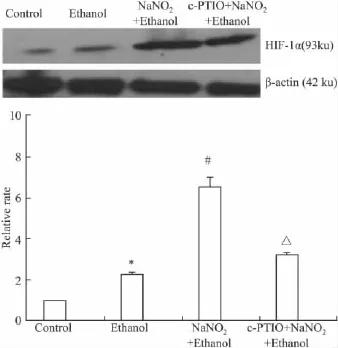
Fig 5 Expression of HIF-1α in PC12 cells induced by NaNO2preconditioning for 24 h then exposed to ethanol for 2 h(±s,n=3)
3 讨论
本课题MTT结果显示,先用0.14 mmol·L-1NaNO2预处理组,较单纯乙醇处理的PC12细胞的活力明显增加。流式细胞术结果显示,NaNO2预处理明显拮抗乙醇诱导的PC12细胞凋亡。荧光染色细胞核形态观察也佐证了上述现象。当培养体系内NO被清除后,上述低剂量NaNO2预处理对乙醇损伤PC12细胞的保护作用一定程度上被抑制。结果提示,亚硝酸盐及其还原的NO共同参与了乙醇损伤PC12细胞的保护作用。
NaNO2预处理对乙醇损伤PC12细胞保护作用可能与下列因素有关:①ROS产生减少:线粒体是ROS产生的主要场所,也是乙醇作用的靶点。乙醇经线粒体细胞色素P450代谢时,伴随产生大量的氧自由基(O-2、H2O2等),引起脂质过氧化反应,通过线粒体途径启动细胞凋亡,导致细胞损伤[8]。亚硝酸盐或NO作用的靶点是线粒体呼吸链复合物I和IV,通过对靶点的抑制,减少乙醇处理时细胞ROS的产生[9]。②ROS清除增加:亚硝酸盐或其来源的NO提高了细胞抗氧化酶活性。实验结果显示,NaNO2预处理的细胞,当遇到乙醇处理时,细胞内CAT、SOD活性和GSH-Px含量明显升高,这样由乙醇处理细胞产生的ROS就会较多的被清除,从而减轻了乙醇对细胞的损伤。③抑制线粒体凋亡途径:亚硝酸盐还原为NO,NO与细胞色素C氧化酶相互作用,使细胞色素C释放减少,这样乙醇诱导的线粒体凋亡途径一定程度上被抑制,拮抗细胞凋亡,进而发挥细胞保护作用[10]。本课题通过对线粒体通路相关分子研究发现,NaNO2预处理,明显逆转乙醇导致的Bax、Caspase-9、Caspase-3升高和Bcl-2降低,NO特异性抑制剂c-PTIO可部分抑制这一现象。结果提示,亚硝酸盐及其还原的NO参与了乙醇诱导的细胞线粒体凋亡拮抗作用[11]。
缺氧诱导因子-1(HIF-1)是细胞适应缺氧而产生的一种核转录因子,通过上调糖转运和糖酵解酶的相关基因,使细胞在低氧或氧化应激时存活下来[12],除缺氧外,其他如生长因子、激素、NO 等因子皆可导致HIF-1在细胞内积累[13]。本实验结果显示,低剂量NaNO2具有促进细胞HIF-1α累积的作用,这样亚硝酸盐预处理的细胞就有可能通过HIF-1途径发挥细胞保护作用[14]。
综上所述,亚硝酸钠通过提高PC12细胞抗氧化酶活性、促进HIF-1积累,进而使细胞获得了拮抗乙醇诱导的线粒体途径凋亡的能力。
[1]Fujita K,Wada K,Nozaki Y,et al.Serum nitric oxide metabolite as a biomarker of visceral fat accumulation:clinical significance of measurement for nitrate/nitrite[J].Med Sci Monit,2011,17(3):123-31.
[2]Bryan N S,Fernandez B O,Bauer S M,et al.Nitrite is a signaling molecule and regulator of gene expression in mammalian tissues[J].Nat Chem Biol,2005,1(5):290 -7.
[3]Weitzberg E,Hezel M,Lundberg J O.Nitrate-nitrite-nitric oxide pathway:implications for anesthesiology and intensive care[J].Anesthesiology,2010,113(6):1460 -75.
[4]Jung K H,Chu K,Lee S T,et al.Effects of long term nitrite therapy on functional recovery in experimental ischemia model[J].Biochem Biophys Res Commun,2010,403(1):66 -72.
[5]张付利,厉永强,史 齐,等.亚硝酸钠对人肝癌细胞增殖与凋亡的影响[J].中国药理学通报,2011,27(2):191 -5.
[5]Zhang F L ,Li Y Q,Shi Q,et al.Effects of sodium nitrite on proliferation and apoptosis on human hepatocarcinoma cells[J].Chin Pharmacol Bull,2011,27(2):191 -5.
[6]Wu J,Sun J,Xue Y.Involvement of JNK and p53 activation in G2/M cell cycle arrest and apoptosis induced by titanium dioxide nanoparticles in neuron cells[J].Toxicol Lett,2010,199(3):269-76.
[7]李延红,史 齐,石贞玉,等.低剂量亚硝酸钠预适应对过氧化氢损伤PC12细胞的保护作用[J].中国病理生理杂志,2010,26(4):802-8.
[7]Li Y H,Shi Q,Shi Z Y,et al.Cytoprotective role of low-dose nitrite preconditioning against H2O2induced damage in PC12 cells[J].Chin J Athophysiol,2010,26(4):802 -8.
[8]Cho K H,Lee S M.Altered activity of cytochrome P450 in alcoholic fatty liver exposed to ischemia/reperfusion[J].Arch Pharm Res,2007,30:50 -7.
[9]Raat N J,Shiva S,Gladwin M T.Effects of nitrite on modulating ROS generation following ischemia and reperfusion[J].Adv Drug Deliv Rev,2009,61(4):339 -50.
[10]Shiva S.Mitochondria as metabolizers and targets of nitrite[J].Nitric Oxide,2010,22(2):64 -74.
[11]Rhenals M V,Strasberg-Rieber M,Rieber M,et al.Nitric oxide donors or nitrite counteract copper-[dithiocarbamate](2)-mediated tumor cell death and inducible nitric oxide synthase down-regulation:possible role of a nitrosyl-copper[dithiocarbamate](2)complex[J].J Med Chem,2010,53(4):1627 -35.
[12]姚 娟,马慧萍,杨 燕,等.缺氧环境对PC12细胞损伤及HIF-1 mRNA表达水平的影响[J].中国药理学通报,2011,27(2):162-6.
[12]Yao J,Ma H P,Yang Y,et al.Anoxic injury and HIF-1 mRNA expression changes after hypoxia in PC12 cell[J].Chin Pharmacol Bull,2011,27(2):162 -6.
[13]Kim J W,Gao P,Liu Y C,et al.Hypoxia inducible factor 1 and dysregulated c-Myc cooperatively induce vascularendothelial growth factor and metabolic switches hexokinase and pyruvate dehydrogenase kinase 1[J].Mol Cell Biol,2007,27:7381 -93.
[14]Zaouali M A,Ben Mosbah I,Boncompagni E,et al.Hypoxia inducible factor-1alpha accumulation in steatotic liver preservation:role of nitric oxide[J].World J Gastroenterol,2010,16(28):3499-509.
