顺铂降低铜离子转运蛋白1表达诱导人食管鳞癌细胞耐药
2011-06-09陈明辉古春萍李亦蕾曹之宪刘叔文
余 乐,陈明辉,古春萍,李亦蕾,曹之宪,刘叔文
(南方医科大学1.药学院、2.附属南方医院药学部,广东广州 510515;3.香港中文大学生物医学学院,香港)
食管癌是一种常见的恶性肿瘤,发病率在我国居恶性肿瘤的第4位。西方国家食管癌患者主要组织学类型是食管腺癌,而我国绝大部分是食管鳞癌[1]。我国的中部地区,包括河南省和山西省,据报道是世界上食管鳞癌发病率最高的地区[2]。对于局部食管癌患者,手术切除是首选的治疗方案。然而临床上近50%的食管癌患者在确诊时已有转移,这些患者则主要依赖于化学治疗[3-4]。化疗的效果取决于肿瘤细胞对化疗药物的敏感性。然而,在接受化疗的过程中,食管鳞癌细胞往往对化疗药物产生耐药性,最终导致化疗的失败。尽管对于肿瘤细胞耐药性的产生已开展了深入的研究,但是耐药性产生的机制以及如何克服耐药性的产生从而提高化疗效果,仍有待进一步阐明。本研究通过浓度梯度递增法诱导出了对顺铂耐药的人食管鳞癌细胞HKESC-1/cis,测定了耐药细胞及其亲代细胞的生长曲线,观察了顺铂处理后耐药细胞和亲代细胞对顺铂的蓄积以及Pt-DNA加合物的形成是否存在差异,并进一步探讨了顺铂耐药性产生的机制,以期为临床上逆转肿瘤细胞耐药提供实验依据。
1 材料与方法
1.1材料MEM培养基购自美国Hyclone公司。胎牛血清、青霉素、链霉素和胰酶购自美国Invitrogen公司。检测铜离子转运蛋白(copper transporter 1,CTR1)的抗体购自美国Santa Cruz公司。检测β-actin的抗体、二抗、ECL发光试剂,购自美国Cell Signaling公司。Wizard Genomic DNA Purification Kit购自美国Promega公司。SDS-PAGE的仪器和试剂来自美国Bio-Rad公司。其他试剂均购自美国Sigma公司。
1.2细胞培养及耐药细胞株HKESC-1/cis建立人食管鳞癌细胞株HKESC-1由香港大学病理系Srivastava G教授馈赠。细胞在MEM培养基,含体积分数为10%胎牛血清,100 kU·L-1青霉素和100 mg·L-1链霉素,37℃,5%CO2,饱和湿度培养箱中培养,0.25%胰酶消化传代。采用浓度梯度递增法诱导耐药株:HKESC-1细胞接种于含0.1 μmol·L-1顺铂的培养基持续培养,部分细胞死亡,存活细胞缓慢生长,稳定后增加药物剂量,从0.1、0.5、1、2、5 直至10 μmol·L-1,经 6 个月诱导而成,命名为HKESC-1/cis。在诱导过程中,若出现80%以上的细胞死亡,则弃去含药培养基,加入新鲜培养基继续培养,待其恢复对数生长后继续使用药物诱导。
1.3MTT法检测顺铂对细胞的杀伤作用并计算IC50取对数生长期的细胞,以6 000/孔接种于96孔板中,培养24 h,吸弃培养基,加入不同浓度的顺铂孵育48 h。吸弃含药培养基,加入MTT(终浓度为0.5 g·L-1)继续培养4 h后吸尽培养基,加入DMSO使MTT还原产物完全溶解。酶联免疫检测仪在570 nm波长处检测OD值。半数抑制浓度IC50通过Prism 4.0统计软件计算。
1.4电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)检测细胞内顺铂含量和Pt-DNA加合物的形成ICP-MS通过检测样品中铂(Pt)的含量来直接反映顺铂的含量。检测细胞内顺铂的方法参考文献报道[5-6]并做了部分修改。取对数生长期的细胞,以2×105/孔接种于6孔板中,培养24 h。顺铂(30 μmol·L-1)处理细胞2 h后,用冷PBS缓冲液冲洗细胞5次以充分洗去细胞外的顺铂。加215 μl 70%的硝酸到各孔直接裂解细胞。收集裂解液至EP管并于65℃下溶解2 h。检测前用去离子水将样品中的硝酸稀释至10%。细胞内顺铂含量用细胞总蛋白做归一化。
对于Pt-DNA加合物形成的检测,取对数生长期的细胞,以1×106/孔接种于10 cm的培养皿中,培养24 h。顺铂(30 μmol·L-1)处理细胞2 h后,用冷PBS缓冲液冲洗细胞5次以充分洗去细胞外的顺铂。按说明书用Wizard Genomic DNA Purification Kit提取基因组 DNA并定量 DNA含量。将DNA溶解在 70 μl去离子水中,然后加入 215 μl 70%的硝酸,样品于65℃下溶解2 h。检测前用去离子水将样品中的硝酸稀释至10%。Pt-DNA加合物的形成用DNA量做归一化。Pt含量使用Thermo X SeriesⅡICP-MS检测。1 ppb铟作为内参监测检测过程中仪器的稳定性。
1.5Western blotRIPA缓冲液裂解细胞提取总蛋白。RIPA缓冲液的配制及其含有的蛋白酶和磷酸酶抑制剂配方参看我们以前的描述[7]。BCA测定蛋白浓度后,以50 μg总蛋白量上样后SDS-PAGE电泳,然后用湿法转膜转印至醋酸纤维素膜,5%脱脂牛奶室温封闭1 h,一抗4℃孵育过夜,洗膜,加二抗,室温孵育1 h,洗膜,ECL发光,显影,定影。
1.6 统计学分析数据以±s比较表示,应用Prism 4.0软件进行统计学分析。两组间比较采用t检验。
2 结果
2.1顺铂抗性细胞株HKESC-1/cis的建立采用浓度梯度递增的方法对HKESC-1细胞株进行体外诱导,得到人食管鳞癌耐药细胞株HKESC-1/cis。耐药细胞呈多边形上皮样生长,形态与亲代细胞没有明显的区别。连续培养HKESC-1和HKESC-1/cis细胞7 d,然后MTT法测定细胞的生长曲线。结果表明耐药细胞和亲代细胞体外增殖速度相似,没有差别。MTT法测得HKESC-1细胞对顺铂的IC50为(4.5 ±0.2)μmol·L-1,而 HKESC-1/cis细胞对顺铂的 IC50增加至(12.9 ±0.4)μmol·L-1,其耐药指数为2.9(Fig 1)。并且HKESC-1/cis细胞在无顺铂的培养基中培养4个月,通过定期测定其对顺铂的IC50,我们发现该细胞稳定的保持着对顺铂的耐药性。

Fig 1 Cell viability curves of cisplatin-resistant cell line HKESC-1/cis and its parental counterpart HKESC-1 following 48-h exposure to cisplatin as determined by MTT assay
2.2HKESC-1/cis细胞内顺铂的含量以及Pt-DNA加合物形成均低于其亲代细胞顺铂在肿瘤细胞内的蓄积,是细胞对顺铂是否敏感的决定因素[8]。为了准确检测细胞内顺铂的含量,需要保证细胞膜的完整以免因为细胞膜的破损而干扰实验结果。我们采用顺铂短时间(2 h)处理细胞的方案[9],该条件下通过显微镜观察,细胞形态完整,与对照组比较没有区别。我们比较了顺铂耐药细胞HKESC-1/cis与其亲代细胞HKESC-1在顺铂处理后细胞内顺铂的含量,结果表明耐药细胞的胞内顺铂蓄积低于其亲代细胞(P<0.01,Fig 2A)。
顺铂发挥其细胞毒作用主要通过与肿瘤细胞的DNA结合生成Pt-DNA加合物,引起DNA损伤而抑制细胞增殖,并进一步引起细胞凋亡[10]。因此,我们比较了顺铂耐药细胞HKESC-1/cis与其亲代细胞HKESC-1在顺铂处理后细胞内Pt-DNA加合物的形成,结果表明顺铂耐药细胞Pt-DNA加合物的形成低于其亲代细胞(P<0.01,Fig 2B)。
2.3HKESC-1/cis细胞CTR1表达降低由于顺铂的分子极性高,胞外顺铂不容易扩散穿过细胞膜进入细胞内。CTR1是主要的铜输入转运体(copper influx transporter)。研究已发现CTR1不仅介导胞外铜离子转运至胞内,而且参与顺铂转运至细胞内[11-13]。考虑到顺铂耐药,细胞内顺铂的蓄积较其亲代细胞有明显的下降,我们推测可能与胞外顺铂进入胞内的过程受到抑制有关。为此,我们检测了顺铂耐药细胞HKESC-1/cis和其亲代细胞HKESC-1的CTR1蛋白表达,结果显示耐药细胞CTR1蛋白的表达水平均明显低于其亲代细胞(Fig 3)。此外,尽管有研究发现顺铂短时间处理细胞会快速下调CTR1的蛋白水平,但我们的研究显示顺铂短时间处理细胞并不引起CTR1蛋白的改变(Fig 3)。

Fig 2 Whole-cell cisplatin accumulation(A)and Pt-DNA adduct formation(B)in response to 2 h exposure of 30 μmol·L-1cisplatin in cisplatin-resistant cell line HKESC-1/cis and its parental counterpart HKESC-1 as determined by ICP-MS
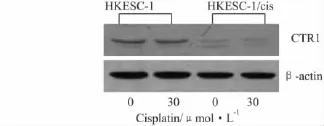
Fig 3 The protein expression of CTR1 in response to 5 min exposure of 30 μmol·L-1cisplatin in cisplatin-resistant cell line HKESC-1/cis and its parental counterpart HKESC-1 as determined by Western blot
3 讨论
肿瘤细胞耐药性的产生目前仍然是肿瘤治疗的主要障碍,也是化疗失败的重要原因。顺铂是食管鳞癌治疗的基本化疗药物,在食管鳞癌的临床治疗中发挥着重要的作用,然而肿瘤细胞耐药性的产生严重限制了顺铂的抗肿瘤效果。在体外建立肿瘤耐药细胞株,能为肿瘤细胞耐药性机制及抗药性逆转的研究提供重要的手段和模型[14]。通过浓度梯度递增法处理人食管鳞癌细胞HKESC-1,我们诱导出了具有顺铂抗性的耐药细胞株HKEC-1/cis,耐药细胞对顺铂的抗性是亲代细胞的2.9倍。更为重要的是,耐药细胞株在无顺铂的培养基中培养4个月后对顺铂的抗性仍保持不变,表明HKESC-1/cis具有稳定的顺铂耐药性。因此,我们认为这一耐药细胞株能够用于细胞耐药性产生的机制研究。
顺铂进入细胞后与DNA嘌呤碱基亲核的N7位结合形成链内和链间的交叉联接,从而破坏DNA的结构和功能,最终导致细胞的死亡[15]。考虑到Pt-DNA加合物的形成与顺铂发挥细胞毒作用之间的相关性,我们检测了HKESC-1/cis及其亲代细胞在顺铂处理后细胞内顺铂的蓄积以及Pt-DNA加合物的形成。结果显示,HKESC-1/cis细胞内顺铂的蓄积以及Pt-DNA加合物的形成均比其亲代细胞HKESC-1少。另外,细胞内顺铂蓄积的减少和Pt-DNA加合物形成的减少程度相当。这一结果提示我们进入细胞内的顺铂量很可能决定了多少顺铂可以进入细胞核并与DNA结合形成加合物。细胞内顺铂的蓄积以及Pt-DNA加合物的减少可以解释HKESC-1/cis细胞对顺铂的耐药性。
顺铂分子极性高,不容易扩散穿过脂质细胞膜。CTR1是顺铂的主要膜转运蛋白。敲除CTR1在体外和体内均可导致肿瘤细胞对顺铂产生耐药性[13,16]。通过检测细胞 CTR1蛋白的表达水平,我们发现顺铂耐性细胞株HKESC-1/cis与其亲代细胞相比,CTR1蛋白水平明显降低。这一结果提示我们,耐药细胞株CTR1蛋白表达的降低抑制了顺铂进入细胞,从而减少了顺铂在细胞内的蓄积。尽管已有文献报道顺铂短期(5 min内)处理一些细胞可引起CTR1蛋白的快速降解而导致CTR1蛋白水平的下降[11-12]。然而,在我们检测的顺铂耐药性细胞和其亲代细胞中并未发现相同的现象。顺铂短期(5 min)处理这些细胞后,CTR1蛋白表达水平不变。考虑到本研究中的顺铂耐药细胞株是通过顺铂长时间处理(6个月)诱导出来的,我们推断人食管鳞癌细胞需要经顺铂长期处理,才能下调CTR1蛋白的表达水平。
CTR1在顺铂进入细胞过程中起着重要作用。因此,通过调节CTR1功能增加顺铂进入细胞,可望提高顺铂的细胞毒性作用。已有研究发现,一些化合物和顺铂合用后可增强顺铂的细胞毒作用,比如铜离子螯合物和蛋白酶抑制剂。铜离子螯合剂可上调CTR1蛋白的表达,而蛋白酶抑制剂则能抑制CTR1蛋白的降解[17-18]。我们的研究发现,顺铂耐药的人食管鳞癌细胞CTR1蛋白表达较其亲代细胞有明显的降低,这可能是耐药细胞胞内顺铂蓄积,以及Pt-DNA加合物减少的重要原因。然而,抗性细胞CTR1蛋白下调的机制并不明确。此外,铜离子螯合物和蛋白酶抑制剂能否恢复顺铂耐药细胞已下调的CTR1蛋白水平,从而逆转耐药细胞对顺铂的抵抗性?这些问题值得进一步地研究探讨。
[1]Wang Z,Tang L,Sun G,et al.Etiological study of esophageal squamous cell carcinoma in an endemic region:a population-based case control study in Huaian,China[J].BMC Cancer,2006,6:287.
[2]Sepehr A,Taniere P,Martel-Planche G,et al.Distinct pattern of TP53 mutations in squamous cell carcinoma of the esophagus in I-ran[J].Oncogene,2001,20(50):7368 - 74.
[3]Ilson D H.Esophageal cancer chemotherapy:recent advances[J].Gastrointest Cancer Res,2008,2(2):85 -92.
[4]刘思涵,孙国平,杨 震,等.丹皮酚诱导食管癌Eca-109裸鼠移植瘤凋亡的机制探讨[J].中国药理学通报,2008,24(4):457-60.
[4]Liu S H,Sun G P,Yang Z,et al.Investigation of apoptosis mechanism of Pae on human esophageal cancer Eca-109 cell carcinoma xenograft in nude mice[J].Chin Phamacol Bull,2008,24(4):457-60.
[5]Holzer A K,Samimi G,Katano K,et al.The copper influx transporter human copper transport protein 1 regulates the uptake of cisplatin in human ovarian carcinoma cells[J].Mol Pharmacol,2004,66(4):817 -23.
[6]Samimi G,Safaei R,Katano K,et al.Increased expression of the copper efflux transporter ATP7A mediates resistance to cisplatin,carboplatin,and oxaliplatin in ovarian cancer cells[J].Clin Cancer Res,2004,10(14):4661 -9.
[7]Yu L,Wu W K,Li Z J,et al.E series of prostaglandin receptor 2-mediated activation of extracellular signal-regulated kinase/activator protein-1 signaling is required for the mitogenic action of prostaglandin E2 in esophageal squamous-cell carcinoma[J].J Pharmacol Exp The,2008,327(1):258 -67.
[8]Hall M D,Okabe M,Shen D W,et al.The role of cellular accumulation in determining sensitivity to platinum-based chemotherapy[J].Annu Rev Pharmacol Toxicol,2008,48:495 -535.
[9]Yu L,Chen M,Li Z,et al.Celecoxib antagonizes the cytotoxicity of Cisplatin in human esophageal squamous cell carcinoma cells by reducing intracellular Cisplatin accumulation[J].Mol Pharmacol,2011,79(3):608 -17.
[10]Kelland L.The resurgence of platinum-based cancer chemotherapy[J].Nat Rev Cancer,2007,7(8):573 -84.
[11]Holzer A K,Katano K,Klomp L W,Howell S B.Cisplatin rapidly down-regulates its own influx transporter hCTR1 in cultured human ovarian carcinoma cells[J].Clin Cancer Res,2004,10(19):6744-9.
[12]Holzer A K,Howell S B.The internalization and degradation of human copper transporter 1 following cisplatin exposure[J].Cancer Res,2006,66(22):10944 -52.
[13]Howell S B,Safaei R,Larson C A,Sailor M J.Copper transporters and the cellular pharmacology of the platinum-containing cancer drugs[J].Mol Pharmacol,2010,77(6):887 -94.
[14]李鸿梅,李雪岩,蔡德富,等.齐墩果对顺铂耐药胃癌SGC-7901细胞增殖的影响及其机制研究[J].中国药理学通报,2009,25(10):1334-7.
[14]Li H M,Li X Y,Cai D F,et al.Effects of oleanolic acid on proliferation of SGC-1901/CDDPin vitroand its potential mechanisms[J].Chin Pharmacol Bull,2009,25(10):1334 -7.
[15]Rebillard A,Lagadic-Gossmann D,Dimanche-Boitrel M T.Cisplatin cytotoxicity:DNA and plasma membrane targets[J].Curr Med Chem,2008,15(26):2656-63.
[16]Larson C A,Blair B G,Safaei R,Howell S B.The role of the mammalian copper transporter 1 in the cellular accumulation of platinum-based drugs[J].Mol Pharmacol,2009,75(2):324 -30.
[17]Ishida S,McCormick F,Smith-McCune K,Hanahan D.Enhancing tumor-specific uptake of the anticancer drug cisplatin with a copper chelator[J].Cancer Cell,2010,17(6):574 - 83.
[18]Jandial D D,Farshchi-Heydari S,Larson C A,et al.Enhanced delivery of cisplatin to intraperitoneal ovarian carcinomas mediated by the effects of bortezomib on the human copper transporter 1[J].Clin Cancer Res,2009,15(2):553 -60.
