AGEs对糖尿病大鼠骨质疏松的作用机制
2011-05-31薛昊罡马恩元蒋维海单广宇苗婷婷
薛昊罡 冷 冰 马恩元 蒋维海 崔 双 单广宇 苗婷婷
(北华大学第一临床医院骨外科,吉林 吉林 132011)
糖尿病骨质疏松的发生可能与晚期糖基化终末产物(AGEs)引起骨代谢紊乱有关。由于慢性高血糖导致AGEs积聚,使骨蛋白及骨细胞分化受到影响,骨代谢平衡失调,引发骨质疏松。骨形态发生蛋白-2(BMP-2)已被证明是成骨细胞转化促进因子,具有较强的促进骨形成的作用〔1〕。目前,BMP-2的研究多集中于骨诱导及骨愈合方面,有关BMP-2在骨质疏松发病机制中的作用尚未见报道。本研究旨在进一步研究AGEs在分子水平对骨代谢影响的作用机制,为临床预防及治疗糖尿病骨质疏松提供理论基础。
1 材料与方法
1.1 研究材料 健康6个月龄Sprague-Dawley(SD)大鼠24只,雌雄各半,体重170~220g,购自北华大学动物实验室。所有大鼠均喂养于塑料鼠盒内,专人饲养,每笼4只。饲养于北华大学实验动物中心清洁级环境,室内通风良好,室温(22±2)℃,相对湿度70% ~75%,昼夜周期12h环境中适应性饲养2w,所有大鼠不限制饮食,自由摄入标准固体颗粒饲料(含1.13%钙、0.66%磷,北华大学动物实验室提供)和自来水。适应性喂养1w后进行分组饲养。实验过程中对动物处置符合科学技术部2006年《关于善待实验动物的指导性意见》的要求。
1.2 研究方法
1.2.1 分组 采用随机数字表法将24只大鼠随机分为对照组和糖尿病骨质疏松组,每组12只,两组大鼠的体重、月龄及喂养条件均无明显差异,具有一致性(P>0.05)。其中对照组大鼠均喂以普通饲料,糖尿病骨质疏松组喂以高糖高脂饲料(普通饲料中添加10%猪油、10%蛋黄粉和20%蔗糖)喂养8w(不限每日热量),禁食12h后一次性左下腹腔注射 STZ(65mg/kg体重),正常对照组腹腔注射等量枸橼酸缓冲液。2w后,每周固定时间大鼠尾静脉采血测血糖,做腹腔内葡萄糖耐量(Intraperitonealglucosetolerancetest,IPGTT)。方法为:大鼠禁食6~8h,按2g/kg体重腹腔注射30%葡萄糖溶液,尾静脉采血测定 0、30、60、120min血糖,以空腹血糖(FPG)≥7.0mmol/L,或糖负荷后2h血糖≥11.1mmol/L者为糖尿病造模成功鼠〔2〕。成模后所有大鼠每周固定时间测血糖和体重,持续观察20w。剔除死亡和造模未成功大鼠,糖尿病骨质疏松组最后纳入统计的大鼠为10只。
1.2.2 检测指标及方法
1.2.2.1 标本取材与保存 各组动物在完成整个实验过程后、处死取材前进入代谢笼,收集24h尿液,经腹腔静脉抽血处死,取实验动物第2腰椎椎体〔3〕。尿和血标本及时检验或放入低温冰箱保存,骨标本分别在低温冰箱、液氮或甲醛固定保存。1.2.2.2 血清学指标测定 血清Ca、P、FPG、甘油三酯(TG)、总胆固醇(TC)的测定由全自动生化分析仪使用比色法测定,抗凝血糖化血红蛋白(HbA1c)的测定采用比色法,血清胰岛素(INS)、白介素(IL)-6、胰岛素样生长因子(IGF)-I、BGP的测定采用放射免疫法,用Hitachi-850型荧光分光光度计测定血清中AGEs的含量〔4〕。公式计算如下:IAI=In(1/FINS×FPG),IR=FPG ×FINS/22.5。
1.2.2.3 骨形态学计量测定 采用美国GDR-2000型Hologac双光能X射线骨密度仪测量大鼠腰椎、股骨及胫骨及总骨密度。应用CMIAS型北航多功能病理彩色图像分析系统计算平均骨小梁宽度、平均骨皮质厚度、骨小梁百分比、平均骨小梁间距〔5〕。
1.2.2.4 骨组织中BMP-2的免疫组织化学染色 用实验大鼠椎体松质骨作为实验材料,取第2腰椎的锥体,4%多聚甲醛固定,15%EDTA溶液脱钙,梯度酒精逐级脱水后,石蜡包埋、切片,用1∶200兔抗大鼠BMP-2多克隆抗体作为第一抗体,1∶200生物素化山羊抗兔IgG作为第二抗体,DAB显色,显微镜下观察有棕黄色物质出现时停止,常规梯度酒精脱水,二甲苯透明,中性树胶封片〔6〕。
1.2.2.5 骨组织中BMP-2的原位杂交 用实验大鼠椎体松质骨作为实验材料,处死大鼠后,剥离出腰椎椎体,置于4%多聚甲醛固定,经20%EDTA脱钙,乙醇上行梯度脱水,石蜡包埋,骨纵行切片(6μm厚)后按BMP-2原位杂交试剂盒进行操作,具体操作步骤如下:①使用前,将所有试剂充分混匀。不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差。②根据待测样品数量加上标准品的数量决定所需的板条数。每个标准品和空白孔建议做复孔。每个样品根据自己的数量来定,能使用复孔的尽量做复孔。③加入稀释好后的标准品50μl于反应孔,加入待测样品50μl于反应孔内。立即加入50μl生物素标记的抗体〔7〕。盖上膜板,轻轻振荡混匀,37℃温育1h。④甩去孔内液体,每孔加满洗涤液,振荡30s,甩去洗涤液,用吸水纸拍干。重复此操作3次。如果用洗板机洗涤,洗涤次数增加1次。⑤每孔加入80μl的亲和链霉素-HRP,轻轻振荡混匀,37℃温育30min。⑥甩去孔内液体,每孔加满洗涤液,振荡30s,甩去洗涤液,用吸水纸拍干。重复此操作3次。如果用洗板机洗涤,洗涤次数增加1次。⑦每孔加入底物A、B各50μl,轻轻振荡混匀,37℃温育10min。避免光照。⑧取出酶标板,迅速加入50μl终止液,加入终止液后应立即测定结果。⑨在450nm波长处测定各孔的OD值。
1.3 统计学分析 采用SPSS13.0软件包对数据进行统计分析,计量资料以x±s表示,结果用单因素方差分析,组间均数比较采用t检验。
2 结果
2.1 两组大鼠体重变化 糖尿病组大鼠与正常对照组大鼠相比,在食用高脂饮食后体重迅速增长,并在高脂饮食8w后明显高于对照组(P<0.05);而在注射STZ后糖尿病组大鼠的体重增长明显缓慢,至20w实验结束时体重明显低于正常对照组(P<0.05)。见表1。
2.2 两组大鼠血糖变化 单纯给予高脂饮食对两组大鼠的血糖无明显影响,但注射STZ后糖尿病组的血糖明显升高,且差异有统计学意义(P<0.05)。见表2。
2.3 两组大鼠代谢相关生化指标和细胞因子的变化 糖尿病组大鼠的血清钙、磷水平与对照组相比均无明显差异(P>0.05);血清 TG、TC、BGP、IGF-1、IL-6 等与对照组相比有明显差异(P<0.05)。见表3。

表1 注射STZ前后两组大鼠体重变化情况(x ± s,g)

表2 注射STZ前后两组大鼠血糖变化情况(x ± s,mmol/L)
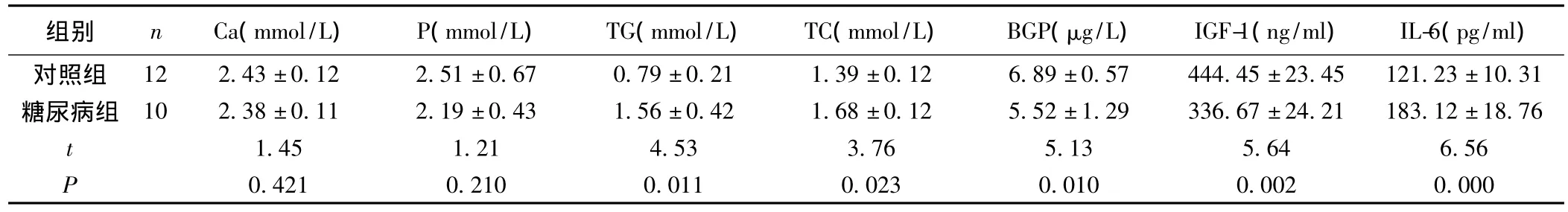
表3 两组大鼠代谢相关生化指标和细胞因子的变化情况(x±s)

表4 两组大鼠血清AGEs、HbAlc、INS及IR的变化情况比较(x±s)
2.4 两组大鼠血清AGEs、HbAlc、INS及IR的变化 糖尿病组大鼠血清AGEs、HbAlc、INS及IR等指标与正常对照组相比有明显差异(P<0.05)。见表4。
2.5 两组大鼠骨组织形态计量学参数的变化 糖尿病组大鼠的骨小梁相对体积、骨小梁厚度、骨小梁数量及骨小梁分离度等骨组织形态计量学参数静态指标与对照组相比均有明显差异(P<0.05)。见表5。另外,由表6可知糖尿病组大鼠的骨矿化沉积率、骨形成率及单位骨小梁面积上破骨细胞数等骨组织形态计量学参数动态指标与对照组相比均有明显差异(P<0.05)。两组大鼠的股骨和胫骨X线片见图1。

表5 两组大鼠骨组织形态计量学参数静态指标的变化(x±s)

表6 两组大鼠骨组织形态计量学参数动态指标的变化(x±s)

图1 对照组及糖尿病组大鼠股骨和胫骨的X线摄片
2.6 BMP-2蛋白表达及平均光密度值 BMP-2蛋白主要沉积于骨细胞。对照组大鼠骨组织BMP-2蛋白表达强烈且广泛,染色深,有的甚至成片状;糖尿病组亦出现BMP-2蛋白的阳性表达,但均散在且淡染。见图2。糖尿病组的BMP-2蛋白表达染色平均光密度(1.29±0.29)较对照组(3.41±0.43)明显升高,且差异有统计学意义(P<0.05)。

图2 BMP-2蛋白表达免疫组化染色
2.7 BMP-2mRNA表达及平均光密度值 糖尿病组原位杂交阳性染色出现于部分成骨细胞、骨细胞,阳性着色较深;对照组原位杂交阳性染色较广泛出现于成骨细胞、骨细胞及部分间充质细胞,阳性着色深。见图3。糖尿病组大鼠椎骨、胫骨上段BMP-2mRNA表达染色平均光密度(0.12±0.019)较对照组(0.21±0.031)明显降低(P<0.05)。

图3 骨组织BMP-2mRNA表达情况
2.8 大鼠血清AGEs与BMP-2mRNA和蛋白表达的关系血清AGEs与BMP-2mRNA和蛋白表达呈显著负相关,相关系数分别为 -0.715(P<0.05)、-0.621(P<0.05)。
3 讨论
AGEs是体内糖的醛基或酮基与蛋白质等的自由氨基经过非酶促糖基化反应形成的一类复合物,这些复合物呈异质性,棕褐色,具有荧光性和高度交联性,正常情况下AGEs是机体组织重建和内环境稳定所需的,过多积累则引起许多病理改变。本文研究结果显示糖尿病组大鼠的AGEs水平较对照组明显升高。这主要是由于AGEs抑制间充质干细胞(MSCs)增殖,诱导凋亡,并阻止其分化为脂肪组织、软骨和骨组织,提示AGEs在老年糖尿病病人肌肉骨骼紊乱发病过程的毒害效应;AGEs介导的交联大分子蛋白质可溶性降低,对蛋白溶解酶的抵抗性增高,导致组织(如弹性胶原)理化和机械特性的改变。这与本文两组大鼠骨组织形态计量学参数比较结果是一致的。Hein等〔8〕取自于骨质疏松患者的骨样本中,通过免疫组化发现存在骨蛋白的AGEs免疫反应强烈区域,其与骨重建参数具有相关性。这一研究表明,骨蛋白及骨细胞分化也受AGEs积聚的影响。Yamamoto〔9〕研究表明,在糖尿病骨质疏松患者当中AGEs通过与细胞表面受体作用而导致骨形成减少,骨吸收增加。Lu〔10〕在STZ诱导的糖尿病大鼠模型中发现IGF-1和成纤维细胞生长因子表达下降,调节成骨细胞分化的基因(Cbfa1/Runx-2和Dlx5)表达不足,导致骨形成降低。Santana〔11〕在糖尿病动物的颅盖骨组织间充质细胞、成骨细胞中,证实RAGE的表达上调。国内张磊〔12〕等的研究证实了糖尿病大鼠血清AGEs明显升高,骨密度则明显降低。李涛等〔13〕的研究证实糖尿病大鼠存在着骨质疏松现象,且AGEs明显高表达。王秀玲〔14〕等证实患者AGEs结合细胞表面的RAGE产生过多的TNF-α、IL-1、IL-6等细胞因子,血清TNF-α、IL-6、EGF水平和BMD呈显著负相关。国内外的研究均提示了AGEs与糖尿病大鼠骨质疏松发病的相关性。
在骨的形成过程中,成骨细胞的产生、增殖、分化受多种因素的调节,其中BMP-2在成骨细胞分化过程中起非常关键的作用〔15〕。BMP-2通过促进成骨细胞分化和促进其他成骨因子的表达而促进骨形成。BMP作为转化生长因子(TGFβ)超家族,其中,BMP-2是骨诱导活性最强的一种〔16〕。离体的BMP-2可诱导成骨细胞前体细胞幼稚软骨细胞或成熟软骨细胞分化为较成熟的成骨细胞样细胞〔17〕。有报道IGF-1促进成骨细胞的增殖、分化以及促进长骨的生长可能是通过增加细胞中BMP-2基因表达所介导的〔18〕。有关AGEs与糖尿病骨质疏松BMP-2基因表达相关性的研究等报道较少。目前有关AGEs与糖尿病骨组织中BMP-2基因相关性的研究罕见报道。本文研究结果显示糖尿病组BMP-2在mRNA和蛋白表达水平均较正常对照组明显降低,这表明糖尿病骨质疏松可能与BMP-2的表达水平有关。
综上所述,AGEs和BMP-2均参与了糖尿病骨质疏松的发生发展;而有效的血糖控制可减少AGEs生成,增加BMP-2的表达,从而延缓糖尿病性骨质疏松的发生和发展。
1 张艳红,董 进.rhIGF-1对成骨细胞增殖、BMP-2及Cbfa1基因表达的影响〔J〕.中国骨质疏松杂志,2010;16(3):157-60.
2 王 娟,阳文琳,陈 隽.辛伐他汀对糖尿病大鼠骨组织BMP-2基因表达的影响〔J〕.中国老年学杂志,2009;29(7):834-6.
3 葛全胜,王寿宇,朱英会,等.降脂壮骨方剂含药血清对大鼠骨髓基质细胞骨形态发生蛋白-2表达的影响〔J〕.中国基层医药,2009;16(10):1729-31.
4 SwarnkarG,SharanK,SiddiquiJA,etal.Anovelflavonoidisolatedfrom thesteam-barkofUlmusWallichianaPlanchonstimulatesosteoblastfunctionandinhibitsosteoclastandadipocytedifferentiation〔J〕.EurJPharmacol,2011;658(2-3):65-73.
5 TangDZ,YangF,YangZ,etal.PsoralenstimulatesosteoblastdifferentiationthroughactivationofBMPsignaling〔J〕.BiochemBiophysResCommun,2011;405(2):256-61.
6 OzkanZS,DeveciD,OnalanEtemE,etal.Lackofeffectofbonemorphogeneticprotein2and4genepolymorphismsonbonedensityinpostmenopausalTurkishwomen〔J〕.GenetMolRes,2010;9(4):2311-6.
7 PountosI,GeorgouliT,HenshawK,etal.Theeffectofbonemorphogeneticprotein-2,bonemorphogeneticprotein-7,parathyroidhormone,and platelet-derivedgrowthfactorontheproliferationandosteogenicdifferentiationofmesenchymalstemcellsderivedfromosteoporoticbone〔J〕.J OrthopTrauma,2010;24(9):552-6.
8 Hein,WeiH,LehmannG,etal.Advancedglycationendproductodificationofoneproteinsandboneremodelling:hypothesisandpreliminaryimmunohistochemicalfindings〔J〕.AnnRheumDis,2006;65:101.
9 YamamotoT.TheroleofAGEsforthepathogenesisofos-teopeniaindiabetesmellitus〔J〕.ClinCalcium,2006;16(8):62-6.
10 LuH,KrautD,GerstenfeldLC,etal.Diabetesinterfereswiththebone formationbyaffectingtheexpressionoftran-scriptionfactorsthatregulate osteoblastdifferentiation〔J〕.Endocrinology,2003;144:346-52.
11 SantanaRB,XuL,ChaseHB,etal.Aroleforadvancedglycationend productsindiminishedbonehealingintypediabetes〔J〕.Diabetes,2003;52:1502-10.
12 张 磊,李 牧,祁 磊,等,晚期糖基化终末产物在糖尿病大鼠骨质疏松发病中的作用及胰岛素潜在的防护机制〔J〕.山东大学(医学版),2007;45(11):1148-52.
13 李 涛,郭洪敏,聂志奎,等.糖基化终末产物在糖尿病大鼠骨质疏松中的作用及阿司匹林干预性观察〔J〕.济宁医学院学报,2010;33(2):82-8.
14 王秀玲,张 颖,于文浩.糖骨康对糖尿病骨质疏松患者血清降钙素、肿瘤坏死因子α、白细胞介素6含量的影响〔J〕.临床荟萃,2007;22(4):286.
15 NoheA,KeatingP,PetersenNO.Signaltransductionofbonemorphogeneticproteinreceptors〔J〕.CellSignal,2004;16(3):291-9.
16 JiaTL,WangHZ,XieLP,etal.Daidzeinenhancesosteoblastgrowththat maybemediatedbyincreasedbonemorphogeneticprotein(BMP)production〔J〕.BiochemPharmacol,2003;65(5):709-15.
17 YehLC,AdamoML,OlsonMS,etal.Osteogenicprotein-1andin-sulinlikegrowthfactorIsynergisticallystimulateratosteoblasticcelldifferentiationandproliferation〔J〕.Endocrinology,1997;138(10):4181-90.
18 梁东春,王宝利,左爱军,等.胰岛素样生长因子-1对成骨细胞中BMP-2、BMP-7基因表达的影响〔J〕.中国骨质疏松杂志,2004;10(1):45-7.
