胶质瘤1p/19q联合缺失特征分析
2011-04-18赛克王芳牟永告张湘衡柯超杨群英邵建永陈忠平
赛克王芳牟永告张湘衡柯超杨群英邵建永陈忠平
·论 著·
胶质瘤1p/19q联合缺失特征分析
赛克*王芳△牟永告*张湘衡*柯超*杨群英*邵建永△陈忠平*
目的 研究胶质瘤中 1p/19q联合缺失与患者临床特征及O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)表达的关系。方法 使用荧光原位杂交技术,对中山大学附属肿瘤医院2009年3月至2011年3月的63例手术确诊胶质瘤标本进行1p/19q联合缺失检测,利用统计学方法分析1p/19q联合缺失患者与无联合缺失患者在性别、年龄、部位、病理类型及MGMT表达状态是否有差异。结果 全组63例患者,男38例,女25例,年龄(41.7±15.3)岁。其中,16例(25.4%)存在1p/19q联合缺失。1p/19q联合缺失患者与无联合缺失患者在性别、年龄及肿瘤部位间的差异无统计学意义。各病理类型1p/19q联合缺失的比例从高到低依次为少突胶质细胞瘤(9/16)、间变性少突胶质细胞瘤(3/8)、星形细胞瘤(2/10)、间变性星形细胞瘤(1/6)及胶质母细胞瘤(1/21),其差异有统计学意义(P<0.01)。在全组63例胶质瘤及25例含少突成分胶质瘤中,MGMT阳性肿瘤1p/19q联合缺失比例与MGMT阴性组间的差异皆无统计学意义。结论1p/19q联合缺失主要与胶质瘤的病理类型有关,含少突成分胶质瘤中1p/19q联合缺失比例较高。1p/19q联合缺失可作为少突胶质细胞瘤病理诊断的重要参考指标。
胶质瘤 1p/19q联合缺失 MGMT 病理
胶质瘤是成人中枢神经系统最常见的原发肿瘤,准确的病理诊断是合理治疗的前提。寻找特异性的分子指标用于胶质瘤病理诊断以及预测胶质瘤患者的临床预后,是目前神经肿瘤领域内的研究热点。1号染色体短臂(1p)与19号染色体长臂(19q)的联合性缺失是胶质瘤,尤其是少突胶质细胞瘤重要的分子指标,在病理诊断、放化疗疗效评价及临床预后预测具有重要意义[1-2]。目前,荧光原位杂交(fluorescence in situ hybridization,FISH)是国外最常用于检测临床胶质瘤标本中1p/19q联合缺失的手段[3]。我们用FISH检测我院2009年3月至2011年3月胶质瘤中1p/19q联合缺失的结果,并分析与其相关的临床病理因素,现报告如下。
1 资料与方法
1.1 临床资料 本研究收集2009年3月至2011年3月我院病理确诊,并进行1p/19q联合缺失检测的胶质瘤病例63例。本组63例,男38例,女25例,年龄7~76岁,平均(41.7±15.3)岁。肿瘤部位:脊髓2例,小脑2例,丘脑2例,岛叶3例,额叶25例,颞叶14例,顶叶9例,枕叶6例。肿瘤病理类型:毛细胞型胶质细胞瘤1例,星形细胞瘤10例,少突胶质细胞瘤16例,间变性星形细胞瘤6例,间变性少突胶质细胞瘤8例,间变性少突-星形细胞瘤1例,胶质母细胞瘤21例。肿瘤级别(WHO分级):Ⅰ级1例,Ⅱ级26例,Ⅲ级15例,Ⅳ级21例。
1.2 O6-甲基鸟嘌呤-DNA 甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)蛋白表达检测 采用四川宇康生物技术有限公司生产的甲基转移酶诊断试剂盒检测。检测方法按试剂盒说明书进行。结果判定根据显微镜下观察,在肿瘤细胞细胞核或胞浆内有棕褐色着色颗粒的为阳性,其中呈强着色、阳性细胞大于10%为阳性。
1.3 1p/19q联合缺失检测 石蜡包埋甲醛固定肿瘤组织,切片HE染色。于光镜下选取无出血及坏死之肿瘤区域,并于石蜡块相应位置定位。使用美国雅培公司生产的1p/19q荧光探针试剂盒,分别在两片选取的石蜡玻片上标记1p36(红色靶点探针)、1q25(绿色参照探针)与19q13(红色靶点探针)、19p13(绿色参考探针)。检测方法按说明书进行。DAPI(蓝色)标记细胞核。荧光显微镜下观察。选取100个肿瘤细胞,当细胞核内红色信号数目=绿色信号数目,判定为非缺失细胞;当细胞核内红色信号数目<绿色信号数目时,判定为缺失细胞。当缺失细胞比例>30%时,判定该肿瘤标本为1p36缺失或19q13缺失阳性(图1)。
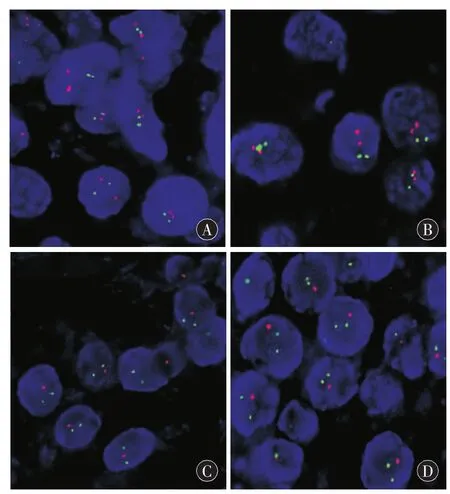
图1 荧光原位杂交检测胶质瘤1p/19q联合缺失。A:1p无缺失;B:19q无缺失;C:1p缺失;D:19q缺失。在A与C中,红色信号为1p探针,绿色信号为1q探针。在B与D中,红色信号为19q探针,绿色信号为19p探针。
1.4 统计学分析 使用SPSS 10.0进行分析,t检验行计量资料间的比较,χ2检验行计数资料间的比较。检测水准α=0.05。
2 结果
2.1 1p/19q联合缺失在胶质瘤中构成情况 见表1。本组 63例胶质瘤中,1p/19q联合缺失 16例(25.4%),无联合缺失47例(74.6%)。联合缺失组中男11例,女5例;无联合缺失组中男27例,女20例,两组性别差异无统计学意义 (χ2=0.637,P>0.05)。联合缺失组与非联合缺失组年龄分别为(38.1±14.1)岁及(42.9±15.7)岁,两组年龄差异无统计学意义(t=2.000,P>0.05)。联合缺失组肿瘤位于左侧8例,右侧7例;非联合缺失组左侧24例,右侧22例,两组肿瘤侧别差异无统计学意义(χ2=0.061,P>0.05)。两组肿瘤所在部位的差异亦无统计学意义(χ2=1.802,P>0.05)
2.2 1p/19q联合缺失与胶质瘤病理类型及病理级别的关系 见表2。16例1p/19q联合缺失病例中,星形细胞瘤2例,少突胶质细胞瘤9例,间变星形细胞瘤1例,间变少突细胞瘤3例,胶质母细胞瘤1例。其中,含少突成分病例12例,不含少突成分4例;低级别胶质瘤(Ⅰ、Ⅱ级)11例,高级别胶质瘤(Ⅲ、Ⅳ级)5例。47例无1p/19q联合缺失病例中,毛细胞型星形细胞瘤1例,星形细胞瘤8例,少突胶质细胞瘤7例,间变星形细胞瘤5例,间变少突细胞瘤5例,间变少突-星形细胞瘤1例,胶质母细胞瘤20例。其中,含少突成分病例13例,不含少突成分34例,低级别胶质瘤(WHO分级Ⅰ、Ⅱ级)16例,高级别胶质瘤(WHO分级Ⅲ、Ⅳ级)31例。1p/19q联合缺失组中含少突成分胶质瘤的比例(12/16)高于无联合缺失组(13/47)(χ2=11.18,P<0.05)。各病理类型中1p/19q联合缺失的比例从高到低依次为少突胶质细胞瘤(9/16)、间变性少突胶质细胞瘤(3/8)、星形细胞瘤(2/10)、间变性星形细胞瘤(1/6)及胶质母细胞瘤(1/21),1p/19q联合缺失的比例在各病理类型间的差异有统计学意义(χ2=13.199,P<0.05)。各病理级别中1p/19q联合缺失的比例从高到低依次为Ⅱ级(11/26)、Ⅲ级(4/15)及Ⅳ级(1/21),1p/19q联合缺失的发生率在各级别间的差异有统计学意义(χ2=8.983,P<0.05)。
2.3 1p/19q联合缺失与胶质瘤组织中MGMT表达的关系 见表3。全组63例胶质瘤中MGMT阴性29例,阳性34例。MGMT阴性肿瘤中1p/19q联合缺失9例,无缺失20例;MGMT阳性肿瘤中1p/19q联合缺失7例,无缺失27例。全组MGMT阴性与阳性肿瘤中1p/19q联合缺失比例的差异无统计学意义(χ2=0.901,P>0.05)。在含少突成分的25例胶质瘤中,MGMT阴性13例,阳性12例。MGMT阴性肿瘤中1p/19q联合缺失7例,无缺失6例;MGMT阳性肿瘤中1p/19q联合缺失5例,无缺失7例。含少突成分胶质瘤MGMT阴性与阳性肿瘤中1p/19q联合缺失比例的差异无统计学意义(χ2=0.370,P>0.05)。
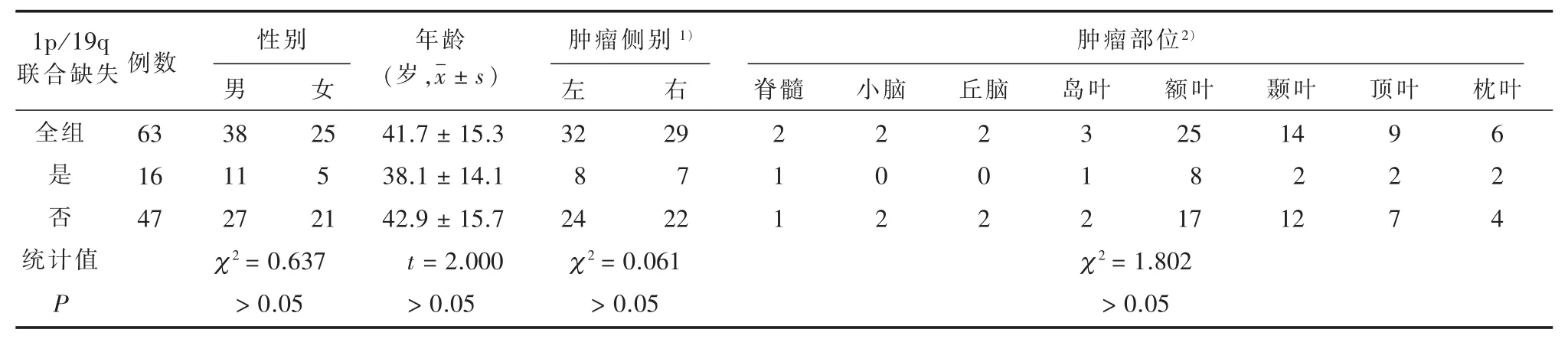
表1 1p/19q联合缺失与1p/19q无缺失患者临床特征比较
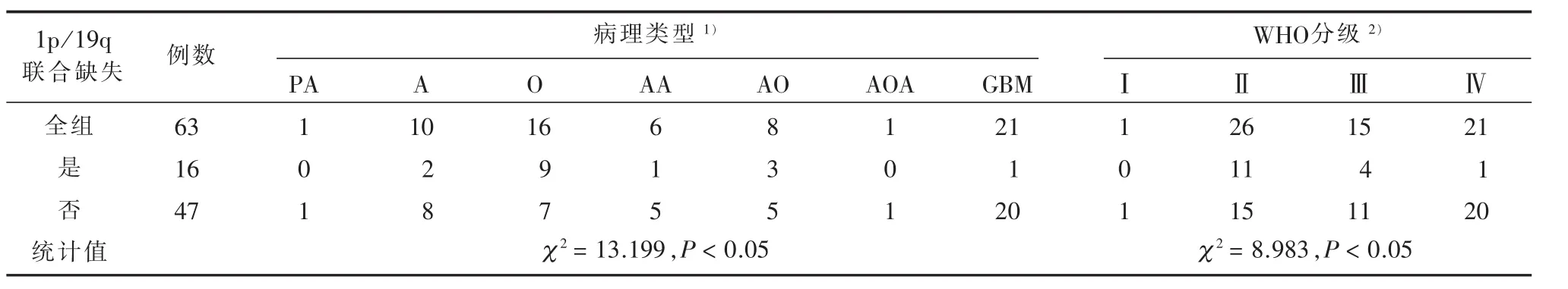
表2 两组患者病理类型比较
3 讨论
3.1 1p/19q联合缺失的检测方法 目前文献报道较多的用于检测1p/19q联合缺失的方法主要包括基于PCR的微卫星分析、比较基因组杂交及荧光原位杂交(FISH)。前两项技术由于耗时长、过程复杂及对技术设备要求较高,因此多用于科研使用,较少用于临床,而FISH由于具有商业化试剂盒、操作相对简单及结果直观等优点,在国外已广泛应用于临床工作[4]。
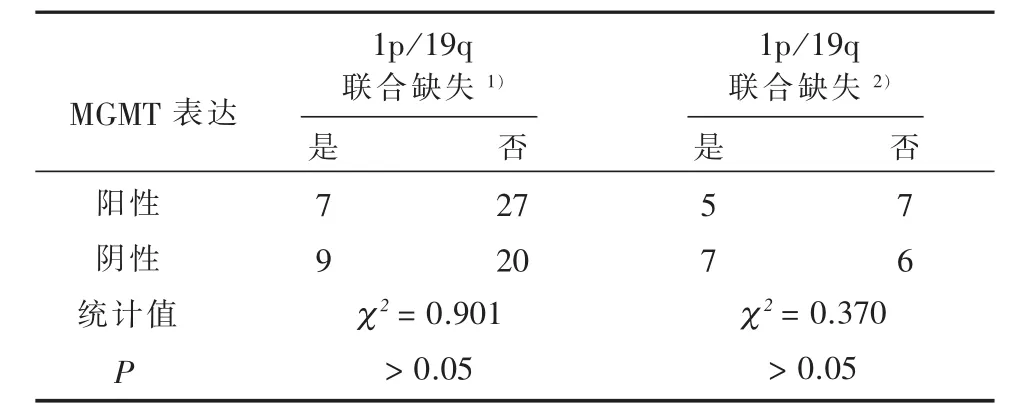
表3 不同MGMT表达组间1p/19q联合缺失的比较
3.2 1p/19q联合缺失与胶质瘤病理类型 Reifenberger J等[5]最早发现少突胶质细胞瘤中存在较高频率的1p/19q的联合缺失。随后研究[6]也表明,1p/19q联合缺失在少突胶质瘤中常见,发生率可达50%~80%,而在星形细胞瘤中,出现率较低。在病理诊断方面,正是由于1p/19q联合缺失在少突胶质细胞瘤与星形细胞瘤存在显著差异,检测1p/19q联合缺失有助于形态学表现不典型少突胶质细胞瘤的诊断与鉴别。与文献报道相符,在本组16例1p/19q联合缺失的病例中,含少突成分的胶质瘤有12例,而47例无1p/19q联合缺失组中,含少突成分的胶质瘤仅有13例。在各病理类型中,含少突成份胶质瘤中1p/19q联合缺失的比例明显高于不含少突成分胶质瘤,其比例从高到低依次为少突胶质细胞瘤>间变性少突胶质细胞瘤>星形细胞瘤>间变性星形细胞瘤>胶质母细胞瘤。
3.3 1p/19q联合缺失与少突胶质细胞瘤患者预后及MGMT表达的关系 1p/19q联合缺失是少突胶质细胞瘤化疗敏感性及预后的重要预测指标。1998年,Cairncross等在回顾性分析了PCV化疗方案治疗间变性少突胶质细胞瘤的疗效后发现,具有1p/19q联合缺失的肿瘤对PCV化疗方案的反应率为100%,而仅有25%的无1p/19q联合缺失的肿瘤对PCV化疗方案有反应。无1p/19q联合缺失患者在PCV方案化疗后的复发死亡率是具有联合缺失患者的5.7倍[7]。除PCV方案外,具有1p/19q联合缺失的少突胶质细胞肿瘤对替莫唑胺(temozolomide,TMZ)亦有较高的反应率。在一项前瞻性临床研究中,Brandes等发现具有1p/19q联合缺失的间变或复发少突胶质细胞瘤中,59.4%的肿瘤对TMZ敏感,而仅有34.3%的无联合缺失的肿瘤对TMZ敏感。另外,具有联合缺失患者中位生存期为45.3个月,较无缺失患者的18.8个月明显延长[8]。
MGMT能够修复由化疗药物造成的DNA损伤,是胶质瘤中介导常用烷化剂(如亚硝脲及替莫唑胺)耐药的重要原因[9]。在胶质瘤中,MGMT的表达与否主要受其启动子区域甲基化状态的调控:若启动子区域甲基化,则MGMT不表达或低表达;若启动子区域去甲基化,则MGMT高表达[10]。由于1p/19q联合缺失的少突胶质瘤对含烷化剂的PCV化疗方案及TMZ敏感,故有部分学者猜测,这些肿瘤的化疗敏感性可能与MGMT有关。在一项欧洲癌症治疗研究组织 (EORTC)进行的临床研究中,van den Bent等发现在39例1p/19q联合缺失的间变性少突胶质细胞瘤中,38例(97%)肿瘤存在MGMT启动子区域甲基化[11]。国内任晓辉利用FISH及免疫组化分别检测胶质瘤标本中1p/19q联合缺失及MGMT的表达情况,并进行相关性分析。该研究作者发现,单因素及多因素回归分析都表明MGMT的表达水平与1p/19q联合缺失相关,并提出利用胶质瘤病理类型及MGMT表达水平预测1p/19q的缺失状态[12]。但是,1p/19q联合缺失与MGMT表达的关系,以及1p/19q联合缺失肿瘤化疗敏感性与较好预后是否与MGMT表达水平有关,仍存在争议。Watanabe等报道47%的少突胶质细胞瘤表达MGMT,且MGMT的表达与1p/19q联合缺失无明显关联[13]。与此篇文献相似,在本组63例胶质瘤及25例含少突成分胶质瘤中,MGMT阳性表达率分别为54.0%与48.0%。两组中,MGMT阳性与阴性病例1p/19q联合缺失率的差异都不具有统计学意义。因此,1p/19q联合缺失少突胶质细胞瘤化疗敏感及患者预后较好可能尚有其他机制。已有研究表明,在1p及19q上存在多个与肿瘤发生、进展及治疗抗拒相关的基因,如Notch2、DIRAS3、CITED4及EMP3等[14]。1p/19q联合缺失可导致相关蛋白表达量的下降、肿瘤生物学特性的改变,从而最终影响患者的临床预后。1p/19q联合缺失在少突胶质细胞瘤生物学特性中所起的作用及与MGMT表达间的关系仍需要进行深入的研究。
[1]Bourne TD,Schiff D.Update on molecular findings,management and outcome in low-grade gliomas[J].Nat Rev Neurol,2010,6(12):695-701.
[2]Hofer S,Lassman AB.Molecular markers in gliomas:impact for the clinician[J].Target Oncol,2010,5(3):201-210.
[3]Woehrer A,Sander P,Haberler C,et al.FISH-based detection of 1p 19q codeletion in oligodendroglial tumors:procedures and protocols for neuropathological practice-a publication under the auspices of the Research Committee of the European Confederation of Neuropathological Societies[J].Clin Neuropathol,2011,30(2):47-55.
[4]Ducray F,El Hallani S,Idbaih A.Diagnostic and prognostic markers in gliomas[J].Curr Opin Oncol,2009,21(6):537-542.
[5]Reifenberger J,Reifenberger G,Liu L,et al.Molecular genetic analysis of oligodendroglial tumors shows preferential allelic deletions on 19q and 1p[J].Am J Pathol,1994,145(5):1175-1190.
[6]Bromberg JE,van den Bent MJ.Oligodendrogliomas:molecular biology and treatment[J].Oncologist,2009,14(2):155-163.
[7]Cairncross JG,Ueki K,Zlatescu MC,et al.Specific genetic predictors of chemotherapeutic response and survival in patients with anaplastic oligodendrogliomas[J].J Natl Cancer Inst,1998,90(19):1473-1479.
[8]Brandes AA,Tosoni A,Cavallo G,et al.Correlations between O6-methylguanine DNA methyltransferase promoter methylation status,1p and 19q deletions,and response to temozolomide in anaplastic and recurrent oligodendroglioma:a prospective GICNO study[J].J Clin Oncol,2006,24(29):4746-4753.
[9] 张俊平,魏大年,史泓浏,等.体外药敏试验及化疗耐药和敏感分子特征指导的恶性脑胶质瘤临床个体化化疗研究[J].中国神经精神疾病杂志,2009,35(8):476-480.
[10]Weller M, Stupp R, Reifenberger G, et al.MGMT promoter methylation in malignant gliomas: ready for personalized medicine?[J]Nat Rev Neurol,2010,6(1):39-51.
[11]van den Bent MJ,Dubbink HJ,Sanson M,et al.MGMT promoter methylation is prognostic but not predictive for outcome to adjuvant PCV chemotherapy in anaplastic oligodendroglial tumors: a report from EORTC Brain Tumor Group Study 26951[J].J Clin Oncol,2009,27(35):5881-5886.
[12]任晓辉,崔向丽,姜中利,等.胶质瘤1p/19q联合缺失与临床病理因素的相关性分析[J].中华神经外科杂志,2011,27(2):116-119.
[13]Watanabe T,Nakamura M,Kros JM,et al.Phenotype versus genotype correlation in oligodendrogliomas and low-grade diffuse astrocytomas[J].Acta Neuropathol,2002,103(3):267-275.
[14]Riemenschneider MJ,Reifenberger G.Molecular neuropathology of low-grade gliomas and its clinical impact[J].Adv Tech Stand Neurosurg,2010,35:35-64.
Analysis of 1p/19q Codeletion in Gliomas: Report of 63 Cases.
SAI Ke, WANG Fang, MOU Yong-gao,ZHANG Xiangheng,KE Chao,YANG Qunying,SHAO Jianyong,CHEN Zhongping.Department of Neurosurgery,Sun Yat-sen University Cancer Center,651 Dongfeng Road East,Guangzhou 510060.Tel:020-87343309.
Objective To detect 1p/19q codeletion in patients with gliomas and investigate the relationship between 1p/19q codeletion and other clinical features including age, sex, location of tumors and the expression of O6-methylguanine-DNA methyltransferase(MGMT).Methods Fluorescence in situ hybridization(FISH)was used to detect 1p/19q codeletion in 63 cases with pathologically confirmed gliomas in Sun Yat-sen University from March 2009 to March.Clinical data were retrospectively reviewed. The relationship between 1p/19q codeletion and other clinical features including age,sex,location of tumors and the expression of MGMT was analyzed.Results Among 63 patients,38 were male and 25 were female.The mean age of patients was 41.7 years.Codeltion of 1p/19q was detected in 16 cases(25.4%).There were no statistical differences in sex, age and tumor location between glioma patients with and without 1p/19q codeletion.Codeletion of 1p/19q,in an descend order,was detected in oligodendrogliomas(9/16),anaplastic oligodendrogliomas(3/8),astrocytomas(2/10),anaplastic astrocytomas(1/6)and glioblastoma multiforme(1/21).There were statisticaldifferencesinthedistributionof1p/19qindifferentpathologicaltypes(P<0.01).Among63cases,34wereMGMT-positive and 29 were MGMT-negative.No statistical differences of status of 1p and 19q codeletion were found between MGMT-positive and-negative tumors.Conclusions 1p/19q codeletion is associated with oligodendroglial tumors and is a useful marker for pathological diagnosis.
Glioma 1p/19q codeletion MGMT Pathology
R651
A
2011-05-16)
(责任编辑:甘章平)
* 华南肿瘤学国家重点实验室 中山大学肿瘤防治中心神经外科(广州 510060)
(E-mail:chenzhp@sysucc.org.cn)
△ 病理科
