首发精神分裂症听觉感觉门控异常的功能磁共振研究☆
2011-04-18卓永宁冀宾梅维马树华景举珍伍秋林
卓永宁冀宾梅维马树华景举珍伍秋林
·论 著·
首发精神分裂症听觉感觉门控异常的功能磁共振研究☆
卓永宁*冀宾△※梅维△※马树华△※景举珍△※伍秋林△※
目的 探讨首发精神分裂症患者听觉门控异常与脑功能异常激活之间的关系。方法 11例首发精神分裂症患者及11名年龄、性别、受教育程度相匹配的正常对照进行脑功能磁共振成像,实验采用多声音刺激和单声音刺激比较的范式,以多声音刺激减单声音刺激的对比探测感觉门控的脑激活效应。以SPM2处理脑影像数据,使用两样本t检验比较两组间听觉感觉门控脑功能激活的差异。结果 患者组的感觉门控脑激活在右侧海马(x=24,y=-28,z=-8,体素集合数=16)、右侧丘脑(x=8,y=-4,z=4,体素集合数 =22)低于正常对照组(t=3.57,P=0.001;t=3.38,P=0.001)。结论 首发精神分裂症患者的听觉门控异常可能与海马、丘脑等脑区的功能激活异常有关。
精神分裂症 听觉 感觉门控 功能磁共振
研究显示,精神分裂症存在感觉门控(sensory gating,SG)功能缺损[1],但其相关的异常脑区仍不清楚。目前已有一些研究使用功能磁共振成像(functional magnetic resonance imaging,fMRI)探讨了精神分裂症患者听觉SG、体感SG异常的脑机制[2-4],初步结果显示SG异常时存在海马、丘脑、前额叶皮质等脑区的激活异常。此外,也有关于正常人SG功能的脑机制的研究探讨[5]。这些fMRI研究各自采用的SG刺激范式不同,研究结果也不尽相同。在丘脑的异常激活较一致,而对于海马的异常激活则存在一定的争议[5]。但既往的SG研究对象均为服药治疗后病情稳定的精神分裂症患者[2-3]。故本研究以未服药的首发精神分裂症患者进行fMRI研究,进一步探讨精神分裂症SG功能异常的脑机制。
1 对象与方法
1.1 研究对象 为来自2009年1月 ~2010年11月间汕头大学精神卫生中心门诊和住院的首发精神分裂症患者。入组标准:①符合中国精神障碍分类与诊断标准第三版(CCMD-3)的精神分裂症诊断标准;②汉族,年龄 18~45岁;③发病后首次就诊;④未服用抗精神病药、抗抑郁药、抗癫痫药、心境稳定剂或苯二氮类等精神科药物;⑤无听力损害(主观听阈 <40 dB)。排除标准:①患其他精神疾病;②患神经系统疾病;③有药物及酒精滥用史;④磁共振扫描禁忌症。共11例患者,男6例,女5例;年龄19~34岁,平均(26.31±6.96)岁;病程1~48个月,中位数 3个月;教育年限6~16年,平均(9.45±4.42)年。均为右利手。
正常对照组均为广告征集的志愿者,自愿参加本研究并身体健康;经询问均无神经精神疾病史及家族史,在年龄、性别、受教育程度方面与患者组匹配。共11名,男6名,女5名;年龄18~33岁,平均(24.23±5.03)岁;教育年限6~16年,平均(10.22±2.26)年。患者组和对照组的性别构成相同,两组年龄和受教育年限方面的差异均无统计学意义(t=0.85,P=0.41;t=1.02,P=0.33)。本研究所有被试或其监护人均签署实验知情同意书。
1.2 fMRI脑成像 MRI数据采集由汕头大学医学院第一附属医院磁共振室技师完成,使用1.5 T Philips MR扫描仪及标准的正交头部线圈。实验时,被试者仰卧在磁共振扫描仪里,通过磁共振环境下专用的耳机和目镜(美国RT公司生产的视听刺激仪Goggle)接收听觉和视觉刺激。每位受试首先接受一组结构像、四组功能像的扫描、一组三维全脑结构像的扫描。二维结构像采用T1加权自旋回波(SE)序列,轴位,TR为505 ms,TE为14 ms,翻转角90度,层厚6 mm,无间距,层数20,视野230 mm×230 mm,矩阵256×256。功能像扫描采用T2*加权梯度平面回波(GE-EPI)序列,参数为:轴面20层,覆盖全脑,TR为2000 ms,TE为45 ms,翻转角度为90度,矩阵为64×64,视野为230×230,层厚为6 mm,无间距。三维全脑结构像采用T1加权小角度激发快速梯度回波(FLASH)序列。
fMRI实验刺激采用混合设计,共4个run(4组相似的任务刺激),每个run共150个TR持续5 min。被试接受的声音刺激包括3种:A:长10 ms的单一声音刺激(以下简称“1”声音刺激),B:长10 ms间隔500 ms的9个声音刺激(以下简称“9”声音刺激)连续出现,共计4 s;C:无声音。每种情况单独出现在10 s长的时间段落内,其中单一声音刺激A出现在第6 s时,多声音刺激B的第一个声音出现在第4 s时。每个run包括AA、AB、AC、BC、BB等5个序列,每个序列随机重复出现3次,每个 run长 5 min,每个 run都观看同一段视频作为刺激背景 (参考2007年 Tregellas等[2]的范式修改)。实验声音刺激序列使用专用软件E-prime1.1制作和播放。多次声音刺激减单次声音刺激(以下用“9-1”表示)可反映听觉 SG效应[2]。
1.3 数据分析 患者组和正常对照组各12例参加了本研究,但均各有1例因头动过大导致fMRI数据质量差而被剔除,最后各11例进入分析。采用统计参数图(statistical parametric mapping,SPM)软件对单个被试的数据进行处理分析,包括时间校正、头动矫正、空间标准化、空间平滑等预处理,再进行线性多重回归分析,得到各种声音刺激的激活统计参数(主要是单声音、多声音,二者的比较即SG效应,无声音视作基线水平)。个体分析后的数据结果再进行组水平的分析,其中组内分析使用单样本t检验,主要关注听觉刺激激活的有效性。最后将两组被试数据进行组间分析,使用两样本t检验比较患者组与对照组间SG脑激活的差别。全脑分析时,将P值小于0.005水平且连续大于10个以上激活体素集合视为激活差异有统计学意义。在全脑分析以后进行的感兴趣区(ROI)分析,使用 Marsbar软件,提取感兴趣解剖脑区内听觉SG效应的平均激活强度(百分比);采用SPSS13.0软件进行两组的两样本t检验,进一步验证全脑分析结果的可靠性。ROI分析时P< 0.05视为差异有统计学意义。
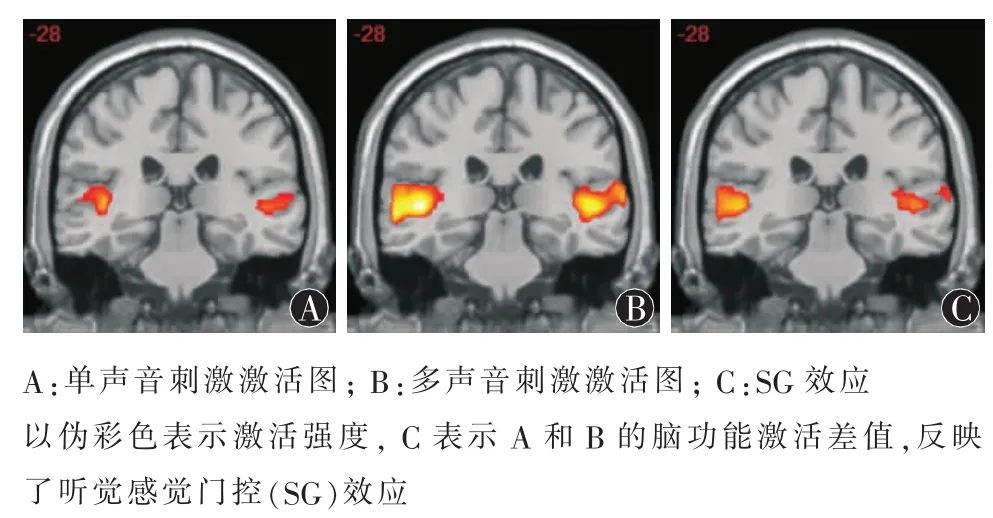
图1 组分析所得各种声音刺激在双侧听觉区的激活图

图2 患者组感觉门控功能下激活小于对照组的脑区(全脑分析)

图3 患者组在9次声音刺激下激活大于对照组的脑区(全脑分析)

图4 右侧海马解剖脑区的ROI分析
2 结 果
2.1 全脑分析结果 所有被试先进行组内分析,结果显示双侧听觉区在单声音刺激、多声音刺激、多声音刺激减单声音刺激(感觉门控)条件下均见显著激活(P<0.005,大于10个体素),提示本实验声音刺激有效。见图1。
9-1即感觉门控效应下脑激活的比较结果显示,患者组右侧丘脑(x=8,y=-4,z=4,体素集合数 =22)、右侧中央前回(x=40,y=-16,z=40,体素集合数 =17)、右侧海马及后扣带回(x=12,y=-36,z=12,体素集合数=25)的激活较对照组减弱(t=3.38,P=0.001;t=4.54,P=0.0001;t=3.77,P=0.001)。
9次声音刺激条件下的脑激活比较结果显示,患者组在右侧海马后部的(x=24,y=-28,z=-8,体素集合数 =16)激活较对照组减弱(t=3.57,P=0.001),见图3。两组间在1次声音刺激下无脑区存在显著激活的差异。双侧听觉区在各种刺激条件(1,9,9-1)对比下均未见显著的组间激活差异。
2.2 基于解剖脑区的ROI分析 9-1的激活信号变化百分比在患者组的均值为-0.02%(-0.21%~0.20%),在正常对照的均值为0.08%(-0.03%~0.34%)。9激活信号变化百分比在患者组的均值为-0.02%(-0.27%~0.24%),在正常对照的均值为0.09%(-0.07%~0.38%)。与对照组比较,患者组9-1及9次声音刺激下右侧海马ROI的激活均减弱(P<0.05)。见图4。两组在完整的左、右侧丘脑及左侧海马的脑激活均未见明显差异(P>0.05)。
3 讨论
本课题组之前的EEG研究已表明,首发精神分裂症患者的P50异常[6-7]。此次又运用fMRI技术探查了首发精神分裂症患者听觉SG功能异常的脑神经机制。感觉门控电生理指标P50是采用的成对声音刺激(S1与 S2)诱发模式,条件刺激(S1)和测试刺激(S2)相隔500 ms,患者在极短的时间内分辨声音以反映感觉门控的效应。虽然fMRI空间分辨率较高,但时间分辨率尚不足以探测500 ms时间间隔的刺激激活差异。故Tregellas等[2]创新设计了多声音刺激(10 ms间隔 500 ms的九个声音刺激连续出现)对比单声音刺激(10 ms),将多声音刺激(相当与P50中的成对声音刺激)信号变化减去单声音刺激的信号变化(即9-1)作为感觉门控SG的效应。Tregellas等[2]的研究表明,P50与 fMRI的检测结果具有较好的相关性,表明该fMRI范式能够良好检测SG的功能异常。
Tregellas等[2]的研究采用 fMRI簇时、间断扫描,虽然可以更好地体现听觉刺激的效果,但是有一定的提示作用,可使被试者提前注意并预期声音刺激的出现,从而减弱了感觉门控效应的客观性(听觉感觉门控反应本身应是基于被动状态下,而非主动反应),带来额外的混杂因素。本研究故采用传统的连续扫描模式,以避免簇时、间断扫描的提示作用。本研究的fMRI脑激活全脑分析结果显示:双侧听觉区在组内分析中不同声音刺激条件下均见显著激活,而组间比较未见显著激活差异。由此说明各组被试接受的声音刺激具有等效性,其听觉中枢对声音刺激的反应无差别,从而表明了此范式连续扫描模式的有效性。
既往的多个研究已表明,海马在介导SG效应中可能具有重要作用。Boutros等[8]用侵入式脑内电极脑电图研究了海马介导SG效应的基础机制。Grunwald等[9]用类似方法发现 SG效应的脑电图表现主要体现在海马、颞顶叶、前额叶等脑区。Krause等[10]的动物研究发现,海马在SG效应中主要参与中间神经元与神经递质的抑制作用。丘脑通过大脑联络区向皮质传递扩散信息,从而参与调控整个神经系统的活动。Boutros等[8]的研究显示,丘脑网状核所介导的皮质信息在SG中起着重要作用。丘脑中的上丘在间接调节听觉SG及抑制神经递质传递中有着非常重要的作用[11]。上述研究提示海马及丘脑都参与SG的调控。而采用fMRI来研究首发(未服药)精神分裂症患者的SG调控尚未见报道。本研究中,在9-1感觉门控声音刺激范式下,精神分裂症患者组右侧海马、右侧丘脑的激活较对照组异常,也提示海马、丘脑可能是精神分裂症SG异常的相关脑区。Tregellas等[2]的研究和本研究使用相似的fMRI研究范式,同样也发现精神分裂症患者的SG缺损与海马、丘脑的异常功能激活有关。Kumari等[3]使用PPI范式结合fMRI研究SG,也发现服药治疗的精神分裂症患者在海马、丘脑、岛叶等脑区表现出异常功能激活。上述结果表明在首发及服药精神分裂症患者中,都存在海马、丘脑等脑区的SG异常功能激活。本研究结果中右侧海马激活在患者较正常被试减弱,而左侧海马未见显著激活,可能与门控处理的优势半球有关[12]。
本研究结果中,9-1和9声音刺激模式在患者组有异常,而1模式没有异常,提示单声音刺激较弱,不足以显示听觉刺激激活的差异,而只是听觉门控效果9-1刺激范式的组份。本研究的ROI分析结果也显示,听觉门控在丘脑、海马的激活差异主要来源于 9,这与 Tregellas等[2]的结果基本一致。在另外的研究中,Tregellas等[13]只使用连续城市噪声作为刺激进行了精神分裂症的fMRI研究,也发现了类似听觉门控刺激在丘脑、海马的脑激活异常。
本研究在全脑分析以后进行了感兴趣区(ROI)分析,是为了进一步验证全脑分析结果的可靠性。本实验结果中,精神分裂症患者海马、丘脑与正常人相比,听觉SG激活减弱,全脑结果和ROI结果对比,右侧海马的异常较一致,而右侧丘脑在ROI分析未见明显差别。可能是因为ROI分析采用完整解剖定义的丘脑范围较大,包含多个核团区,而全脑分析结果的差别只显现在其内某些核团区而非全部丘脑 (如图2所示),ROI分析时则平均统计了全部解剖丘脑的激活结果而未能显示其内的某些核团区存在的激活差异。
本研究结果中还显示了精神分裂症患者右侧中央前回、右侧后扣带回的SG激活差异,这两个脑区在既往的SG研究结果中报道不多。中央前回的SG激活差异在Tregellas等[2]的研究结果中也有显示,而后扣带回的异常激活在本研究结果中是与海马的激活连续在一起的 (属于同一个激活体素集合)。这些脑区的显示,要考虑到统计阈值的相对高低对噪声影响的控制水平,以及fMRI本身空间分辨率的相对局限性。所以,与Tregellas等[2]对其研究结果中中央前回的看法一样,本研究结果所显示的右侧中央前回、右侧后扣带回的SG激活差异,其意义须谨慎解释,有待进一步研究。
本研究的对象为未服药首发精神分裂症患者,避免了药物对实验结果,特别是对fMRIBOLD信号的影响[14],虽然样本量不大,但所发现的海马、丘脑的脑功能异常,对既往的精神分裂症SG研究结果具有重要的支持意义和补充作用。本研究选择的是处于急性期且合作的首发精神分裂症患者,并未与抗精神病药物治疗后稳定期的患者进行直接对比研究。对参加本研究的患者药物治疗后的追踪复查是以后重要的研究方向。
[1]Wan L,Friedman BH,Boutros NN,et al.P50 sensory gating and attentional performance[J].Int J Psychophysiol,2008,67(2):91-100.
[2]Tregellas JR,Davalos DB,Rojas DC,et al.Increased hemo-dynamic response in the hippocampus,thalamus and prefrontal cortex during abnormal sensory gating in schizophrenia[J].Schizophr Res,2007,92(1-3):262-272.
[3]Kumari V,Antonova E,Geyer MA,et al.A fMRI investigation of startle gating deficits in schizophrenia patients treated with typical or atypical antipsychotics[J].Int J Neuropsychophamacol,2007,10(4):463-477.
[4]Hazlett EA,Buchsbaum MS,Zhang J,et al.Frontal-striatalthalamic mediodorsal nucleus dysfunction in schizophrenia-spectrum patients during sensorimotor gating[J].Neuroimage,2008,42(3):1164-1167.
[5]Mayer AR,Hanlon FM,Franco AR,et al.The neural networks underlying auditory sensory gating[J].Neuroimage,2009,44(1):182-189.
[6] 万晓娜,蒋廷云,江丽云,等.首发精神分裂症患者及其一级亲属感觉门控P50研究[J].中国神经精神疾病杂志,2007,33(9):544-547.
[7]Hong X,Chan RC,Zhuang X,Jiang T,et al.Neuroleptic effects on P50 sensory gating in patients with first-episode nevermedicated schizophrenia[J].Schizophr Res,2009,108(1-3):151-157.
[8]Boutros NN,Trautner P,Rosburg T,et al.Sensory gating in the human hippocampal and rhinal regions[J].Clin Neurophysiol,2005,116(8):1967-1974.
[9]Grunwald T,Boutros NN,Pezer N,et al.Neuronal substrates of sensory gating within the human brain[J].Biol Psychiatry,2003,53(6):511-519.
[10]Krause M,Hoffmann WE,Hajos M,et al.Auditory sensory gating in hippocampus and reticular thalamic neurons in anesthetized rats[J].Biol Psychiatry,2003,53(3):244-253.
[11]Magnee MJ,Oranje B,vanEngeland H,et al.Cross-sensory gating in schizophrenia and autism spectrum disorder:EEG evidence for impaired brain connectivity[J].Neuropsychologia,2009,47(7):1728-1732.
[12]Thoma RJ,Hanlon FM,Moses SN,et al.Lateralization of auditory sensory gating and neuropsychological dysfunction in schizophrenia[J].Am J Psychiatry,2003,160(8):1595-1605.
[13]Tregellas JR,Ellis J,Shatti S,et al.Increased hippocampal,thalamic,and prefrontal hemodynamic response to an urban noise stimulus in schizophrenia[J].Am J Psychiatry,2009,166(3):354-360.
[14]Braus DF,Ende G,Weber-Fahr W,et al.Antipsychotic drug effects on motor activation measured by functional magnetic resona nce imaging in schizophrenic patients[J].Schizophr Res,1999,39(1):19-29.
Functional magnetic resonance imaging (fMRI) study of abnormal auditory sensory gating in first-episode schizophrenia.
ZHUO Yongning,JI Bin,MEI Wei,MA Shuhua,JING Juzhen,WU Qiulin.The Mental Health Center of Shantou University,Taishan North Road,Shantou 515063.China.Tel:0754-82902702.
Objective The present study was conducted to explore the correlation of sensory gating deficits with abnormal brain activation in the first episodic schizophrenia.Methods Eleven schizophrenia patients in the first episodic and 11 healthy controls matched in gender,age,education underwent a fMRI auditory sensory gating task.The experiments were performed using multi-and single click stimulation and the brain activation of sensory gating effects was measured using“multi-clicks minus single click”.The results were analyzed using SPM2 and the data from two groups were compared by two sample t-test.Results Compared with healthy controls,schizophrenia patients showed decreased activation in the right hippocampus(x=24,y=-28,z=-8,cluster=16 voxels,t=-3.57,P=0.001)and right thalamus(x=8,y=-4,z=4,cluster=22 voxels,t=-3.38,P=0.001)during the fMRI sensory gating task.Conclusion Our data indicate that the abnormal brain activation in the hippocampus and thalamus may be related to the sensory gating deficits in the firstepisode schizophrenia patients.
Schizophrenia Auditory Sensory gating fMRI
R749.3
A
2011-04-06)
(责任编辑:曹莉萍)
☆ 广东省科技计划项目(编号:2008B030301367),国家自然科学基金面上项目(编号:81072905)
* 四汕头大学精神卫生中心(汕头 515063)
(E-mail:zyn1683@126.com)
△汕头大学医学院第一附属医院
※ 广东省医学分子影像重点实验室
