连续温度变化对β-1,3-葡聚糖酶酶解酵母β-葡聚糖的影响
2011-02-09段峰卢雪梅段永成高培基
段峰,卢雪梅,段永成,高培基
山东大学 微生物国家重点实验室,济南 250100
温度是生命环境的重要因素之一,是生命科学研究工作中必须控制的首要条件。研究温度对生命体生长繁殖的影响,以及温度对生物酶反应的效率等是生命科学研究领域中的一个关键内容。目前实验室所用恒温装置主要是空气浴、水浴形式,对温度的控制为一室一控。在一个恒温装置中进行一次实验只能获得一个温度点的特性数据,欲完成一条温度特性曲线的完善描述,还需要多次实验才能完成,由于多次实验要受到环境条件、仪器稳定性、试剂配制、操作手法等不确定性因素干扰,所得各温度点的数据不适合温度特性研究工作。综观已报道的温度对微生物生长和产物形成过程分析的报告,都是依据上述温度梯度试验结果而作出的,通常都是相隔5 ℃和温差±1 ℃下得到的,由此可见一个确切的温度影响的动力学过程是难以得到的,特别是对于“转折点”的判断会造成显著误差,而这又是微生物生理学和生物工程学上的重要参数。早在1958年,Halldal和French开始利用金属铝板产生温度梯度,在其上铺琼脂介质支持海藻生长,并利用水槽、毛玻璃、纸梳形成光照梯度,进行温度与光照两个因素对海藻生长影响的研究[1]。后来有许多研究者改进或自行设计新型温度梯度装置进行温度特性的相关研究工作。Thompson利用自制“温度梯度栅”研究了温度对野生植物种子的发芽影响与其对自身生长环境适应性的关系[2];Blankley等利用灯泡为热源,冷端暴露等设计了一种简易的温度梯度产生装置,研究了温度对卡氏球钙板藻Cricosphaera carterae 生长的影响[3];Youdeowei采用金属铜片作为温度梯度产生介质,研究了红蝽Dysdercus intermedius的温度适应行为[4];Clark等设计了一种不连续温度梯度小室装置,研究了细胞生长与病毒复制的温度特性[5];Battley在前人设计基础上,改进并研究了连续温度梯度下微生物生长的最大、最适、最低生长温度,解决了非连续梯度实验中个别的适应性生长现象给判定生长温度极限带来的误差[6];Siver改进了培养海藻的装置,使其可产生较大范围的温度梯度[7]。近些年,出现了一些较为特别的改进。Wolf等设计了微型化、稳定线性化的温度梯度装置[8];Mao等设计了一种可控微流多通道的线性温度梯度装置,可广泛用于研究催化反应活化能、熔点、荧光量子产生曲线等[9];Grodzicki等在传统温度梯度装置上加装红外线探测器,并接入计算机实时记录,研究了蜜蜂和蟑螂适应温度个体和群体表现行为的差异[10]。另外还有许多采用相似温度梯度装置进行研究的报道[11-15]。
作者依据金属板能产生连续温度梯度的特性与生物温度特性研究工作的需要,设计了具有连续温度梯度板面和等间隔温度梯度孔等的实验装置,可在温度梯度孔中放置 2×20个实验管,可一次获取20个梯度温度点的特性数据,足以精确描绘温度特性曲线,可广泛应用于微生物液固培养、生物酶反应、植物种子发芽、昆虫繁育等相关生物技术领域的温度特性研究。
β-1,3-葡寡糖是重要的功能性糖,可作为植物抗真菌病害免疫促进剂,也有抗糖尿病活性[16],还可诱导人血细胞产生抗肿瘤因子[17]等。本室研究获得一株壳聚糖酶产生菌Mitsuaria chitosanitabida H12 (CGMCC 2949),研究发现其产生一种内切型β-1,3-葡聚糖酶,可用来制备β-1,3-葡寡糖,并发现温度是影响水解产物组分的重要因素,对其不同温度下的酶解进一步研究有望获得大分子产物,扩大该酶的应用领域。本文利用生化温度特性实验仪详细研究了温度对该酶酶解酵母 β-葡聚糖过程的影响,求出了反应活化能、温度衰减方程、产物组分变化等。
1 材料与方法
1.1 供试菌株与β-1,3-葡聚糖酶
Mitsuaria chitosanitabida H12,由山东大学微生物国家重点实验室提供;经由液体发酵、离心获得上清、硫酸铵盐析获得粗酶,该粗酶经分离纯化为单一内切型β-1,3-葡聚糖酶,其最适反应温度和pH分别为52 ℃和5.2。
1.2 主要仪器与试剂
温度梯度产生装置为自制生化温度特性实验仪(专利号:201020015088.1),示意图见图1。该仪器通过在金属铝板两端分别加热和制冷形成线性温度梯度,并具有 20个等温差梯度孔和连续的温度梯度板面,温度波动范围小于±0.1 ℃,设计高端极限95 ℃,低端极限−2 ℃,最大温差60 ℃。利用等温差梯度孔进行固体试验时采用普通试管;液体试验时采用“L”型试管,封闭端插入试验孔中,开口端向上,温度梯度板以图1“C”为中轴作弧形往复转动,则试验液体在管中作往复流动。利用连续温度梯度板面进行试验时可采用普通平皿。
β-葡聚糖购于安琪酵母有限公司,β-葡聚糖含量70%;昆布二糖、昆布五糖购于 Seikagaku Kogyo (Japan);昆布三糖、昆布四糖购于 Sigma-Aldrich (USA);其他试剂为分析纯,水为去离子水。
1.3 β-葡聚糖的酶解方法
将 β-葡聚糖和0.2 mol/L乙酸缓冲液 (pH 5.2)以3.5 ∶ 100 (W/V) 的比例混匀后,121 ℃灭菌30 min,趁热磁力搅拌并自然冷却。每支“L”型试管分装9.00 mL,插入试验孔 (图1B所示) 中并转动梯度板进行预热15 min,分别加入1.00 mL酶液,在设定时间点取样,每次取样200 μL,加入含800 μL无水乙醇的1.5 mL离心管中,混匀终止反应,10 000 r/min离心5 min,取上清备用。
1.4 酶解产物的分析
1.4.1 酶解产物的还原糖分析
采用DNS法测定[18]:取400 μL适当稀释后的样品加入DNS试剂400 μL,沸水浴10 min,立即冷却,取200 μL加入96孔板,并于酶标仪 (Victor3TMV,PE company,USA) 上550 nm读数,以葡萄糖为标准还原糖当量计算还原糖浓度。

图1 生化温度特性实验仪主要组成部件示意图Fig. 1 Diagram of Biochem-temperature Characteristic Apparatus. One end of aluminum board contains cartridge heaters (E), and the other end is connected to the circulating cooling device. Temperature is monitored by adjacent thermistor. The pump (D), tank, refrigerator, temperature controller, motor, and all the other components of the apparatus are placed in chassis except the aluminum board which was supported by bracket.
1.4.2 酶解产物的组分分析
酶解产物寡糖组成由薄层色谱 (TLC) 进行分析,薄层板采用TLC-60 plate (Merck TLC Silica gel 60 F254),点样采用半自动电动点样仪 (上海科哲生化科技有限公司),展层剂为乙酸乙酯∶乙酸∶水= 2∶2∶1 (V∶V∶V) ,显色条件为10% (V/V) 硫酸-乙醇溶液喷雾后130 ℃加热10 min[19]。
1.4.3 酶解产物的纯化
酶解液经离心获得上清,减压蒸发至折光10%~15%,加入1%活性炭于70 ℃保温30 min脱色,脱色液进行活性炭柱层析分离[20],洗脱液为水∶乙醇 (V/V)=1∶3,洗脱液经减压蒸发除掉乙醇,冷冻干燥后为纯化的酶解产物样品。
2 结果与分析
2.1 温度对 β-1,3-葡聚糖酶酶解酵母 β-葡聚糖的影响
对于生物酶酶解反应来说,一般是温度升高则反应速度提高,在长时间酶解反应过程中,过高的温度可提高初始速度但加速酶的失活,不利于产物的积累,而较低的温度有利于酶的稳定。利用生化温度特性实验仪,在22 ℃~60 ℃范围内以2 ℃为间距的20个等温差实验点,进行了酶解实验,研究了温度对该酶酶解酵母 β-葡聚糖反应过程的影响。图2为采用Interpolant函数 (MATLAB R2009b sftool)以温度和时间对产物浓度作图。从图 2上的不对称可以得出,随水解时间的延长,产物积累最大的温度并不是一成不变的,而是略微下降的。即酶解反应开始1 h内,最大产物积累接近50 ℃,而9 h则下降到40 ℃附近。
通过对每个采样时间点的数据进行Gaussian函数平滑(MATLAB R2009b cftool),并获得最大值对应的温度,以时间对其作图 (图 3),在采样时间区域内的最适温度随时间的变化呈指数衰减。其中由拟合方程参数c给出的极限最适温度39.54 ℃与该酶的热稳定性相吻合 (40 ℃以下保温24 h,残存活力大于90%,数据未列出);由方程指出的0时刻的最适温度49.32 ℃与该酶的最适反应温度52 ℃相接近,说明该指数方程能很好的解释最适酶解温度随时间的变化过程。

图2 温度与反应时间对酶解产物生成的影响Fig. 2 Effects of temperature and reaction time on the hydrolytic products. Yeast β-glucan was hydrolyzed by β-1,3-glucanase (1 U/mL) under different temperature (22 °C−60 °C, 2 °C intervals) on the Biochem-temperature Characteristics Apparatus.

图3 最适酶解温度与时间的关系Fig. 3 Relationship between the optimum temperature and the reaction time. The optimum temperature at each time point was solved by Gaussian curve fitting in MATLAB R2009b to the data from Fig.2.
该酶对酵母 β-葡聚糖的水解历程符合双曲线方程,如图4的46 ℃、48 ℃所示;而58 ℃、60 ℃等高温区,因酶快速失活,用双曲线拟合极限比较准确,但相应初速度的拟合值偏差会较大;24 ℃、26 ℃等低温区,酶解历程基本呈直线变化,同用双曲线拟合,与高温区相反,初速度较为准确,极限值并不合理。说明酶解过程在高温区产物积累速度迅速减低,主要是伴随着酶的热失活;而低温区,酶解速度微量下降主要是由于底物浓度的下降引起的。
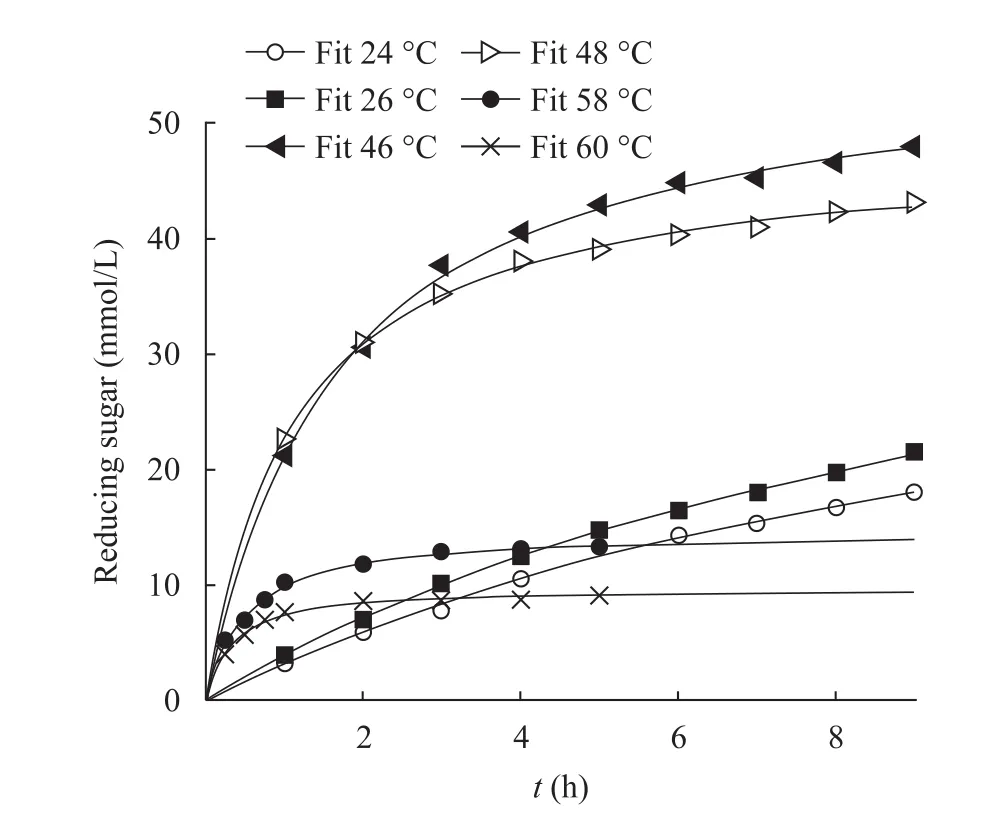
图4 酵母β-葡聚糖的酶解反应历程Fig. 4 Hydrolytic process of yeast β-glucan by β-1,3-glucanase at different temperature. The data for hyperbolic curve-fitting came from Fig. 2.
根据酶解反应历程曲线,求得每个温度下的酶解反应初速度 (原点处的一阶导数) 代替反应速率常数,并以−1/RT对其做图 (图5),可以得到酶解最大初始反应速度在 48 ℃~50 ℃(−1/RT=[−3.745,−3.722]×10−4)之间,从全部数据范围看,该反应类型不符合阿累尼乌斯经验公式,然而48 ℃之前的反应可以用阿累尼乌斯经验公式来解释,其活化能Ea为84.17 kJ/mol。
2.2 温度对酶解产物组分的影响
2.2.1 对酶解产物组分的TLC分析

图5 酶解反应初始速度与温度的关系Fig. 5 Initial reaction rate changed with temperature. The xlabel, ‘R’ is molar gas constant and ‘T’ is absolute temperature.‘V0’ is initial velocity, ‘A’ is pre-exponential factor, ‘Ea’ is activation energy. The initial velocity at 22 °C−48 °C was solved by hyperbolic fitting and seeking the first-order derivative at its origin (0) point.

图6 不同温度酶解产物组分的TLC分析Fig. 6 Thin-layer chromatography of hydrolytic products of yeast β-glucan by β-1,3-glucanase at different temperature. G is glucose; L2−L5 are laminaribiose, laminaritriose, laminaritetraose and laminaripentaose, respectively. ‘S’ is 1,3-β-D-glucooligosaccharide markers comprising G and L2−L5.
温度对该酶酶解酵母 β-葡聚糖的影响,不仅表现在酶解产物生成速度上 (图 4),而且表现在水解产物组分上。上文2.1节的8 h产物经薄层色谱分析(图6),结果显示,酶解产物组分随温度变化可以划分为4个部分:1) 50 ℃以上,产物主要以昆布二糖和昆布三糖为主;2) 46 ℃~42 ℃,大于昆布三糖的寡糖比例已经有明显增加;3) 38 ℃~30 ℃,以昆布二糖-五糖为主;4) 30 ℃以下,产物以昆布五糖及更大分子量的寡糖为主。
2.2.2 酶解产物组分的13C NMR鉴定
酶解产物样品,同标准品昆布二糖和昆布三糖用D2O配制成20 mg/mL进行13C NMR (AVANCE 400) 测定,结果见图7。根据SDBS数据库 (Spectral Database for Organic Compounds,Japan) 中的昆布二糖 (SDBS No.11561)13C NMR图谱说明,其β-1,3-D-glycosidic的C3特征化学位移在83和85附近,样品与标准品对照完全一致,为 1,3-β-D-葡寡糖。
3 讨论
3.1 生化温度特性实验仪
诸如前言中所述,温度梯度装置的发展中有许多研究工作者对其做了相应改进,以求达到实验目的和要求。这些改进主要分为 2个方面:一是温度梯度装置本身,例如,在梯度板上做圆孔配合试管达到不连续温度梯度液体培养的需求[21-23];在梯度板上做与梯度平行的凹槽配合试管达到连续温度梯度固态培养需求[6];在梯度板上用绝热材料将板面分成若干小室,配合细胞培养瓶培养细胞和病毒[5]。虽然梯度板的温度梯度是线性的[3],其内部孔也是线性的[21],但是装置两端的温度不是完全线性[5],这是由于分开的小室在温度梯度板外,小室内的温度受环境影响较大。二是附属装置,例如,增加光照部分配合海藻等生长的需求[1,3,7];增加红外探测部分配合昆虫的检测[10]。但它们都是为满足单一实验需求而改进的装置,不适合多用途使用,而附属装置是独立于温度梯度装置外的部分,与仪器本身性能影响无关。

图7 纯化的酶解产物的13C核磁共振波谱Fig. 7 13C NMR of 1,3-β-D-glucooligosaccharide and the purified products.
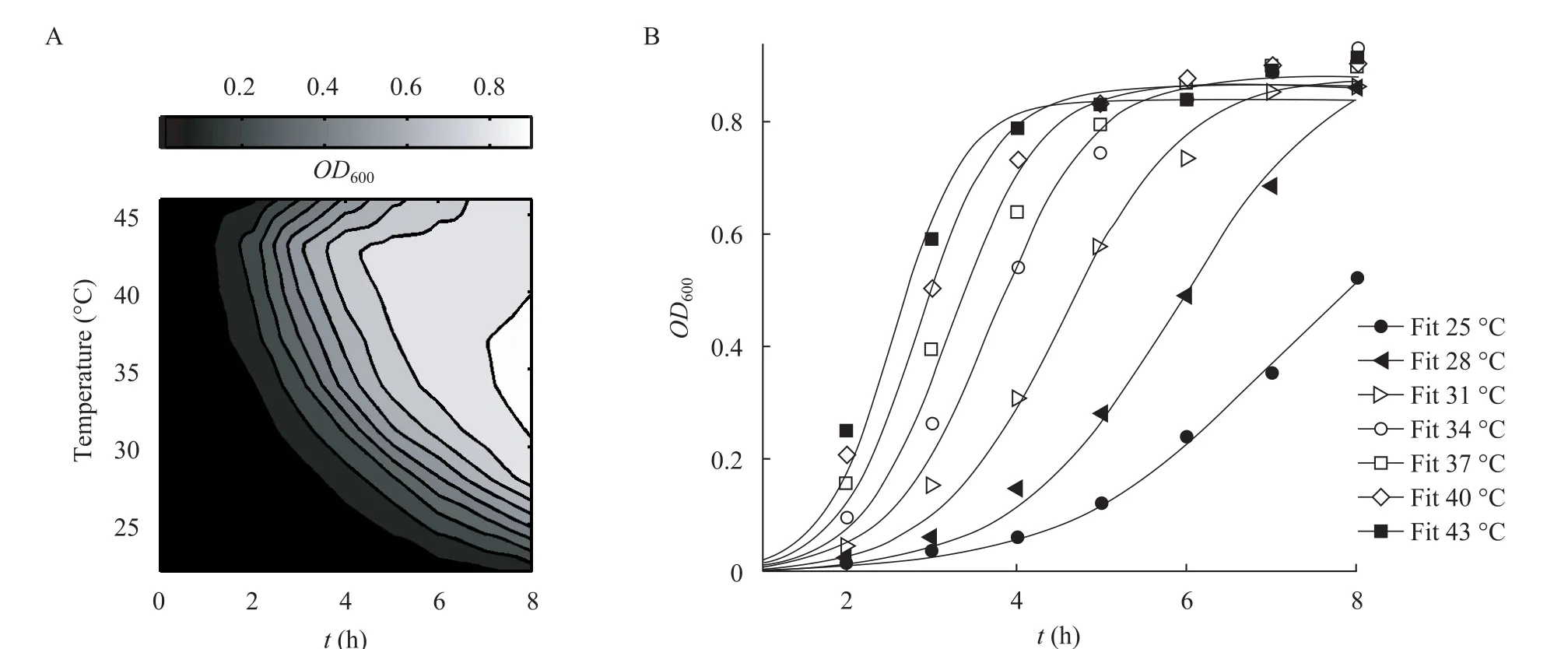
图8 温度对大肠杆菌生长的影响Fig. 8 Effects of temperature on the growth of E. coli. (A) Surface fitting of sample data using interpolant function of MATLAB R2009b. (B) Fitting of logistic equation to the data.
作者综合前人的经验,进一步完善和创新,设计并研制成功了一种用途更广泛的新型温度梯度产生装置,命名为生化温度特性实验仪。该仪器采用分体模块设计,使一套温度梯度系统可以实现多功能。如图1所示为进行液、固培养的梯度板,可以用来研究微生物生长曲线 (图 8)、酶反应历程(图 2)、食用菌菌丝生发与出菇、植物根的生发等;使用工字型梯度板作为母板,分别使用不同配件可以实现固体培养管研究生长温度极限[6,23], Halldal等的平板培养[1],Pires等的昆虫研究[12],还可以实现酶反应的温度、pH与时间多因素影响等研究。除了上文中所述酶解酵母 β-葡聚糖条件的研究工作,作者还利用该仪器进行了大肠杆菌、枯草杆菌、酵母菌、食用真菌等微生物生长的研究,图8所示为大肠杆菌在该仪器上的生长情况,A为interpolant函数 (MATLAB R2009b sftool) 以温度和时间对OD600作图,B为部分数据的Logistic方程拟合,其R2>0.98,可以看出温度特性曲线平滑,具有很强的相关性,比传统手段具有较强优势,这主要是该仪器克服了传统实验中分次进行所造成的菌种不一致性等影响,因为即使以OD600控制每次实验的接种量也不能保证菌种的生理状态完全一致[24];同时,该仪器的弧形往复振荡方式优于旋转与直线往复摇瓶机的性能,利于液体均匀混合与增加溶氧。
与温度有关的多因素实验中,该仪器在微生物生长温度特性曲线研究中的优势上文已论述,而如酶反应等实验材料的稳定性影响可以忽略,因此传统的分批次实验对结果影响不大,但存在时间浪费较多的情况。例如作者在研究该酶的最适反应条件时,设计了3个因素 (温度、pH与时间) 和4水平,其中反应时间最长为1 h,则需7 h完成实验,而用该仪器只需2 h即可完成;而且该仪器的温度波动范围为±0.1 ℃,达到超级恒温水浴的精度指标,且波动为同一时间同一方向,操作方便,便于精细研究。
REFERENCES
[1] Halldal P, French CS. Algal growth in crossed gradients of light intensity and temperature. Plant Physiol, 1958, 33(4): 249−252.
[2] Thompson PA. Characterization of the germination response to temperature of species and ecotypes. Nature, 1970, 225(5235): 827−831.
[3] Blankley WF, Lewin RA. Temperature responses of a coccolithophorid, Cricosphaera carterae, measured in a simple and inexpensive thermal-gradient device. Limnol Oceanogr, 1976, 21(3): 457−462.
[4] Youdeowei A. The behaviour of a cotton stainer Dysdercus intermedius (heteroptera, pyrrhocoridae) in a temperature gradient and the effect of temperature on aggregation. Ent Exp Appl, 1968, 11(1): 68−80.
[5] Clark HF, Kaminski F, Karzon DT. Thermoelectrically cooled temperature-gradient apparatus for comparative cell and virus temperature studies. Appl Microbiol, 1970, 19(5): 848−854.
[6] Battley EH. A thermal-gradient block for the determination of temperature relationships in microorganisms. Antonie van Leeuwenhoek, 1964, 30(1): 81−96.
[7] Siver PA. A new thermal gradient device for culturing algae. Br Phycol J, 1983, 18(2): 159−164.
[8] Wolf R, Niemuth J, Sauer H. Thermotaxis and protoplasmic oscillations in Physarum plasmodia analysed in a novel device generating stable linear temperature gradients. Protoplasma, 1997, 197(1/2): 121−131.
[9] Mao HB, Yang TL, Cremer PS. A microfluidic device with a linear temperature gradient for parallel and combinatorial measurements. J Am Chem Soc, 2002, 124(16): 4432−4435.
[10] Grodzicki P, Caputa M. Social versus individual behaviour: a comparative approach to thermal behaviour of the honeybee (Apis mellifera L.) and the American cockroach (Periplaneta americana L.). J Insect Physiol, 2005, 51(3): 315−322.
[11] Cabrera BJ, Rust MK. Behavioral responses to light and thermal gradients by the western drywood termite (Isoptera: Kalotermitidae). Environ Entomol, 1996, 25(2): 436−445.
[12] Pires HHR, Lazzari CR, Schilman PE, et al. Dynamics of thermopreference in the chagas disease vector Panstrongylus megistus (Hemiptera: Reduviidae). J Med Entomol, 2002, 39(5): 716−719.
[13] Kamykowski D. Laboratory experiments on the diurnal vertical migration of marine dinoflagellates through temperature gradients. Mar Biol, 1981, 62(1): 57−64.
[14] Hiroko T, Kumiko O. A temperature gradient apparatus and temperature preference of the thermally acclimated planarian, Dugesia japonica. Comp Biochem Physiol A: Physiol, 1985, 82(4): 805−807.
[15] Fortin MCA, Poff KL. Temperature sensing by primary roots of maize. Plant Physiol, 1990, 94(1): 367−369.
[16] Kim YW, Kim KH, Choi HJ, et al. Anti-diabetic activity of β-glucans and their enzymatically hydrolyzed oligosaccharides from Agaricus blazei. Biotechnol Lett, 2005, 27(7): 483−487.
[17] Miyanishi N, Iwamoto Y, Watanabe E, et al. Induction of TNF-α production from human peripheral blood monocytes with β-1,3-glucan oligomer prepared from laminarin with β-1,3-glucanase from Bacillus clausii NM-1. J Biosci Bioeng, 2003, 95(2): 192−195.
[18] Sumner JB. Dinitrosalicylic acid: a reagent for the estimation of sugar in normal and diabetic urine. J Biol Chem, 1921, 47: 5−9.
[19] Kumagai Y, Ojima T. Enzymatic properties and the primary structure of a β-1,3-glucanase from the digestive fluid of the Pacific abalone Haliotis discus hannai. Comp Biochem Physiol, 2009, 154(1): 113−120.
[20] Chen HM, Zhu P, Yan XJ. Preparation of agarooligosaccharides and its antioxidative activities in vivo. Chin J Mar Drugs, 2005, 24(3): 29−32.陈海敏, 朱鹏, 严小军. 琼寡糖的制备及其体内抗氧化活性的研究. 中国海洋药物, 2005, 24(3): 29−32.
[21] Oppenheimer CH, Drost-Hansen W. A relationship between multiple temperature optima for biological systems and the properties of water. J Bacteriol, 1960, 80(1): 21−24.
[22] Cannefax GR. A temperature-gradient bar and its applications to the study of temperature effects on the growth of Reiter’s treponeme. J Bacteriol, 1962, 83(4): 708−710.
[23] Landman OE, Bausum HT, Matney TS. Temperaturegradient plates for growth of microorganisms. J Bacteriol, 1962, 83(3): 463−469.
[24] Radmer RJ, Kok B. Rate-temperature curves as an unambiguous indicator of biological activity in soil. Appl Environ Microbiol, 1979, 38(2): 224−228.
