重叠延伸PCR克隆三孢布拉霉carRA基因及其功能活性检测系统的构建
2011-02-09汤晖石楠于淼刘龙刘静贾颖牛宏彦张利平
汤晖,石楠,于淼,刘龙,刘静,贾颖,牛宏彦,张利平
河北大学生命科学学院 河北省微生物多样性研究与应用实验室,保定 071002
番茄红素 (Lycopene) 具有极强的清除自由基[1]、诱导细胞分化[2]、增加免疫力[3]、减少 DNA损伤等功能,对防癌抗癌[4]、预防心血管疾病、提高免疫功能和延缓衰老均有一定的疗效[5],因此,具有极大的生产和消费潜力。番茄红素的生产开发项目已成为国际上功能性食品和新药研究的热点,已被纳入我国的“十一五国家高技术研究发展计划”。
在全球范围内,三孢布拉氏霉菌 Blakeslea trispora是实现番茄红素工业化生产的主要菌株。它是一种产 β-胡萝卜素的高产菌,番茄红素是其代谢的中间产物,工业生产上通过添加阻断剂来抑制 β-胡萝卜素生物合成途径中番茄红素环化酶的活性,从而积累番茄红素。番茄红素环化酶由carRA基因编码产生,是否通过基因工程的手段敲除carRA基因,菌体就会积累番茄红素?研究表明:CarRA为双功能蛋白,既有环化酶活性又有八氢番茄红素合成酶的功能活性,而八氢番茄红素合成酶是番茄红素合成途径中上游的关键酶[6]。因此,carRA基因的完全敲除必然导致番茄红素的合成失败。
本研究将构建体外检测番茄红素环化酶和八氢番茄红素合成酶功能活性的筛选模型,为通过定点突变探测 CarRA蛋白番茄红素环化酶活性位点、而不影响八氢番茄红素合成酶功能活性提供检测系统。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
所用质粒及其主要遗传特性如表 1所示。大肠杆菌菌株 DH5α、BL21,三孢布拉氏霉菌菌株ATCC14272及质粒 pET28a为本实验室保存,pMD18-T载体购自 TaKaRa公司,质粒 pAC-LYC由美国马里兰大学Elisabeth Gantt教授馈赠。
1.1.2 主要试剂
pfu DNA聚合酶、Ex-Taq 聚合酶、T4 DNA连接酶、限制性内切酶、dNTPs、凝胶回收试剂盒均购自TaKaRa公司。
1.1.3 PCR扩增引物及序列
引物由北京三博远志生物技术有限责任公司合成 (表2)。
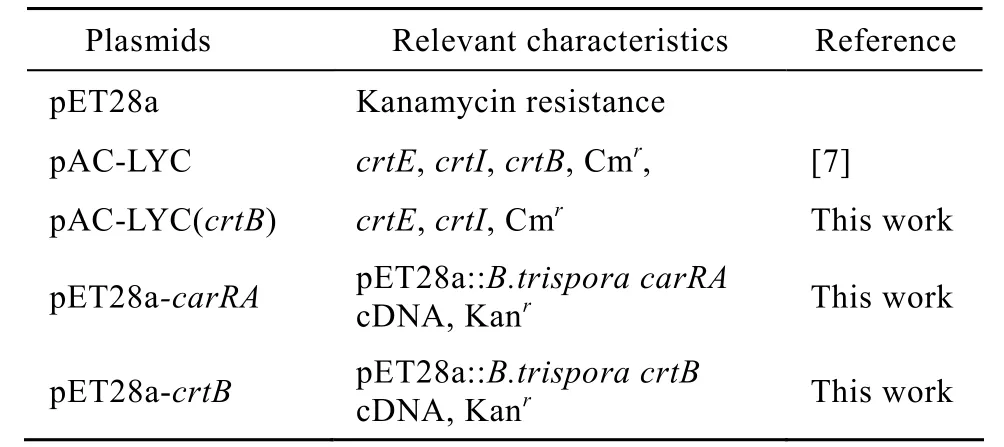
表1 本实验所用质粒及特性Table 1 Plasmids used in this work, and their relevant characteristics
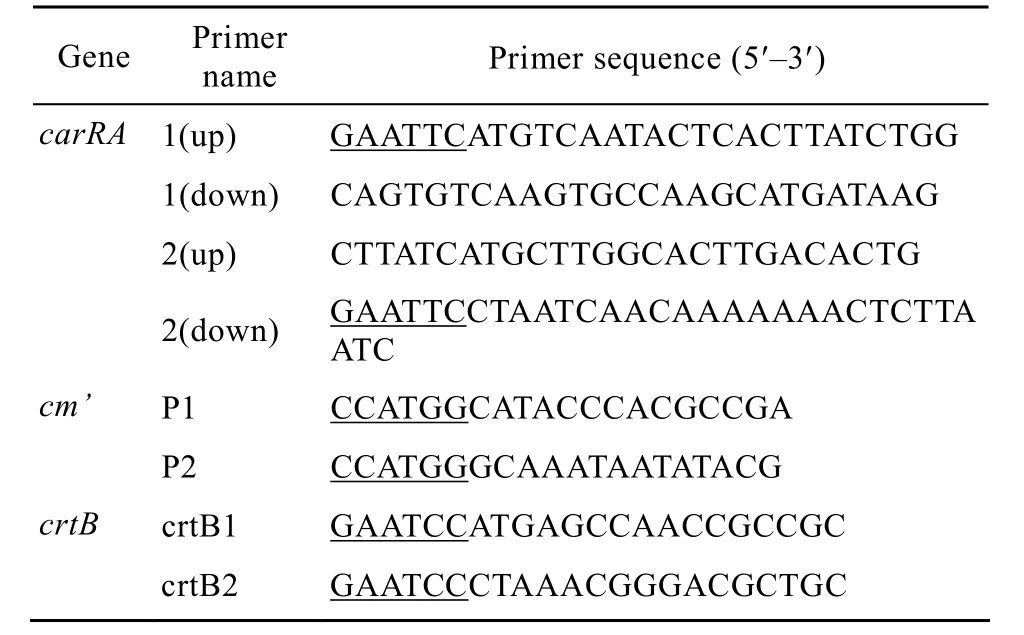
表2 PCR扩增引物及序列Table 2 Primer and primer sequence
1.2 方法
1.2.1 重叠延伸PCR法克隆carRA基因的cDNA序列
以番茄红素环化酶基因 DNA序列 (GenBank Accession No. AY884174.1) 设计引物,扩增上游(1~405 bp) 和下游 (476~1 897 bp) 序列,并分别于相应引物 5′端添加 EcoRⅠ酶切位点。SDS-CTAB法提取三孢布拉霉基因组DNA为模板,分别以1(up)/1(down) 和 2(up)/2(down) 为引物对,pfu DNA聚合酶扩增carRA基因的2个外显子片段。扩增反应条件均为:94 ℃预变性5 min;98 ℃ 10 s,61 ℃ 10 s,72 ℃ 2 min,30个循环。分别回收上轮PCR的2个产物,等摩尔比例混合适当稀释后作为模板,以 1 (up)/2(down) 为引物对,进行第 2轮PCR:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。扩增产物连接至pMD18-T载体,转化大肠杆菌DH5α。PCR初步鉴定后,送上海生工生物技术有限公司进行测序,测序结果用Blastn程序比对。
1.2.2 大肠杆菌表达载体pET28a-carRA的构建和重组子的筛选
提取质粒pMD18-T-carRA,EcoRⅠ完全酶切,回收小片段连接至表达载体pET28a,重组表达载体pET28a-carRA转化大肠杆菌BL21(DE3),卡那霉素抗性基因筛选并PCR初步鉴定后测序验证。
1.2.3 番茄红素环化酶活性的检测
提取质粒 pAC-LYC,转化含有表达载体pET28a-carRA的 BL21(DE3) 感受态细胞,Kan和Cm双抗筛选转化子。pAC-LYC含有细菌来源的类胡萝卜素代谢途径中的 3个基因 crtE/crtI/crtB,在大肠杆菌中能积累番茄红素,环化酶可以催化番茄红素生成类胡萝卜素,菌体将由粉红色变为黄色,因此可以利用颜色的改变初步检测和鉴定环化酶活性。阳性克隆子于含Kan和Cm (终浓度50 mg/L) 的LB 培养基中37 ℃振荡培养至OD600为0.4~0.6时加入终浓度为 1 mmol/L的 IPTG诱导,继续培养至OD600为0.8时,室温振荡培养12~24 h,离心收集菌体观察菌体颜色。以空载体 pET28a转化含质粒pAC-LYC的BL21(DE3) 菌株作为阴性对照。
1.2.4 八氢番茄红素合成酶活性体外检测载体的构建
以载体 pAC-LYC为基础进行构建。pAC-LYC中有2个NcoⅠ酶切位点,分别位于crtB基因和cm抗性基因内部。根据Tn9转座子上的氯霉素抗性基因序列 (GenBank Accession No. V00622.1) 设计引物,扩增cm基因被NcoⅠ切下的约500 bp的片段cm’,用来补全 cm基因提供质粒 Cm抗性。以引物P1和 P2、质粒 pAC-LYC为模板扩增,产物NcoⅠ完全酶切后与 pAC-LYC NcoⅠ完全酶切后的大片段连接,转化感受态细胞 BL21(DE3),氯霉素抗性平板 (终浓度50 mg/L) 筛选。挑取单克隆菌落,PCR初步鉴定后测序验证,重组质粒命名为pAC-LYC△(crtB)。
为进一步验证构建的pAC-LYC△(crtB) 载体的可靠性,进行crtB基因互补试验。依据质粒pAC-LYC中的crtB基因序列设计引物,并添加EcoRⅠ酶切位点,以引物 crtB1和 crtB2进行扩增,回收 930 bp左右的扩增产物连接到pMD18-T载体上,将正向连入的T+crtB质粒进行 SacⅠ/Hind Ⅲ双酶切,连接到质粒pET28a上,转化大肠杆菌BL21(DE3),卡那抗性平板 (终浓度50 mg/L) 培养,提取质粒。通过PCR鉴定和测序验证插入的序列及方向是否正确,构建成功的重组质粒命名为pET28a-crtB。将crtB基因缺失的质粒 pAC-LYC△(crtB) 与重组质粒pET28a-crtB共转化大肠杆菌BL21(DE3),用Kan和Cm双抗平板 (终浓度50 mg/L) 筛选,阳性克隆子的颜色鉴别实验同环化酶活性检测,同时分别以含有质粒 pAC-LYC△(crtB) 和 pET28a-crtB的BL21(DE3) 菌株为阴性对照。载体构建和基因互补实验的技术路线如图1所示。

图1 八氢番茄红素合成酶活性体外检测载体的构建和基因互补实验的技术路线Fig. 1 Construction of phytoene synthase activity detection vector and gene complementary.
1.2.5 八氢番茄红素合成酶活性的检测
提取质粒pAC-LYC△(crtB),转化含有表达载体pET28a-carRA的大肠杆菌BL21(DE3) 感受态细胞,Kan和 Cm双抗筛选转化子,进一步的颜色互补实验同环化酶活性检测。
1.2.6 番茄红素含量测定
将恒重后的菌体研碎,称取0.5 g,加入少量丙酮∶石油醚 (1∶1) 混合液,在研钵中研磨萃取至提取液完全无色,将萃取液过滤定容至10 mL容量瓶,高效液相色谱法 (HPLC) 测定。色谱仪为watersl525高效液相色谱仪、UV-VLS Detee-tor2487双通道紫外检测器;分离柱为Lichrospher-5-Cu, 5 μm,250 mm×4.6 mm;流动相为甲醇∶乙腈∶二氯甲烷 (7∶7∶2,V/V/V);检测波长472 nm,柱温35 ℃,流速l mL/min;进样量10 μL。
2 结果与分析
2.1 carRA基因的克隆及测序
经过2次PCR扩增,得到了三孢布拉霉番茄红素环化酶基因的2个外显子片段。从图2可看出泳道1大小为400 bp左右,和第一外显子大小一致;泳道2大小为1 400 bp左右,和第二外显子大小一致,由此可初步确定扩增到了两个外显子片段。经重叠延伸PCR后,泳道3、4是拼接产物的检测,大小为1 800 bp左右处有扩增条带,和番茄红素环化酶cDNA大小基本一致,可以初步确定克隆出番茄红素环化酶cDNA片段。
将拼接产物胶回收后连接至pMD18-T载体,进行测序,结果表明克隆的基因和该序列完全一致,同源性达 100%。表明克隆得到的三孢布拉霉番茄红素环化酶cDNA序列完全正确。
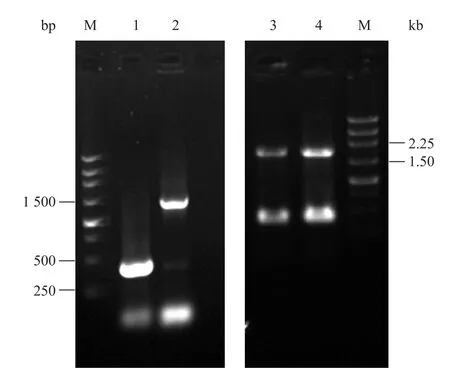
图2 重叠延伸PCR扩增carRA基因Fig. 2 PCR amplification of two exons of carRA gene. 1: the first exon of carRA gene; 2: the second exon of carRA gene; 3,4: splicing results of two exons; M: DNA marker.
2.2 表达载体pET28a-carRA的鉴定
将番茄红素环化酶基因的cDNA序列导入原核表达载体 pET28a,构建原核表达质粒pET28a-carRA,经 PCR扩增初步检测 (图 3) 和测序验证,表明质粒中carRA序列为正向插入多克隆位点,表明原核表达载体pET28a-carRA构建成功。
2.3 八氢番茄红素合成酶活性检测载体pAC-LYC△(crtB) 的鉴定
扩增cm基因中NcoⅠ酶切位点下游的序列,与质粒 pAC-LYC NcoⅠ完全酶切后的大片段相连,通过 Cm抗性筛选及 PCR鉴定 (图 4),表明pAC-LYC△(crtB) 构建正确。

图3 表达载体pET28a-carRA的PCR鉴定Fig. 3 Identification of pET28a-carRA by PCR. 1: PCR products of pET28a-carRA; M: DNA marker.

图4 cm’序列的PCR扩增Fig. 4 PCR products of cm’. 1,2: PCR products of pAC-LYC; 3,4: PCR products of pAC-LYC△(crtB); M: 250 bp ladder.
通过基因互补实验进一步验证 pAC-LYC△(crtB) 载体中CrtB酶活性丧失,而crtE和crtI还保留相应功能。自质粒pAC-LYC中扩增得到crtB基因的编码区 (图5),正向插入pET28a的多克隆位点,PCR反应结果 (图5) 及测序结果表明 crtB基因的表达载体 pET28a-crtB构建正确。pET28a-crtB和 pAC-LYC△(crtB) 共转化大肠杆菌 BL21感受态细胞,37 ℃恒温培养12~24 h后转入室温暗处,1 d后菌体开始变为橘红色,2 d后颜色进一步加深。而阴性对照始终为大肠杆菌的本色。

图5 ctrB 基因的PCR扩增Fig. 5 PCR products of crtB. 1,2: PCR products of pAC-LYC; 3,4: PCR products of pET28a-crtB. M: 250 bp ladder.

图6 HPLC检测质粒pAC-LYC在大肠杆菌BL21中的表达Fig. 6 HPLC analysis of pAC-LYC expressed in E. coli BL21.
2.4 三孢布拉霉carRA基因番茄红素环化酶和八氢番茄红素合成酶活性的验证
将表达载体 pET28a-carRA转化到带有质粒pAC-LYC的大肠杆菌 BL21(DE3) 感受态细胞中,菌体颜色由粉红色转变为黄色。通过这个酶活试验,表明carRA基因的表达产物能够将工程菌中积累的番茄红素 (粉红色) 转化成 β-胡萝卜素 (黄色),初步证明了CarRA蛋白具有番茄红素环化酶的功能与活性。
将表达载体 pET28a-carRA转化到带有质粒pAC-LYC△(crtB) 的大肠杆菌 BL21(DE3) 感受态细胞中,菌体颜色由大肠杆菌本色转变为黄色。通过这个颜色互补试验,表明carRA基因的表达产物能够合成番茄红素并进一步转化成 β-胡萝卜素 (黄色),初步证明了CarRA蛋白亦具有八氢番茄红素合成酶功能与活性。
通过HPLC分析可定性和定量地确证筛选模型中 CarRA蛋白的功能活性。如图 6所示,crtE/crtI/crtB基因簇正确的顺序作用将使菌体积累番茄红素;当环化酶行使功能时菌体积累β-胡萝卜素 (图7)。

图7 HPLC检测质粒pAC-LYC和pET28a-carRA,或pAC-LYC△ (crtB) 和 pET28a-carRA在大肠杆菌BL21中的共表达Fig. 7 HPLC analysis of pAC-LYC and pET28a-carRA or pAC-LYC△(crtB) and pET28a-carRA co-expressed in E. coli BL21.
3 讨论
在多数情况下扩增真核生物的目的编码基因都采取RT-PCR的策略,而提取RNA的过程较烦琐且需要时刻防止 RNA酶的污染。相比较而言,DNA的提取及其 PCR扩增则容易得多。采用重叠延伸PCR的方式,能快速获得目的基因,不仅克服了RT-PCR中必须依赖mRNA的问题,而且有很高的效率[8]。
从carRA基因的扩增可以看出,合理设计的引物可保证第1个外显子和第2个外显子的准确性,使得融合位点正确拼接;相连引物间的重叠区域达到了26个碱基,亦避免富含AT的序列,在片段合成过程中,防止了错配发生。
重叠延伸PCR包括2个阶段,第1个阶段分别扩增出2个外显子,第2个阶段以上个阶段的2个产物为模板扩增出完整的 DNA序列,2个产物的大小不同,很容易导致模板量有较大的差异,在扩增时候需要考虑引物和模板的比例关系。一般需要使模板的摩尔数相同,并进行适当的稀释,这样才能有效保证扩增到目标片段。
质粒 pAC-LYC自构建以来,对多种来源的环化酶如蓝细菌[7]、植物[9]、藻类[10]等,通过菌体颜色变化,即可简单直观地对蛋白的环化酶活性进行鉴定。本研究首次对三孢布拉霉来源的环化酶功能活性采用颜色互补实验进行初步筛查,同时亦改造了 pAC-LYC质粒,使其仅具有细菌来源的类胡萝卜素代谢途径中的 2个基因 crtE/crtI,即质粒pAC-LYC△(crtB)。当重组蛋白具有八氢番茄红素合成酶活性时,在大肠杆菌中能积累番茄红素,菌体呈现粉红色,据此可鉴定蛋白的八氢番茄红素合成酶功能活性。此外,pAC-LYC△(crtB) 也可同时鉴定八氢番茄红素合成酶和番茄红素环化酶的功能活性,即菌体呈现黄色。
三孢布拉霉是目前发酵法生产番茄红素的主要菌种,但需要添加阻断剂抑制番茄红素环化酶活性从而实现番茄红素的积累。阻断剂的添加不仅增加了生产工艺流程,亦会对后续的提取质量产生影响,因此通过基因工程的手段获得番茄红素环化酶活性缺失的工程菌是符合生产需求的。
卷枝毛霉Mucor circinelloides中的CarRP蛋白亦为双功能蛋白,与三孢布拉霉CarRA蛋白为同功酶,Velayos等[11]的研究表明,CarRP蛋白 N端某些氨基酸的突变会积累番茄红素,说明番茄红素环化酶活性丧失而保留有八氢番茄红素合成酶活性。同样的现象在红法夫酵母 Xanthophyllomyces dendrorhous中亦有发现[12]。番茄红素环化酶由carRA基因编码,但CarRA蛋白为双功能蛋白,又具有八氢番茄红素合成酶活性,只有通过定点突变才可能缺失CarRA蛋白的番茄红素环化酶活性,而不影响八氢番茄红素合成酶的正常功能。
本研究确立的酶活检测模型将为此提供简便、可靠的筛选方法:利用质粒pAC-LYC检测番茄红素环化酶活性是否改变;发生改变的再用质粒pAC-LYC△(crtB) 检测八氢番茄红素合成酶活性的变化,最后通过HPLC进一步确证。
REFERENCES
[1] Hadley CW, Clinton SK, Schwartz SJ. The consumption of processed tomato products enhances plasma lycopene concentration in association with a reduced lipoprotein sensitivity to oxidative damage. J Nutr, 2003, 133(3): 727−732.
[2] Yilmaz S, Atessahin A, Sahna E, et al. Protective effect of lycopene on adriamycin induced cardiotoxicity and nephrotoxicity. Toxicology, 2006, 218(2/3): 164−171.
[3] Blum A, Monir M, Wirsansky I, et al. The beneficial effects of tomatoes. Eur Intem Med, 2005, 16(6): 402−444.
[4] Mein JR, Lian F, Wang XD. Biological activity of lycopene metabolites: implications for cancer prevention. Nutr Rev, 2008, 66(12): 667−83.
[5] Omoni A, Aluko RE. The anti-carcinogenic and antiatherogenic effects of lycopene: a review. Trends Food Sci Technol, 2005, 16(8): 344−350.
[6] Rodríguez-Sáiz M, Paz B, de la Fuente JL, et al. Blakeslea trispora genes for carotene biosynthesis. Appl Environ Microbiol, 2004, 70(9): 5589−5594.
[7] Francis XC Jr, Sun Z, Chamovitz D. Molecular structure and enzymatic function of lycopene cyclase from the cyanobacterium Synechococcus sp. strain PCC7942. Plant Cell, 1994, 6(8): 1107−1121.
[8] Heckman KL, Pease LR. Gene splicing and mutangenesis by PCR-driven overlap extension. Nature, 2007, 2(4): 924−932.
[9] Devitt LC, Fanning K, Dietzgen RG, et al. Isolation and functional characterization of a lycopene β-cyclase gene that controls fruit colour of papaya (Carica papaya L.). J Exp Bot, 2010, 61(1): 33−39.
[10] Li T, Shi CL, Gan ZB, et al. Cloning and analysis of the gene encoding lycopene epsilon cyclase in Chlorella protothecoides CS-41. Acta Microbiol Sin, 2009, 49(9): 1180−1189.李婷, 施春雷, 淦志兵, 等. 原壳小球藻番茄红素 ε环化酶基因的克隆和分析. 微生物学报, 2009, 49(9): 1180−1189.
[11] Velayos A, Eslava AP, Iturriaga EA. A bifunctional enzyme with lycopene cyclase and phytoene synthase activities is encoded by the carRP gene of Mucor circinelloides. Eur J Biochem, 2000, 267(17): 5509−5519.
[12] Verdoes JC, Krubasik P, Sandmann G, et al. Isolation and functional characterisation of a novel type of carotenoid biosynthetic gene from Xanthophyllomyces dendrorhous. Mol Gen Genet, 1999, 262(3): 453−461.
