影响无菌苗体系建立因素的研究进展
2011-02-01陈丽闽毛碧增
陈丽闽,毛碧增
(浙江大学 生物技术研究所,浙江 杭州 310029)
影响无菌苗体系建立因素的研究进展
陈丽闽,毛碧增
(浙江大学 生物技术研究所,浙江 杭州 310029)
综述无菌苗体系建立过程中外植体选择、外植体消毒、内生菌污染控制等关键因素的研究进展,并对存在问题进行探讨。
外植体;消毒剂;内生菌
1902年德国植物学家 Haberlandt首次提出的植物细胞全能性理论是植物组织培养的理论基础[1],直到20世纪60年代,Haberlandt的预言才逐步实现,被誉为“植物组织培养之父”。植物组织培养经历了理论创建与实践初探、技术发展与深化、产业化生产等阶段,从20世纪60年代至今,各种植物快繁技术得以广泛应用,使植物组织培养技术进入“工厂化”时代,全球涌现一大批种子种苗公司,如荷兰的 VDE Flowerbulbs,智利南方球茎公司,美国维生种苗公司等。美国Wyford国际公司,印度American Hybird Seeds种子公司等每年的产量达到数千万株,组培成功的植物种类多达1 500种,产业化、商品化生产的有几百种。植物次生代谢物的开发,以及20世纪90年代转基因技术的蓬勃发展,赋予了组织培养新的发展前景。
无菌苗的建立是植物组织培养的首要关键环节,是整个组织培养的起始点,外植体污染以及褐化是该环节的主要问题,决定着整个实验的成败。为此,我们对影响无菌苗体系建立的几个关键因素研究作一概述。
1 外植体的种类
外植体 (explant)指植物组织培养中作为离体培养的材料。
植物细胞全能性是指植物体的每一个细胞都含有能发育成完整个体的全套基因,这些基因在适宜的外界条件下将按照某种特定的程序先后表达,最终分化形成一个完整植株[2],植物的器官,组织、胚胎、细胞以及原生质体等都是常用的外植体。
幼胚是最早作为外植体的材料,早在1904年Hanning通过培养萝卜和辣根未成熟的幼胚获得了小苗;1926年Harlan大麦幼胚培养成功。随着组织培养研究的深入以及被研究物种的增多,外植体的种类逐渐丰富,主要分为5大类,即胚胎培养(成熟或未成熟胚)、器官培养 (根、茎、叶、花、果)、组织培养 (顶端分生组织、侧生分生组织和居间分生组织)、细胞培养 (单个的游离细胞)、原生质体培养。
组织培养已成功的常见植物:胚胎培养有水稻、小麦、大麦、玉米、豌豆、高粱、棉、红麻、剑麻、烟草、甜菜、向日葵、棕榈、莴苣、葱、苹果、梨、核果、龙眼、山楂、甜瓜、猕猴桃、松树、百合、兰花[3];器官培养中根培养有胡萝卜、掌叶大黄[4]、长春花[5]、高山红景天[6]、光果甘草[7]、褐脉少花龙葵[8]、烟草[9],茎培养有马铃薯、甘薯、木薯、烟草、甘蔗、橡胶树、油菜、棕榈、石刁柏、苹果、梨、核果、山楂、葡萄、草莓、猕猴桃、香蕉、番木瓜、针叶松、海岸红杉、杨树、桉树、泡桐、百合、水仙、菊花、杜鹃、兰花[3],叶培养有豌豆、甘薯、高粱、烟草、番茄、茄子、芹菜、百合、兰花[3],花培养有水稻、小麦、大麦、玉米、马铃薯、苎麻、红麻、亚麻、烟草、茶树、橡胶树、花生、大豆、芸苔、葡萄、番茄、茄子、石刁柏、柑橘、苹果、荔枝、龙眼、草莓、甜瓜、西瓜、杨树、菊花[3],芽培养有苎麻、西瓜[3]; 分生组织培养有葱、甘薯[10]、骏枣[11]、球根花卉 (唐菖蒲、水仙、郁金香等)[3];原生质体培养有马铃薯、棉、油菜、大豆、芸苔、番茄、茄子、莴苣、胡萝卜、柑橘、小麦、大麦[3]。
不同品种、生长年龄和生理状态以及同一植株的不同部位、器官和组织,植物细胞的分化再生能力具有差异。1934年White以番茄根尖为材料成功获得第1个可以正常生长的无性系,从而使非胚器官培养首次获得成功。随着研究深入,研究者们发现番茄的叶片更适宜作为组织培养的材料,如目前番茄的转基因研究常采用叶盘法[12]。
此外外植体的选择既可以考虑实验的可行性,也可以结合研究目的,如脱病毒。众所周知,病毒在植物体内的分布是不均匀的。在受侵染的植株中,顶端分生组织一般说或者是无病毒的,或者是只携带有浓度很低的病毒[13],故可选用茎尖分生组织作为外植体。不少文献已有相关报道,1952年,法国人Morel将带病毒的大丽花进行茎尖离体培养,获得去病毒植株;1960年,Morel采用相同方法获得了兰属 (Cymbidium)植物的再生植株。这一技术很快被欧美东亚许多国家的花卉生产企业所应用,实现了兰花工业化生产,形成了特有的“兰花工业”。1964年印度德里大学的 Guha和Maheshwari在培养南洋金花未成熟花药时发现了由大量胚状体形成的小植株;1967年Bourgin等从烟草花药培养中获得单倍体植株,证实花药发育成单倍体植株的可能,此后花药培养成为获得单倍体的一条最佳途径,成功应用于水稻、小麦等作物育种,并在改变植物遗传性的应用研究和基础研究中有着广泛的应用前景[3]。
2 消毒方法以及消毒剂种类
2.1 消毒剂种类以及工作原理
对外植体表面的病原菌进行有效的消毒是无菌苗体系建立的关键环节,消毒剂种类的选择应因外植体的种类而异,目前采用的比较多消毒剂为酒精、升汞、次氯酸钠、溴水、过氧化氢等 (表1)。
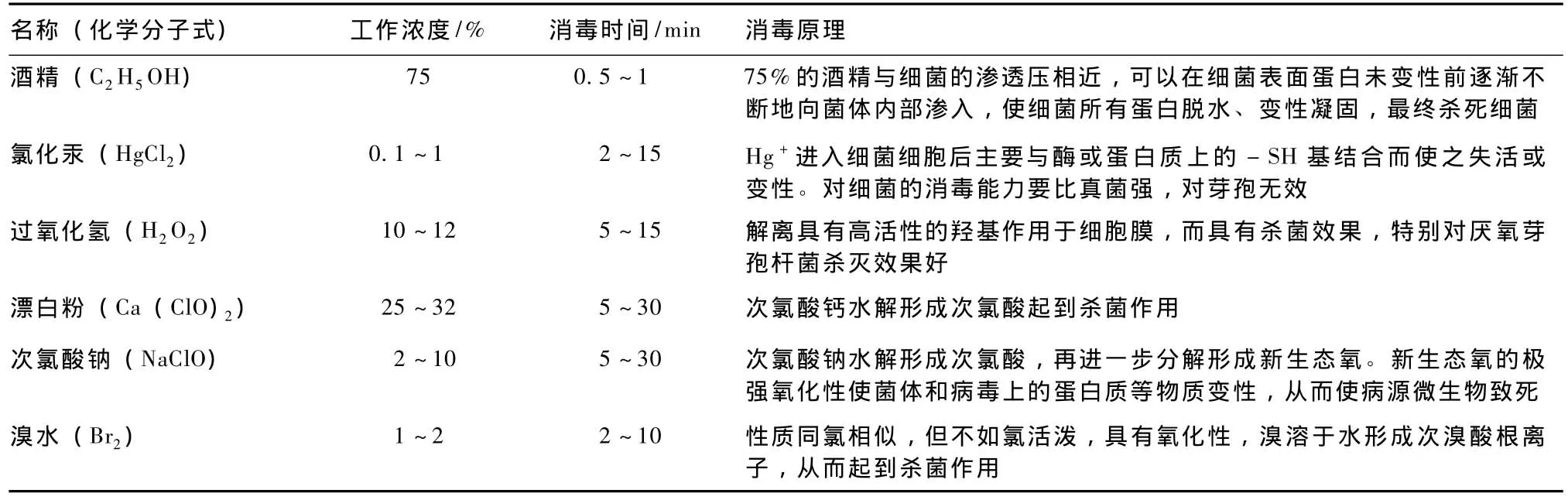
表1 消毒剂的种类及其工作原理
2.2 消毒方法
外植体的消毒方法可以是消毒剂单独使用,也可以是各种消毒剂的组合使用,但是引起组织培养污染的细菌、真菌等各种微生物,不仅存在于植物体表,甚至存在植物体内,常规的消毒一般只对植物的表面进行消毒,二步消毒法或内生菌的消毒可彻底消除组培中出现的各种污染现象。
2.2.1 表面消毒
植物体表、体内均会存在各种微生物,因此,选择一种有效的消毒方式是组织培养实验成败的关键。
种子选用浓硫酸浸泡[14],70% ~75%酒精 +0.1%升汞[15],0%酒精 +10% 双氧水[16],70% 酒精 +10%次氯酸钠[17],70%酒精 +40%次氯酸钠[18]; 茎尖选用 70% 酒精 +10% 次氯酸钠[19-20],75%酒精 +0.1% 升汞[21-22],70% 酒精 +0.1% 升汞[23-24],70% 酒 精 +20% 次 氯 酸 钠 +0.1% 升汞[25]; 根尖适用 70% 酒精 +0.1% 升汞[26],或种子灭菌待长出无菌根后进行组织培养[27-28];花药选用70% ~75%酒精+0.1%升汞[29],70%酒精+15%次氯酸钠[30];叶片选用 70% ~75%酒精 +0.1% 升汞[31-33],0.1% 升汞[34]。
70%~75%酒精与0.1%升汞的组合最常用,但要依不同的外植体适当调整消毒时间和消毒剂的浓度;次氯酸钠也较常用,但因其具有漂白作用,不用于叶片的消毒。对叶片的消毒可以使用10%的巴氏消毒液;此外,对于带有绒毛的外植体,为使灭菌剂湿润整个组织,还需在消毒液中加入几滴表面活性剂吐温20或吐温80。在消毒前,流水冲洗外植体数分钟。消毒后要用无菌水将外植体冲洗干净,以防残液对植物细胞的伤害。
酒精消毒时要选择适宜浓度。因高浓度酒精,会使细菌蛋白迅速脱水,造成细菌表面蛋白质首先变性凝固,形成了一层坚固的包膜,酒精反而不能很好地渗入细菌内部,以致影响其杀菌能力;酒精浓度若低于75%,会因渗透性降低而影响杀菌能力。各组培工作者的实践经验表明,酒精的工作浓度范围为70%~75%,综合考虑细菌自身的渗透势,为此我们建议最佳工作浓度为75%。
使用氯化汞消毒,要充分把握好消毒浓度和消毒时间。因为微量的重金属离子能在细胞内不断累积并最终对生物发生毒害作用,或引起生物体内遗传物质的改变。
2.2.2 内生菌消毒
控制内生菌污染是影响组培技术成功的又一关键因素。关于植物内生菌(endophyte)的概念范畴有着广泛的争议,1991年 Petrini在 Carroll和Clay提出的概念基础上,将内生菌定义为:内生菌包括那些在其生活史中的某一段时期生活在植物组织内,对植物组织没有引起明显病害症状的菌,该定义还包括了那些在其生活史中的某一阶段营表面生的腐生菌,对宿主暂时没有伤害的潜伏性病原菌和菌根菌[35]。内生菌可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接产生扩增出微生物DNA的方法来证明其内生,被感染的寄主 (至少是暂时)不表现出来外在病症[36]。
国内在内生菌的开发应用中研究得较深入,如在制药、植物保护、污染物降解方面,进行了菌种的分离鉴定与筛选[37]。而国外学者在内生菌污染方面的研究重点在于阐明引起其污染的原因及控制策略 (表2)。

表2 引起组织培养污染的内生菌及控制
由表2可知,通过抗生素、生物活性物质、对组培苗生长环境的控制等措施可以有效控制内生菌引起的污染问题。
3 小结
无菌苗体系的建立需要综合考虑各种因素作用。依细胞的全能性,根据实验目的及具体的植物种类,选择合适的外植体;同时,选取的外植体、各种消毒剂自身的性质共同决定了采用何种消毒剂及方法;关于内生菌,黄小荣等[51]则认为:植物组培中细菌污染的原因是休眠细菌芽孢萌发的结果。
在内生菌消毒中,由于植物体中的内生细菌潜伏得较深,表面消毒无法将其消除。这种污染在外植体的初期培养中 (前几代的继代培养),不易被肉眼察觉,随着继代培养次数的增加,菌量逐渐累积,才在培养基上显现出来[52]。植物体内某些内生菌是与植物互利共生的,休眠的内生菌也会因培养基条件的改变而被激活[42,53]。综上所述,要建立一个无菌苗体系,要充分考虑外植体、消毒剂、培养基等各种因素,而不能将各种因素孤立起来。
[1] Rout G R,MohapatraA,Jain S M.Tissuecultureof ornamental pot plant:A critical review on present scenario and future prospects[J].Biotechnol Adv,2006,24:531-560.
[2] 王蒂.植物组织培养 [M].北京:中国农业出版社,2000.
[3] 颜昌敬.植物组织培养手册 [M].上海:上海科学技术出版社,1990.
[4] 杨世海,刘晓峰,果德安,等.不同碳源对掌叶大黄毛状根生物量和蒽醌产量的影响 [J].中草药,2005,36(37):1075-1078.
[5] 孙敏,曾建军.长春花毛状根培养及抗癌生物碱产生的研究 [J].中国中药杂志,2005,30(10):741-743.
[6] 徐洪伟,周晓馥.高山红景天毛状根培养的研究 [J].中国生态农业学报,2003,11(3):45-47.
[7] 王裔惟,丁家宜,周倩耘,等.光果甘草毛状根培养过程中对活性氧清除能力和总黄酮含量的变化 [J].植物资源与环境学报,2004,13(2):6-9.
[8] 吴晓凤,施和平,Tsang P K E.褐脉少花龙葵毛状根的诱导、培养及其澳洲茄胺的产生 [J].分子细胞生物学报,2008,41(3):184-191.
[9] 王英娟,步怀宇,李多伟,等.烟草毛状根诱导及其茄尼醇含量初探 [J].植物学通报,2006,23(34):334-340.
[10] 张雅琼,郭华春.甘薯茎尖分生组织培养的研究进展[J].农业生物技术,2005,21(31):74-76.
[11] 朱文勇,杜学梅,郭黄萍,等.骏枣茎尖培养脱除枣疯病MLO [J].园艺学报,1996,23(2):197-198.
[12] 田吉林,杨玉爱,何玉科.转HAL1基因番茄的耐盐性[J].植物生理与分子生物学学报,2003,29(5):409-414.
[13] 李浚明,朱登云.植物组织培养教程 [M].北京:中国农业大学出版社,2000:224-225.
[14] 邹利娟,苏智先,胡进耀,等.美洲商陆组培快速繁殖[J].中药材,2008,31(9):129-1301.
[15] 漆燕玲,栗孟飞,孙萍,等.桃儿七成熟胚的离体培养研究 [J].生物学杂志,2008,25(4):39-41.
[16] 许亚楠,佘建明,张保龙,等.陆地棉子叶离体培养诱导不定芽植株再生 [J].江苏农业学报,2008,24(5):595-599.
[17] 邢德峰,李新玲,王全伟,等.影响大白菜高效离体培养再生的因素 [J].植物生理学通讯,2003,39(5):420-424.
[18] 余波澜,张利明,孙勇如,等.茄子子叶和下胚轴的组织培养和植株再生 [J].植物生理学通讯,2003,39(4):317-320.
[19] 蒋刚强,王瑜,兰海燕,等.水浮莲无菌苗的获得及其培养体系的优化 [J].水生生物学报,2008,32(5):615-619.
[20] 吴林森,冯福娟,张宇,等.西兰花离体快繁外植体消毒技术初探 [J].农业与技术,2006,26(3):96-98.
[21] Zhou J,Wang B C,Zhu L Q .Conditioned culture for protoplasts isolated from chrysanthemum:An efficient approach[J].Colloids Surf B Biointerfaces,2005,45:113-119.
[22] 顾沛雯.葡萄卷叶病毒的脱毒技术研究 [J].西北农林科技大学学报,2008,36(5):85-91.
[23] 段新玲,任东岁,段黄金.毛刺槐的组织培养和植株再生[J].植物生理学通讯,2000,36(6):534-535.
[24] 周玉珍,张雨青.金叶风箱果初代离体培养中影响外植体褐化的因素 [J].植物生理学通讯,2001,37(2):122-123.
[25] 唐东芹,黄丹枫,唐克轩,等.东方百合鳞片的组织培养[J].植物生理学通讯,2003,39(5):450-452.
[26] 王桂英.韭菜根尖培养及植株再生 [J].北方园艺,2007(12):199-200.
[27] 鲁守平,孙群,杨艳春,等.乌拉尔甘草离体根尖培养方法的建立 [J].农业生物技术科学,2008,24(2):93-97.
[28] 祝水金,季道藩.棉花离体根尖培养体系的建立 [J].棉花学报,2000,12(6):288-293.
[29] 朱允华,刘清,吴朝林,等.菜薹花药培养诱导胚状体的研究 [J].生物技术通报,2008(2):136-139.
[30] 王玲仙,谢吉容,付坚,等.香花槐花器官的组织培养及植株再生研究 [J].北方园艺,2008(1):191-193.
[31] 胡国富,李凤兰,袁强,等.北青兰 (Dracocephaluma rgunense)叶片组织培养的研究 [J].东北农业大学学报,2004,35(2):195-198.
[32] 张小苹,马双马,那淑芝,等.二色补血草叶片组织培养及无性系的建立 [J].沈阳农业大学学报,1998,29(1):96-97.
[33] 符文英,杜道林,符木均.海南粗框愈伤组织的诱导和培养 [J].植物生理学通讯.2004,40(1):34-36.
[34] 马国华,张静峰,刘念,等.从多花野牡丹和野牡丹花柄直接诱导出芽 [J].植物生理学通讯,2004,40(6):719.
[35] Petrini O.Taxonomy of endophytic fungi in aerial plant issues[G] //Fokkema N J. Microbiology ofthephyllosphere.Cambridge U K:Cam bridge University Press,1986:175-187.
[36] Stone J K,Bacon C W,White J F.An overview of endophytic microbes:endophytism defined[G] //Bacon C,White J F.Microbial endophytes.New York:Marcel Dekker,2000:3-29.
[37] 李强,刘军,周东坡,等.植物内生菌的开发与研究进展[J].生物技术通报,2006(3):33-37.
[38] West T P,Preece J E.Use of acephate,benomyl and alginate encapsulation for eliminating culture mites and fungal contamination fromin vitrocultures of hardy hibiscus[J].In Vitro Cell Dev Biol-Plant,2006,42:301 -304.
[39] Abdi G,Salehi H,Khosh-Khui M.Nano silver:a novel nanomaterial for removal of bacterial contaminants in valerian(Valeriana officinalisL.)tissue culture [J].Acta Physiol Plant,2008,30:709 -714.
[40] Marino G,Gaggia F,Saiano F,et al.Elimination ofin vitrobacterial contaminants in shoot cultures of‘MRS 2/5’plum hybrid by the use ofMelia azedarachextracts[J].Eur J Plant Pathol,2009,123:195 -205.
[41] Nagy JK, SuleS, SampaioJP. Appletissueculture contamination by rhodotorula spp:identification and prevention[J].In Vitro Cell Dev Biol-Plant,2005,41:520 -524.
[42] Cassells A C,Tahmatsidou V.The influence of local plant growth conditions on non-fastidious bacterial contamination of meristem-tips ofHydrangeaculturedin vitro[J].Plant Cell Tissue Organ Cult,1996,47:15 -26.
[43] Tanprasert P,Reed B M.Determination of minimal bactericidal and effective antibiotic treatment concentrations for baceterial contaminants from micropropagated strawberries[J].In Vitro Cell Dev Biol-Plant,1997,33:227 -230.
[44] Luna C,Collavino M,Mroginski L,et al.Identication and controlofbacterialcontaminants from Ilex dumosa nodal segments culture in a temporal immersion bioreactor system using 16S rDNA analysis [J].Plant Cell Tissue Organ Cult,2008,95:13-19.
[45] Thomas P,Prakash G S.Sanitizing long-term micropropagated grapes from covert and endophytic bacteria and preliminary field testing of plants after 8 yearsin vitro[J].In Vitro Cell Dev Biol-Plant,2004,40:603 -607.
[46] Eudes F,Comeau A,Collin J,et al.Use of hen lysozyme for protection against bacterial contamination ofin vitroembryo cultures[J].Plant Cell Rep,1995,15:30-33.
[47] 翟建中,顾梅俏.长春蔓组培生产中污染的防除 [J].森林病虫通讯,1999(4):30-32.
[48] Barrett C,Cassells A C.An evaluation of antibiotics for the elimination ofXanthomonas campestrispv.pelargonii(Brown)fromPelargoniumX.domesticumcv.‘Grand Slam’explantsin vitro[J].Plant Cell Tissue Organ Cult,1994,36(2):169-175.
[49] 何云芳,郭达初.百合及半夏试管繁殖中的污染防治初报[J].浙江农业大学学报,1995,21(3):322-324.
[50] Kneifel W,Leonhardt W.Testing of different antibiotics against Gram-positive and Gram-negative bacteria isolated from plant tissue culture [J].Plant Cell Tissue Organ Cult,1992,29:139-144.
[51] 黄小荣,杨开太.香水白掌的组织培养 [J].广西林业科学,2001,30(1):39-40.
[52] Kritzinger E M,Vuuren R J,Woodward B.Elimination of external and internal contaminants in rhizomes ofZantedeschia aethiopicawith commercial fungicides and antibiotics[J].Plant Cell Tissue Organ Cult,1998,52:1-2.
[53] Panicker B, Thomas P, Janakiram T,et al. Influence of cytokinin levels oninvitropropagation ofshy suckering chrysanthemum“Arka Swarna”and activation of endophytic bacteria[J].In Vitro Cell Dev Biol-Plant,2007,43:614-622.
S 339.4
A
0528-9017(2011)03-0483-05
文献著录格式:陈丽闽,毛碧增.影响无菌苗体系建立因素的研究进展 [J].浙江农业科学,2011(3):483-487.
2010-12-09
浙江省重大科技攻关项目 (2005C13016)
陈丽闽 (1986-),女,浙江金华人,硕士研究生,研究方向为植物组织培养以及转基因分子育种。E-mail:liminchen@zju.edu.cn。
注:毛碧增系通信作者,E-mail:maobz@zju.edu.cn。
(责任编辑:吴益伟)
