低能体外冲击波对大鼠成骨细胞增殖分化的影响
2011-01-23刘长剑罗宗键
王 李,刘长剑,罗宗键
(1.大连市友谊医院 医学影像科,辽宁 大连 116001;2.大连医科大学 附属第一医院 骨科,辽宁 大连 116011;3.长春中医药大学附属医院 骨科,吉林 长春 130021)
现已知多种理化因素能参与影响体内、外成骨过程的各个环节。各种因素在此过程中并非只是单独调节骨形成或骨吸收,而是对骨吸收和骨形成在不同的组织。不同的时间段起不同的作用,经综合、交叉作用后共同完成对成骨的调节。体外冲击波(extracorporeal shock wave,ESW)对成骨细胞的作用引人注目。ESW可以一种机械能的形式进入骨折部位,骨组织对高频率、低强度的机械刺激敏感。而低能量的ESW正好可持续给予骨折部位的骨组织这种应力刺激。大量研究证明,频率、能量强度适合的ESW可促进骨愈合[1,2]。成骨细胞的体内环境中,由于液体流动、活体运动等因素,也是处于持续的应力刺激之下。有文献报道,PKC和p38MAPK蛋白激酶家族成员可能与成骨细胞增殖、成骨功能密切相关[3,4]。所以,本研究观察ESW这一应力刺激因素对体外培养鼠成骨细胞(ROB)增殖分化的影响,并进一步探讨了ESW作用的细胞内信号传导过程中PKC和p38MAPK的可能作用。
1 材料和方法
1.1 实验材料
动物和试剂:出生24 h内Wistar大鼠乳鼠(大连医科大学实验动物中心,雌雄不拘,清洁级)72只,每次取6只颅盖骨成骨细胞分瓶培养、扩增至第3代备用。PI染液、RNA酶(北京鼎国生物技术公司),ALP活性检测试剂盒(南京建成公司),兔抗鼠I型胶原免疫组化试剂盒(武汉博士德公司),高糖DMEM培养基(美国Hyclone公司),胎牛血清(杭州四季青公司),H7 (美国sigma生物),SB203580(美国sigma生物),细胞全蛋白提取试剂盒(凯基生物),蛋白定量试剂盒(凯基生物),磷酸化P38 MAPK一抗(美国Santa Cruze生物),总P38 MAPK一抗(美国Santa Cruze生物)ECL放射显影试剂盒(美国Amershan生物),其它试剂均为国产分析纯。
主要仪器和设备:体外冲击波碎石机(MODEL KDE-2001A,北京中科建安公司),流式细胞仪(B.D.FACS Aria,美国B.D.公司),恒温二氧化碳培养箱(Series Ⅱ Water Jacketed CO2 Incubator,美国Thermo Electron公司),超净工作台(Forma Class Ⅱ A2 Biological Safety Cabinet,美国Thermo Electron公司),立式灭菌器(LMQ.R-4060,山东新华医疗仪器公司)Western Blot 放射显影曝光暗室及洗片机,电泳仪(EC120 Mini Vertical Gel System,美国Thermo Electron)。
1.2 实验方法
细胞培养,取出生24 h内Wistar大鼠乳鼠,浸泡于75%酒精中5~10 min,取出颅骨,冲洗后用0.1%I型胶原酶消化20 min,吸弃上清,用眼科手术剪将骨块剪碎,再用0.1%I型胶原酶消化30 min,终止消化,再次加入0.1%I型胶原酶消化30 min,重复消化共3次,将获得的细胞悬浮于含10%胎牛血清的DMEM中,接种培养,细胞长致融合状态时消化传代(1∶2),详见作者报道的方法[5]。
1.3 观察ESW对体外培养ROB的影响
将MODEL KDE-2001 体外液波碎石机调整形成能量密度为0.18 mJ/mm2的低能冲击波。取体外培养第3代ROB,ESW冲击之前将ROB培养于不含血清的培养基中24 h,使培养的细胞同步化;将目标细胞装入细胞冻干瓶中然后通过C型臂X 射线透视装置将冻干瓶定位在半椭圆形的第2焦点处。用该能量的冲击波分别作用含有ROB细胞悬液(5×105/mL)的细胞冻存管0、30、60、90、120、150次,每组设3个样本。
1.3.1 ROB细胞增殖观察
(1)台盼兰染色法活细胞计数,取体外培养第3代成骨细胞,加入台盼兰染液后滴入细胞计数池,显微镜下计数活细胞数目。
(2)MTT(噻唑兰)法检测细胞增殖:取第3代成骨细胞,分组刺激后,按照常规MTT法将细胞培养于含10%去类固醇FBS的高糖DMEM中48 h;然后将培养液弃去,每孔加入MTT应用液20 μL,继续培养4 h,每孔加入150 μL二甲基亚砜(DMSO)孵育20 min。调整酶标仪波长为490nm,测定每孔吸光度。
(3)流式细胞术(FCM)进行DNA倍体分析检测ROB增殖指数:取第3代成骨细胞,分组刺激后,培养于含10%去类固醇FBS的高糖DMEM中24 h。收集细胞,离心弃培养液,70%乙醇固定,置4℃冰箱过夜。检测前加RNA酶溶解RNA,加PI染液,避光孵育30 min,按试剂盒说明上机检测。用Modfit分析软件分析图像,得出处于各个细胞周期的细胞比例,计算ROB细胞增殖指数(PI指数):PI=S%+G2%
1.3.2 ROB成骨分化观察
(1)酶标仪检测ROB细胞内ALP活性:取第3代成骨细胞,分组刺激,将细胞悬浮于含10%去类固醇FBS的高糖DMEM中,调整细胞浓度为2×104/ mL,加入96孔板,培养于37℃、5%CO2和饱和湿度的恒温培养箱内72 h。按试剂盒操作步骤处理96孔板中的细胞,在405 nm波长下测定各孔的吸光度。
按如下公式计算样品中碱性磷酸酶(ALP)活性:
ALP活性(金氏单位/100 mL)=(测定管吸光度/标准管吸光度)×0.005×(100/0.05)
(2)免疫组化法检测I型胶原表达:取第3代成骨细胞,分组刺激后,将细胞悬浮于含10%去类固醇FBS的高糖DMEM中,调整细胞浓度为2×104/ mL,接种于24孔板中进行细胞爬片4 d;将爬片固定后,按免疫组化剂盒说明步骤操作;显微镜观察并计数阳性细胞百分比。
1.4 探讨ESW作用于成骨细胞的细胞内信号转导机制
取体外培养第3代ROB,ESW冲击之前将ROB培养于不含血清的培养基中24 h,使培养的细胞同步化,收集细胞,分组如下:
对照组:单纯0.18 mJ/mm2ESW冲击120次组;ESW+H7组:刺激前1 h加入PKC抑制剂H7(2×10-5M);ESW+SB203580组:刺激前1 h加入p38MAPK抑制剂SB203580(2×10-5M)。
观察指标:(1)台盼兰染色法活细胞计数;(2) MTT法检测细胞增殖;(3) FCM进行DNA倍体分析检测ROB增殖指数;(4)酶标仪检测ROB细胞内ALP活性;(5) 免疫组化法检测I型胶原表达;(6) Western Blot检测ESW是否磷酸化激活p38MAPK,以及PKC抑制剂H7和p38MAPK抑制剂SB203580对ESW磷酸化激活p38MAPK的影响。
1.5 统计学方法
2 结 果
2.1 ESW对体外培养ROB的影响
2.1.1 ROB细胞增殖观察结果
(1)台盼兰染色法活细胞计数:细胞数量随着0.18 mJ/mm2ESW刺激次数从30~120次之间依次增加。细胞计数在ESW刺激30~150次各组比较差异有显著性意义(P<0.05),阴性对照组(0次)与ESW 30次组之间比较差异无显著性意义(P>0.05),见表1。
(2) MTT法检测细胞增殖:A490值随着0.18 mJ/mm2ESW刺激次数从30~120次之间依次增加。A490值在ESW刺激30~150次各组之间差异有显著性意义(P<0.05),除了ESW 90次和150次刺激组之间差异无显著性意义、阴性对照和ESW30次组之间差异无显著性意义之外,见表1。
(3) FCM进行DNA倍体分析检测ROB增殖指数(PI):PI随着0.18 mJ/mm2ESW刺激次数从30~120次之间依次增加。PI值在ESW刺激30~150次各组之间差异有显著性意义(P<0.05),除了ESW120次和150次刺激组之间差异无显著性意义、阴性对照和ESW30次组之间差异无显著性意义之外,见表1。
2.1.2 ROB成骨分化观察结果
(1)酶标仪检测ROB细胞ALP活性:ALP活性随着0.18 mJ/mm2ESW刺激次数从30~120次之间依次增加。ALP活性在ESW刺激30~150次各组之间差异有显著性意义(P<0.05),除了ESW90次和150次刺激组之间差异无显著性意义、阴性对照和ESW30次组之间差异无显著性意义之外,见表1。
(2)免疫组化法检测I型胶原表达:I型胶原阳性ROB细胞百分比随着0.18 mJ/mm2ESW刺激次数从30~150次之间依次增加。I型胶原阳性ROB细胞百分比在ESW刺激30~150次各组之间差异有显著性意义(P<0.05),除了ESW120次和150次刺激组之间差异无显著性意义、阴性对照和ESW30次组之间差异无显著性意义之外,见表1。

表1 不同冲击次数0.18 mJ/mm2ESW刺激对ROB增殖的影响
1) 与对照组相比,P<0.05;2) 与对照组相比,P<0.01;n=3
2.2 ESW作用于成骨细胞的细胞内信号转导机制的探讨结果
2.2.1 ROB细胞增殖观察结果
观察PKC抑制剂H7和p38MAPK抑制剂SB203580对120次0.18 mJ/mm2ESW刺激促进体外培养ROB细胞增殖作用的影响:
(1)台盼兰染色法活细胞计数:120次ESW刺激组细胞数量最高,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著抑制120次ESW刺激组的细胞数目,其各组细胞数目比较差异有显著性意义(P<0.05),PKC和p38MAPK均参与ESW促进ROB细胞增殖的作用,见表2。
(2) MTT法检测细胞增殖:120次ESW刺激组A490值最高,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著降低120次ESW刺激组的A490值,其各组A490值比较差异有显著性意义(P<0.05),PKC和p38MAPK均参与ESW促进ROB细胞增殖的作用,见表2。
(3) FCM进行DNA倍体分析检测ROB增殖指数,120次ESW刺激组增殖指数PI值最高,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著抑制120次ESW刺激组的PI指数,其各组PI指数比较差异有显著性意义(P<0.05),PKC和p38MAPK均参与ESW促进ROB细胞增殖的作用,见表2。

表2 PKC抑制剂H7和p38MAPK抑制剂SB203580对120次0.18 mJ/mm2ESW刺激促进ROB成骨分化作用的影响
1)与各自相应的无抑制剂H7或SB203580加入组比较,P<0.01;2)与H7加入组比较,P<0.05;n=3
2.2.2 ROB成骨分化观察结果
观察PKC抑制剂H7和p38MAPK抑制剂SB203580对120次0.18 mJ/mm2ESW刺激促进体外培养ROB细胞成骨作用的影响:
(1)酶标仪检测ROB细胞ALP活性:120次ESW刺激组ALP活性最高,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著降低120次ESW刺激组的ALP活性,其各组ALP活性比较差异有显著性意义(P<0.05),PKC和p38MAPK均参与ESW促进ROB细胞成骨的作用,见表2。
(2)免疫组化法检测I型胶原表达:120次ESW刺激组I型胶原表达阳性细胞比率最高,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著降低120次ESW刺激组的I型胶原表达阳性细胞比率,其各组之间比较差异有显著性意义(P<0.05),PKC和p38MAPK均参与ESW促进ROB细胞成骨的作用,见表2。
2.2.3 Western Blot检测结果
Western Blot检测ESW是否磷酸化激活p38MAPK,以及PKC抑制剂H7和p38MAPK抑制剂SB203580对ESW磷酸化激活p38MAPK的影响,来探讨ESW对ROB作用的细胞内信号转导通路:可见120次ESW刺激组磷酸化p38MAPK表达的光密度比最高,其磷酸化激活p38MAPK的能力最强,PKC抑制剂H7和p38MAPK抑制剂SB203580均能显著降低120次ESW刺激的这种作用,其各组之间比较差异有显著性意义(P<0.05),PKC位于ESW促进ROB增殖成骨作用细胞信号通路的上游(图1)。
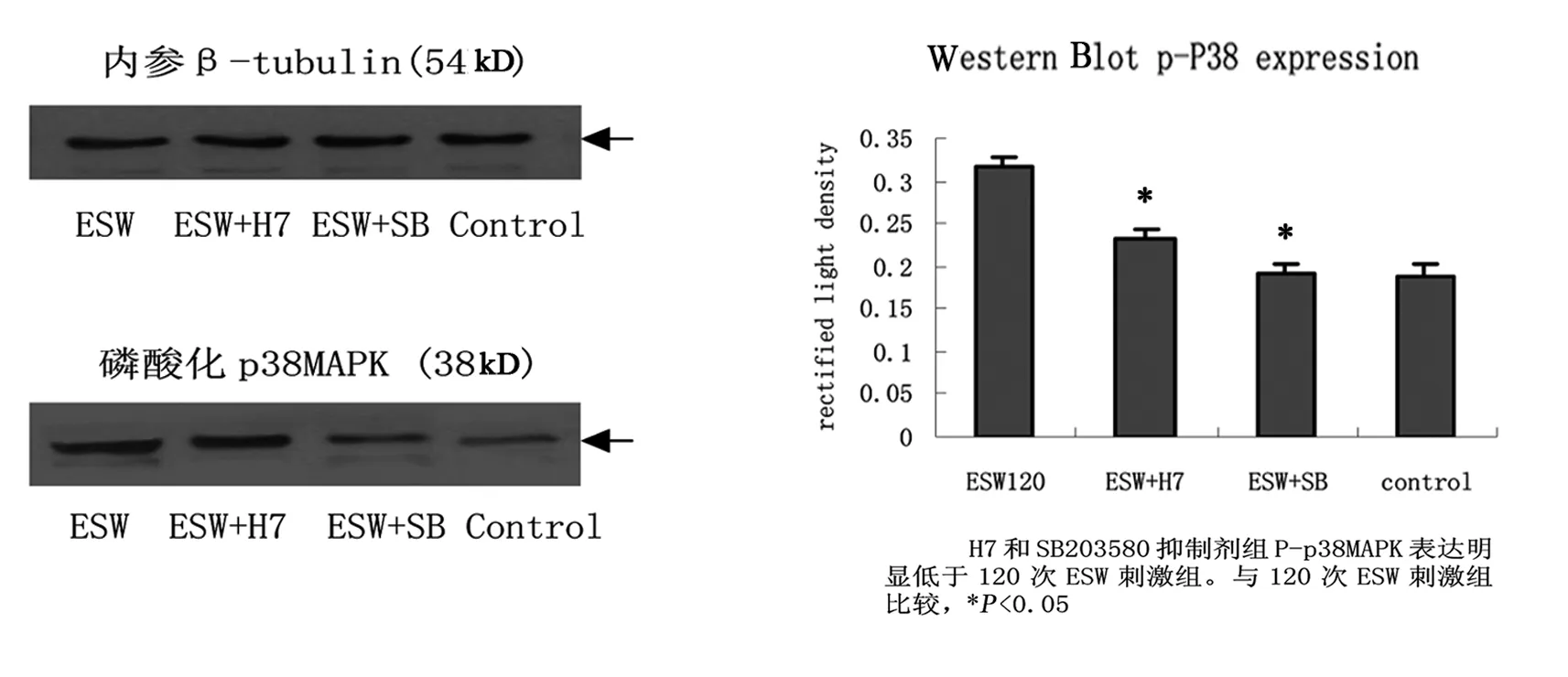
图1 Western Blot检测P-p38MAPK表达
3 讨 论
适当的应力刺激可以促进体内、外成骨。因而,近来在骨组织工程构建方式上提出应力化、持续灌流构建的概念[6-10]。多个关于ESW的研究证实,ESW可以使作用部位的流体力学状态改变并对处于作用范围中的细胞产生流体剪切应力(FSS)和牵拉作用[11,12];成骨细胞和骨细胞一直被认为是主要的应力感受细胞。本实验数据表明0.18 mJ/mm2ESW(60~150次)刺激可显著促进ROB增殖和成骨分化。
在人体环境中,成骨细胞处于持续不断的应力刺激之下,这种作用会对ROB增殖、分化造成什么影响。本研究根据前期实验数据,采用0.18 mJ/mm2ESW(30~150次)刺激共同作用于体外培养的ROB(为尽量排除血液中其他活性成分的干扰,实验过程中采用去类固醇血清),结果发现, 0.18 mJ/mm2ESW(60~150次)刺激各组能明显促进ROB体外增殖和成骨分化。体内骨质的溶解和重塑是处在一个动态
平衡之中,这种动态平衡又依赖于成骨细胞(OB)和破骨细胞(OC)功能之间的平衡[13,14]。本实验结果表明,ESW刺激可以促进成骨细胞的增殖、分化,这也有助于解释为什么体育锻炼可以促进骨质形成;而且,PKC和p38MAPK这两种应力敏感蛋白激酶可能都参与此过程的信号传导,PKC可能作用于p38MAPK的上游。通过上述实验,可得出如下设想:在体内环境中,骨吸收和骨形成保持平衡;如果出现抑制骨形成、促进骨吸收的因素,如长期卧床等情况,这一平衡会向骨质吸收倾斜,出现骨质疏松等表现;如果出现促进骨形成、抑制骨吸收的因素,如体育锻炼等适当的应力刺激,这一平衡会向骨质形成倾斜。虽然适当的应力刺激被观察到可通过PKC和p38MAPK促进体外培养的ROB增殖、成骨分化,但其作用的分子机制远未明了,尚需进一步研究。
本研究结果提示,适当的ESW应力刺激可明显促进体外培养ROB增殖和成骨分化,PKC和p38MAPK可能都参与此过程的细胞内信号转导,PKC可能位于其细胞内信号转导通路的上游。
[1] Yeung-Jen Chen,Yur-Ren Kuo,Kuender D Yang,et al.Activation of extracellular signal-regulated kinase (ERK) and p38 kinase in shock wave-promoted bone formation of segmental defect in rats[J].Bone,2004,34(3):466-477.
[2] FS Wang,KD Yang,YR Kuo,et al.Temporal and spatial expression of bone morphogenetic proteins in extracorporeal shock wave-promoted healing of segmental defect[J].Bone,2003,32(4):387-396.
[3] Ling Qin,Pikkwan Fok,Hongbin Lu,et al.Low intensity pulsed ultrasound increases the matrix hardness of the healing tissues at bone-tendon insertion-a partial patellectomy model in rabbits[J].Clin Biomech,2006,21:387-394.
[4] Fujita T.Parathyroid hormone in the treatment of osteoporosis[J].Biodrugs,2001,15:721-728.
[5] 刘长剑,刘建国,于铁成,等.I型胶原酶阶段消化法体外培养、纯化及鉴定大鼠成骨细胞[J].中国老年学杂志,2007,6(27),525-527.
[6] 刘长剑,刘建国,于铁成,等.低能体外冲击波(ESW)和低剂量间歇rhPTH1-34刺激对体外培养成骨细胞增殖分化的影响[J].中华创伤骨科杂志,2007,9(11):1062-1067.
[7] Aleksyniene R,Thomsen JS,Eckardt H,et al.Parathyroid hormone PTH(1-34) increases the volume,mineral content,and mechanical properties of regenerated mineralizing tissue after distraction osteogenesis in rabbits[J].Acta Orthop,2009,80(6):716-723.
[8] Claire MM,Mark RM,Andrew H,et al.Therapeutic Ultrasound Bypasses Canonical Syndecan-4 Signaling to Activate Rac1[J].J Biol Chem,2009,284(13):8898-8909.
[9] Mark RA,Sunho Oh,Judith AC,et al.Ultrasound effect on osteoblast precursor cells in trabecular calcium phosphate scaffolds[J].Biomaterials,2007,28(32):4788 -4794.
[10] Manabu Kinoshita,Yutaka Eguchi,Kullervo Hynynen.Activation of Bak in ultrasound-induced,JNK-and p38-independent apoptosis and its inhibition by Bcl-2[J].Biochem Biophys Res Commun,2007,353(2):515-521.
[11] Ling Qin,Pikkwan Fok,Hongbin Lu,et al.Low intensity pulsed ultrasound increases the matrix hardness of the healing tissues at bone-tendon insertion-a partial patellectomy model in rabbits[J].Clin Biomech,2006,21:387-394.
[12] Mark S Phong,Robert D Van Horn,Shuyu Li,et al.p38 Mitogen-Activated protein kinase promotes cell survival in response to DNA damage but is not required for the G2 DNA damage checkpoint in human cancer cells[J].Mol Cell Biol,2010,30(15):3816-3826.
[13] Michael RB,Benjamin BL,Megumi Aita,et al.Stress induced p38 Mitogen-Activated protein kinase activation Mediates κ-Opioid-Dependent dysphoria[J].J Neurosci,2007,27(43):11614-11623.
[14] DA Dossing,JM Radeff,J Sanders,et al.Parathyroid hormone stimulates translocation of protein kinase C isozymes in UMR-106 osteoblastic osteosarcoma cells[J].Bone,2001,29(3):223-230.
