放射剂量对腮腺区早期移植脱细胞异体真皮基质的影响
2011-01-23高润涛张皑峰李景辉韩培彦
高润涛,赵 宏,张皑峰,李景辉,韩培彦
(1.首都医科大学 附属北京友谊医院 口腔科, 北京 100050;2.首都医科大学 附属北京友谊医院 放疗科,北京 100050)
脱细胞异体真皮基质(acellular dermal matrix,ADM)为经过多种病毒筛查后的同种异体皮肤,利用组织工程技术去除真皮内的所有细胞成分,包括成纤维细胞、内皮细胞、皮脂腺、汗腺,形成只保留了真皮中Ⅳ型胶原蛋白、弹性蛋白、蛋白多糖等低抗原物质构成的三维空间结构。由于ADM具有诸多优点,现已广泛用于有关组织修复和整形的外科操作中,近年来在口腔科应用也不断增加[1-9]。腮腺区的恶性肿瘤为颌面部常见病,发病率较高,目前提倡手术加放疗的综合治疗方法。手术治疗应用ADM可促进伤口愈合、改善腮腺区美观、减少并发症。但关于移植ADM区是否可以进行早期放射治疗,以及早期放射治疗对移植ADM的影响的研究仍较少。本文拟通过模拟临床放射治疗,探讨腮腺区应用ADM后早期进行放射治疗的可行性及安全剂量,为临床应用提供依据。
1 材料和方法
1.1 实验动物及材料
新西兰大耳白兔48只,3月龄,雄性,体重2~2.5 kg,单笼饲养,自由饮食(首都医科大学实验动物中心提供并饲养)。ADM (商品名:瑞诺组织补片,北京清源伟业生物组织工程科技有限公司研制)为乳白色、半透明、蜂窝状矩形组织片(2.5 cm×2 cm)。基底膜面较光滑致密,真皮面略显柔软粗糙,厚度为0.4~0.6 mm。
1.2 ADM植入动物模型的建立
新西兰大耳白兔腹腔注射氯胺酮麻醉,备皮消毒后,在左腮腺区切开皮肤、皮下组织、颈阔肌,沿嚼肌浅面向上翻瓣显露面神经分支并分离至面神经总干处,将面神经表面的腮腺组织切除。用生理盐水冲洗ADM 3遍后将其缝固于术野并关闭伤口(图1)。
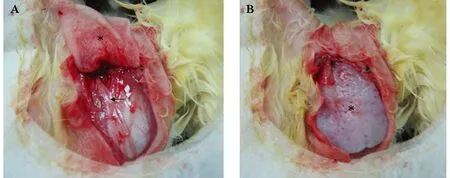
图1 兔腮腺区植入ADM
1.3 放射治疗方法
待伤口愈合良好后,将实验动物按照射剂量随机分为6组(每组8只),照射剂量分为0、10、15、20、25、30 Gy。以0 Gy剂量组为对照组,其它照射剂量组作为实验组。首先进行CT模拟定位:将兔麻醉后纵卧于CT检查床上,在耳廓前缘平面与体中线在皮肤的交点及耳廓前缘平面与口角水平在皮肤的交点分别贴标记点,之后CT扫描头颈部,层厚3 mm。应用CT轴位图像来制定照射计划:左侧腮腺设定为照射靶区,眼睛定为需保护的正常器官。使用三维治疗计划系统(TPS,Pinnacle3,version 7.6,ADAC Inc,USA) 设计治疗计划:治疗的等中心点定在体中线与口角水平线相交点,剂量计算的参考点均位于腮腺中心,照射野4 cm×4 cm,床角度(TA)90°,大机架角度(GA)350°和170°,两野对穿照射。放射治疗使用6 MV-X医用直线加速器(Varian linear accelerator,Clinac 600C,VARIAN Medical Systems Inc,USA),剂量率 3.2 Gy/min(图2)。
1.4 观察指标
观察放射治疗后的临床变化,以及放射治疗后2、4、8、12周分别从每组中取ADM观察其病理变化。通过双盲法,由病理室两位有经验的病理专家独立评估。
2 结 果
2.1 对照组的临床和病理观察
对照组(DT =0 Gy)的兔伤口愈合良好,无肿胀、流脓、排异等现象。在各时相点取ADM,肉眼观察:ADM的完整性良好,色泽仍为乳白色、半透明;病理观察:ADM呈均质状纤维组织,无降解破坏和炎症细胞浸润(图3)。

图2 放疗设计及方案
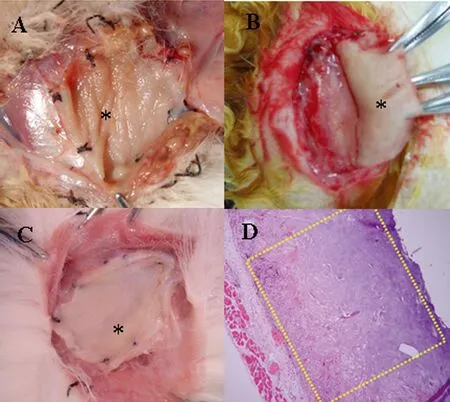
图3 对照组与DT≤25Gy的各剂量组AMD在放疗后的病理变化
2.2 实验组的临床和病理观察
2.2.1 DT≤25 Gy的各剂量组观察结果:各组在放射治疗后各时点,伤口愈合正常。各组临床表现及ADM的肉眼观察结果与对照组相似,ADM在各时点的病理表现与对照组比较差异无显著性意义(表1、图3)。

表1 ADM放疗后的临床和病理表现
以对照组的表现为正常
2.2.2 DT =30 Gy剂量组观察结果:有2只兔(2/8,25%)在放射后1周实验侧肿胀严重,局部形成炎症包块有降解物自切口处排出,待其排净后切口愈合。病理显示ADM降解破坏呈无结构状态。其余6只兔(6/8,75%)在放疗后各时点临床表现与对照组相似,但病理表现ADM全层内可见大量嗜酸性粒细胞或多核巨细胞及少量淋巴细胞呈弥漫性浸润(表1、图4)。
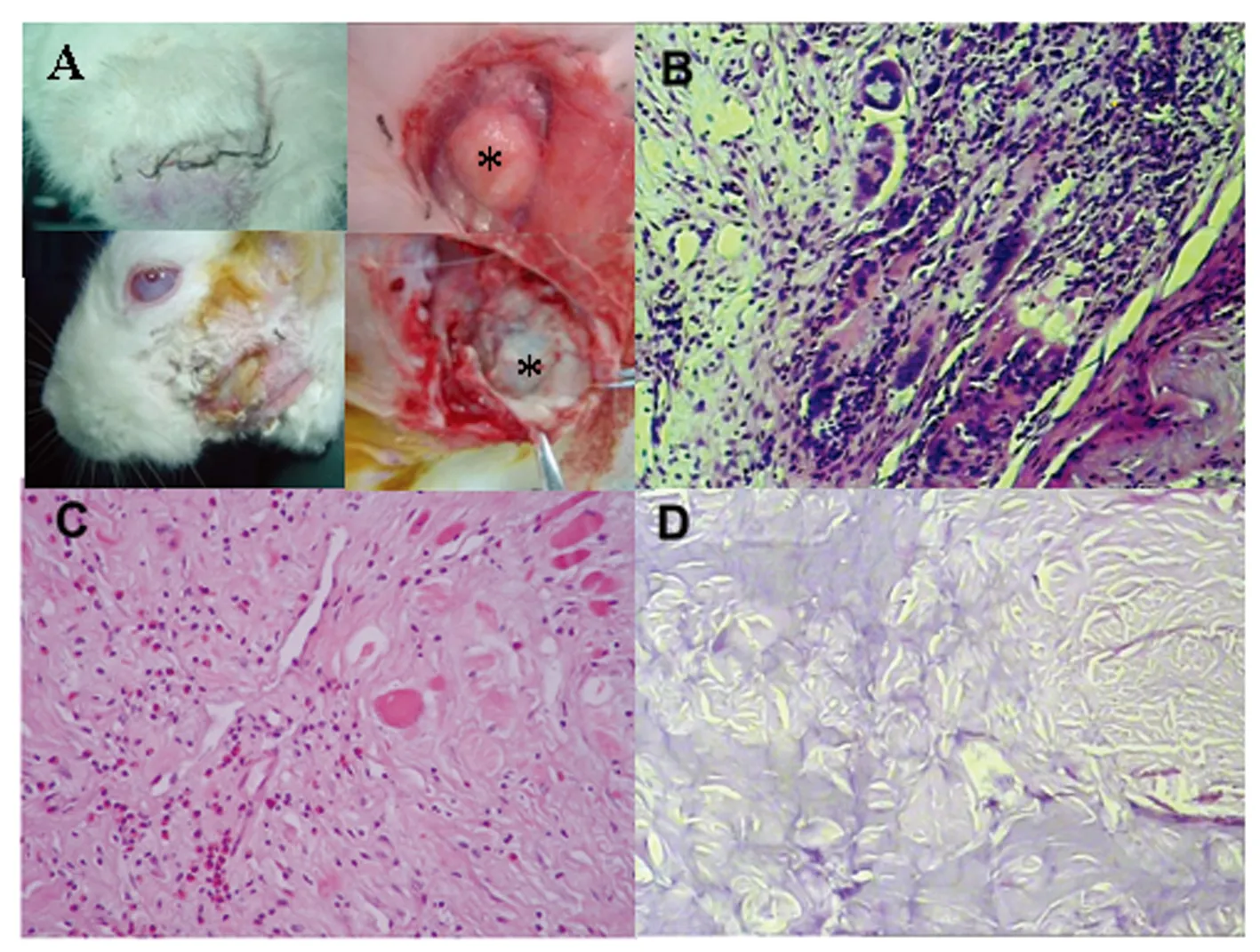
图4 DT =30 Gy剂量组AMD在放疗后的临床和病理变化
A:部分兔腮腺区出现肿胀(上左)和化脓(下左),ADM吸收(上右)和坏死(下右);B:部分ADM全层中可见大量多核巨细胞浸润;C:部分ADM全层中可见大量嗜酸性粒细胞浸润;D:偶见ADM降解破坏呈无结构状态(星号示ADM)
A: Swelling (upper-left) and suppuration (infra-left) of some parotid region,or ADM resorption (upper-right) and necrosis (infra-right); B: a large number of full-thickness infiltration of multinucleated giant cells can be seen in some ADM; C: there are a large number of full-thickness infiltration of eosinophils in some ADM; D: ADM occasionally shows no structural destruction due to degradation(Asterisk:ADM)
3 讨 论
ADM保留了基底膜复合物,形成基底膜与真皮两个面,真皮面有利于ADM的快速血管化,基底膜面可为上皮细胞的移行和定植提供一个天然平面,有利于ADM的上皮化。由胶原蛋白、弹性萤臼、蛋白多糖、糖蛋白等低抗原物质构成的细胞外基质抗原性弱,加上细胞外基质提供的三维空间,利于宿主细胞生存、长入和与宿主组织整合。此外,作为一种真皮替代物,ADM可为创面提供足够量的真皮组织,从而减轻瘢痕的形成和挛缩。由于ADM具有良好的柔韧性,易于修剪,可以切割、重叠、搓成卷状,亦可制成微粉状进行皮内或皮下注射,故临床应用方式多样。ADM作为移植材料的优势还在于可减少甚至完全消除供体部位的并发症、组织相容性好、原料来源丰富、稳定性较好、其柔软性可修复一些复杂的三维缺损、减少手术时间等。因此,近年国内在口腔领域ADM的应用范围也不断扩大[1,2]。
目前,腮腺区肿瘤较多,其手术常进行皮瓣移植或应用ADM,供体区也可能应用ADM。ADM植入后,可增加局部软组织厚度,矫正局部组织量不足,并用作为局部细胞外基质支架,邻近宿主细胞组织长入后,成为宿主自身组织的一部分。与其他皮瓣移植相比,ADM移植后可以作为上皮细胞、成纤维细胞、新生血管的良好支架,具有促进愈合、恢复丰满度、无需其它部位供体手术并可预防味觉出汗综合症等优点[1,2,8,9]。但应用ADM对术后需辅以放射治疗的方案提出挑战,必需考虑ADM植入区域或邻近区域是否能进行早期放射治疗。另外,头颈部应用ADM后因其他原因需进行放射治疗也要考虑是否对植入的ADM产生影响。国外研究表明,鼠表皮移植ADM后放疗结果表明:DT=20 Gy是安全可靠的,这低于本文结果,可能是种属差异所致。在临床手术中,植入ADM并进行放射治疗未见明显异常现象[3-7]。因此,如必需兼顾ADM应用和早期放射可以通过调整放射方式和放射剂量来权衡。
3.1 采用靶向放射技术
对ADM植入区为非治疗区的头颈部放疗病例,可采用靶向放射技术以减少对ADM的放射影响。随着放射治疗技术的不断完善,一些放射新方法新方式逐渐得到应用,如三维适形放射治疗、调强放射治疗以及目前在头颈部肿瘤经常使用的多野照射技术[10]。这些放疗技术的改进使需要照射的部位获得治疗剂量而其他部位受到最小的放射剂量。但即便如此,仍不能保证邻近的正常器官和组织免受照射。根据本实验结果,单次放射剂量DT=30 Gy时,部分ADM中有大量炎症细胞浸润或降解破坏呈无结构状态,这势必会影响局部组织的修复。所以,如果放射治疗累及到ADM植入区,那么ADM植入区受到的单次放射剂量安全阈值不要超过25 Gy。
3.2 采用分次放射技术
临床中恶性肿瘤的放射治疗常采用分次照射(2 Gy/次,5次/周)以减少正常器官和组织的放疗反应,累计根治剂量一般为60~70 Gy。根据LQ线性二次方程,对肿瘤组织和早反应正常组织,25 Gy的单次照射的生物效应相当于常规分次照射累计剂量72 Gy;对晚反应组织则相当于常规分次照射剂量140 Gy。这说明临床的单次放射剂量远远低于25 Gy,ADM完全可以耐受。在ADM植入的区域进行早期放射治疗是安全的,只有累计放射剂量超过72 Gy时需慎重。
[1] 俞凯,杨钧,李满敬,等.脱细胞异体真皮基质预防味觉性出汗综合征的临床观察[J].中华口腔医学杂志,2007,42(9):570-571.
[2] 曾昭旋.腮腺咬肌筋膜和脱细胞异体真皮基质在预防腮腺手术后Frey综合征中的临床应用[J].临床口腔医学杂志,2010,26(1):40-42.
[3] Tadjalli HE,Evans GR,Gürlek A,et al.Skin graft survival after external beam irradiation[J].Plast Reconstr Surg,1999,103(7): 1902-1908.
[4] Ibrahim HZ,Kwiatkowski TJ,Montone KT,et al.Effects of external beam radiation on the allograft dermal implant[J].Otolaryngol Head Neck Surg,2000,122(2): 189-194.
[5] Dubin MG,Feldman M,Ibrahim HZ,et al.Allograft dermal implant (AlloDerm) in a previously irradiated field[J].Laryngoscope,2000,110(6): 934-937.
[6] Butler CE,Langstein HN,Kronowitz SJ.Pelvic,abdominal,and chest wall reconstruction with AlloDerm in patients at increased risk for mesh-related complications[J].Plast Reconstr Surg,2005,116(5): 1263-1275.
[7] Nahabedian MY.AlloDerm performance in the setting of prosthetic breast surgery,infection,and irradiation[J].Plast Reconstr Surg,2009,124(6): 1743-1753.
[8] Clayman MA,Clayman LZ.Use of AlloDerm as a barrier to treat chronic Frey's syndrome[J].Otolaryngol Head Neck Surg,2001,124(6): 687.
[9] Sinha UK,Saadat D,Doherty CM,et a1.Use of AlloDerm implant to prevent frey syndrome after parotidectomy[J].Arch Facial Plast Surg,2003,5(1): 109-112.
[10] 乐文友,戴建荣,高黎.鼻咽癌调强放疗等效均匀剂量优化方法对腮腺的保护作用[J].中华放射肿瘤杂志,2006,15(6):484-488.
