一氧化氮对豚鼠耳蜗外毛细胞L-型钙通道电流影响的实验研究
2011-01-23曹玲黎万荣
曹玲 黎万荣
最近研究表明耳蜗中有大量的一氧化氮合酶(nitric oxide synthease,NOS)存在[1],提示一氧化氮(NO)在耳蜗内有生物作用。耳蜗内的NO与耳蜗血流调节、内淋巴液离子稳定性和神经传导等生理过程有关,还影响内耳多种疾病的病理生理过程[2]。目前人们对内耳NO及NOS的研究大多仍集中在正常生理情况下的分布和功能特征方面,而对其在内耳病理生理与药理条件下的研究报道尚少见,如NO是否可以通过影响耳蜗外毛细胞表面的钙通道,从而调节外毛细胞的功能状态,影响某些内耳疾病的发生和发展等。本实验应用全细胞膜片钳技术观察NO供体之一L-精氨酸(L-Arg)对豚鼠耳蜗外毛细胞L型钙通道电流(ICa-L)的影响,以探讨NO能否通过耳蜗外毛细胞钙通道途径调节外毛细胞及内耳的功能。
1 材料与方法
1.1耳蜗外毛细胞分离 实验动物为40只杂色或白色豚鼠(由泸州医学院实验动物中心提供),体重325±22 g,雌雄不拘。动物快速断头处死,取出颞骨,迅速打开听泡,置入已充氧的冷Hanks液中;解剖显微镜下仔细剔除耳蜗骨壳,尽量保持膜迷路完整;断开蜗轴,将耳蜗轻移入含胶原酶Ⅳ的D’Hanks液中消化10~20分钟;轻移入含钙的Hanks液中终止消化5分钟;轻移入预先用多聚赖氨酸处理过的浴槽中,解剖显微镜下微镊撕除螺旋韧带,剪碎基底膜,轻轻吹打后静置10分钟,使单离的外毛细胞贴附于浴槽底部;小心更换新鲜的浴液。选择贴壁良好、立体感强、表面光滑、胞核接近底部、胞内无布朗运动颗粒、胞膜完整有双折射现象的单离外毛细胞进行观察和实验。
1.2实验材料 电极液(mM):CsCl 119.8, MgCl24.0,EGTA 5.0,CaCl20.06,HEPES 10.0,Na2ATP 3.1, NaGTP 0.42,CsOH调pH至 7.25~7.3。浴液(mM):NaCl 107.1,CsCl 30.0,MgCl21.8,CaCl21.8, NaHCO34.0, Glucose 5.0,Sodium pyravate 5.0,HEPES 10.0,NaH2PO4·2H2O 0.8,NaOH调pH至7.3~7.4。Hanks液(mM):KCl 5.4,KH2PO4 0.5 ,NaCl 137.0,NaHCO34.2,Na2HPO40.3, MgCl20.5,MgSO40.4, CaCl21.3,Glucose 5.0,NaOH调pH至7.3~7.4。 D Hanks液(mM):KCl 5.4,KH2PO4 0.5 ,NaCl 137.0,NaHCO34.2,Na2HPO40.3,NaOH调pH至7.3~7.4。盐桥液同电极液。胶原酶Ⅳ(collagenase Ⅳ):0.5 mg/ml以上试剂中,HEPES、EGTA、Na2ATP、NaGTP、CsOH、Sodium pyravate、胶原酶Ⅳ均购自美国Sigma公司,L-精氨酸(L-Arg):C6H14N4O2,Japan,余为国产分析纯。
玻璃微管电极制备:选用内径1.0 mm、壁厚0.25 mm、长度75.0 mm的软质毛细玻璃管 (美国Drummond scientific 公司生产),置于微管电极拉制仪上,经两步拉制而成,第一步拉制参数设置为58.4 mA,第二步拉制参数设置为53.5 mA,通过两步拉制后的电极尖端直径约为0.7 mm ,充灌电极液后电极阻抗约为5~8 MΩ。将拉制成的微管电极置于抛光仪垂直推进架上,在低倍镜(×60)下找到电极尖端和加热电阻丝,然后换成高倍镜(×495),将加热电阻丝和电极尖端调整至一个平面内,进行瞬间高温加热,待电极尖端微微回缩后,立即停止加热,完成电极抛光。
1.3ICa-L的记录 采用膜片钳全细胞记录方式(AXOPA TCH-200B Axon instrument,USA)记录不同浓度L-Arg对L型钙通道电流的影响,根据溶液中加入的L-Arg浓度,分为0.5×10-6mol/L组(A组)、1.0×10-6mol/L组(B组)及1.5×10-6mol/L组(C组),分别观察各组用药后5分钟内 ICa-L峰值电流密度增幅。选择钳制电压(VH)为-60 mV,刺激持续时间为200~300 ms的测试电压,10 mV为一个阶跃,从-50 mV除极到+50 mV,激活钙通道,记录ICa-L。实验中全细胞电流信号经膜片钳放大器放大后,引入记忆示波器及12位A/D、D/A转换器,再输入计算机用于电流信号采集,采样频率为20 kHz。所记录的电流数据采用P-Clamp9.0专用软件进行分析处理,分析电流幅值(current amplitude,Am)、电流密度(current density)和电流-电压关系曲线(I-V)。记录在屏蔽防震工作台上进行。

2 结果
2.1ICa-L的特性及鉴定 图1为豚鼠耳蜗外毛细胞在细胞外液游离钙离子浓度为1.8 mmol/L和Cs+内液时,膜片钳全细胞记录方式下记录到的电流图形。本实验钳制电压(VH)设置为-60 mV,以10 mV为一个阶跃,改变指令电压(VT)(-50 mV~+50 mV),刺激持续时间为200~300 ms,可记录到一电压依赖性的内向电流。此内向电流的激活电压大于-40 mV~-30 mV,激活范围在-50 mV~+50 mv电压范围内。当VT为0 mV时电流幅值Am达峰值,反转电位约为+60 mV,I-V曲线为钟型。此内向电流具有明显的衰减现象,可被维拉帕米完全阻断。以上结果均提示该内向电流为电压依赖性L型钙通道电流。

图1 膜片钳全细胞记录方式记录到的豚鼠耳蜗外毛细胞ICa-L
2.2L-Arg对耳蜗外毛细胞ICa-L的影响 VH为-60 mV、VT为0 mV时(图2)观察L-Arg对通道电流的影响。通道电流在L-Arg浓度为0.5×10-6mol/L ~1.5×10-6mol/L(低浓度)表现为浓度依赖性抑制,电流幅值和峰值电流密度随L-Arg浓度的增大而减小(图3~5),洗脱后通道电流部分恢复。用药后5分钟内各组ICa-L峰值电流密度增幅最大值分别为:A组从3.78±1.40 pA/pF降至3.70±1.22 pA/pF,增幅为-2.12%,A组用药前后比较,ICa-L增幅差异无统计学意义(P=0.35,t=1.06);B组从3.78±1.40 pA/pF降至2.62±0.85 pA/pF,增幅为-30.69%,用药前后比较,ICa-L增幅差异有极显著统计学意义(P=0.003,t=6.58);C组从3.78±1.40 pA/pF降至1.32±0.17 pA/pF, 增幅为-65.08%, 用药前后相比,ICa-L增幅差异有极显著统计学意义(P=0.001,t=6.35);A与B、B与C、A与C组之间比较,ICa-L的增幅差异均有极显著统计学意义(均为P<0.01)。
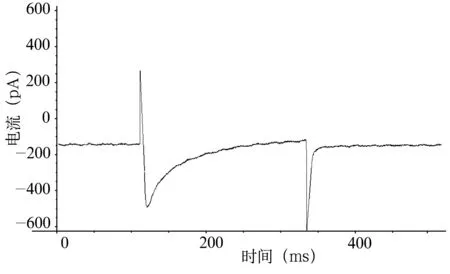
图2 VH为-60 mV,VT为0 mV时浴液内未加L-Arg时豚鼠耳蜗外毛细胞ICa-L

图3 VH为-60 mV,VT为0 mV时浴液内加入L-Arg 0.5×10-6mol/L时豚鼠耳蜗外毛细胞ICa-L
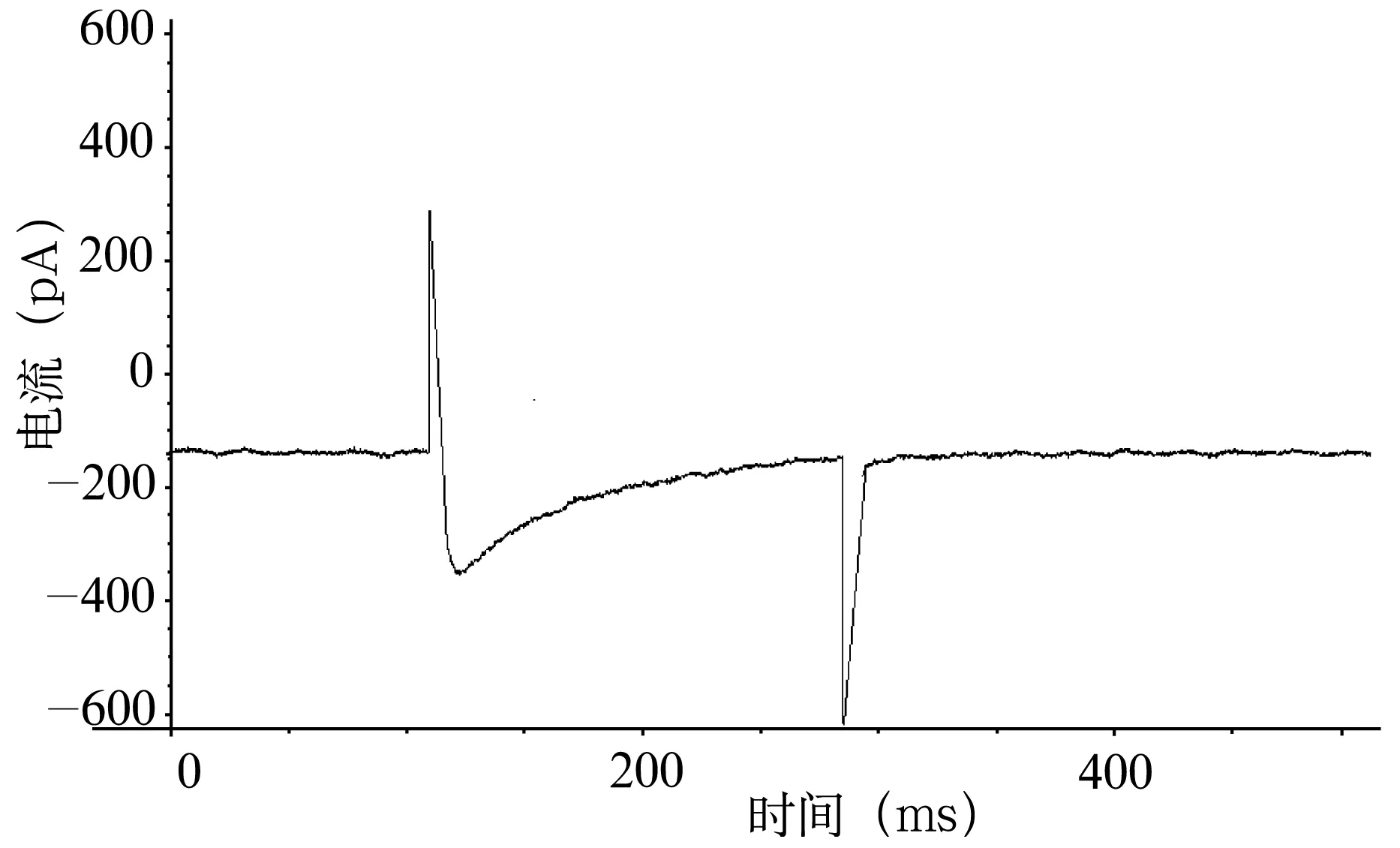
图4 VH为-60 mV,VT为0 mV时浴液内加入L-Arg 1.0×10-6mol/L时豚鼠耳蜗外毛细胞ICa-L
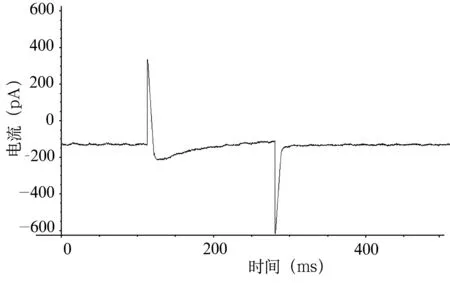
图5 VH为-60mV,VT为0mv时浴液内加入L-Arg1.5×10-6mol/L时豚鼠耳蜗外毛细胞ICa-L

图6 L-Arg对豚鼠单个耳蜗外毛细胞ICa-LI-V曲线的影响
2.3L-Arg对ICa-L作用的I-V关系 在低浓度状态下,L-Arg可使ICa-L减小,I-V曲线上抬(图6),并且随指令电压的变化而发生规律性的变化,在锋电流电压下作用最明显,对反转电位无明显影响。
3 讨论
在耳蜗水平,钙通道主要是控制突触部位神经递质的释放,也可调节毛细胞中一些依赖Ca2+的细胞功能活动,包括适应慢收缩过程的调节。内毛细胞的钙通道与钾通道互相配合,参与感受器电位的调节。前庭感受器II型毛细胞的L型钙通道的特点与内毛细胞的相似,而对耳蜗外毛细胞和前庭感受器I型毛细胞钙通道研究资料较少。外毛细胞的L型钙通道在膜电位去极化至-30 mV时激活,与其静息膜电位-70 mV~-80 mV相距甚远,故生理意义尚不清楚。前庭感受器I型毛细胞L型钙通道的生物物理特性与前庭感受器II型毛细胞的差别不大,其功能可能是参与感受器电位的调节及突触部位递质的释放。
电压门控L型钙通道位于内毛细胞突触前膜,控制钙离子内流和内耳传入突触的递质释放[3],对听觉产生有重要意义。耳蜗内的NO与耳蜗血流调节、内淋巴液离子稳定性和神经传递有关。生理条件下,NO维持内耳功能并与耳蜗蜗内电位(EP)、复合动作电位(CAP)、微音电位(CM)的产生有关[4]。基于L型钙通道和NO在耳蜗外毛细胞活动中的重要作用,本实验研究NO供体L-Arg对ICa-L的影响,结果可见在全细胞膜片钳记录方法下,L-Arg浓度为0.5×10-6mol/L ~1.5×10-6mol/L时,对L型钙通道电流表现为浓度依赖性抑制,电流幅值和峰值电流密度随L-Arg浓度的增大而减小,I-V曲线上抬,洗脱后通道电流部分恢复。
周建波等[5]指出,在生理条件下,体内的NO对耳蜗外毛细胞的保护作用可能是通过阻断外毛细胞L型钙通道电流的内流,从而抑制胞内Ca2+超载来发挥作用的,这也可能是病理生理过程初期阶段的一种保护机制。有文献报道应用低浓度L-Arg活体灌流耳蜗,可以部分拮抗H2O2对毛细胞的损伤[6],也支持上述机制存在的可能性。本实验研究结果显示低浓度L-Arg抑制ICa-L的机制与上述文献报道一致。
通过本实验和既往实验研究结果[6]推测NO对L型钙通道的影响可以通过激活钙激活钾通道(KCa)的负反馈机制使K+外流,促使膜向超极化方向变化,使Ca2+通道关闭,降低胞内Ca2+水平。基于上述推测,NO生成过多或L型钙通道功能异常及病理条件下,耳蜗内氧自由基等代谢产物大量增加,可能造成外毛细胞胞内Ca2+增加,胞内钙超载,致细胞死亡,导致内耳疾病的产生和发展。临床上应用钙拮抗剂治疗内耳疾病有一定效果的实践,也从另一方面支持上述机制存在的可能性[7]。
综上所述,认为在调节豚鼠耳蜗外毛细胞的活动中存在NO/ICa-L途径。然而,NO在内耳的作用可能是多方面的,其作用机理十分复杂,简单的电生理研究仅能揭示NO在内耳作用的部分机制,并不能反映其全部的生理过程。今后有待于利用其它先进技术进一步研究,深入探索NO与ICa-L的详细作用机制。
(致谢:本研究实验部分在泸州医学院心肌电教研室完成,曾晓荣教授、李妙龄老师给予大力帮助,在此表示衷心的感谢!)
4 参考文献
1 Dulon D,Zajic G,Aran JM, et al.Aminoglycoside antibiotics impair calcium entry but not viability and motility in isolated cochlear outer hair cells [J].J Neurosci Res,1989,24:338.
2 Aran JM ,Erre JP,Lima da Costa D,et al.Acute and chronic effects of aminoglycosides on cochlear hair cells[J].Ann N Y Acad Sci,1999,884:60.
3 Catterall WA.Strueture and regulation of voltage-gated Ca2+channels[J].Annu Rev Cell Dev Bio1,2000,16:521.
4 李兴启,贾学斌,曹效平,等.一氧化氮-环磷酸鸟苷通路对耳蜗灵敏度的调节[J].中华耳鼻咽喉头颈外科科杂志,2006,41:532.
5 周建波,孔维佳.硝普纳对豚鼠耳蜗外毛细胞全细胞钙电流作用的实验研究[J].中华耳鼻咽喉科杂志,2003,38:259.
6 赖丹,黎万荣,李兴启.一氧化氮对过氧化氢所致听力损失的保护作用[J].生理学报,2004,56:237.
7 Mann W,Beck C,Beck C.Calcium antagonists in the treatment of sudden deafness[J].Arch Otorhinolaryngol,1986,243:170.
