一株嗜热菌木糖异构酶的纯化与性质研究*
2011-01-13张波殷燕
张波,殷燕
木糖异构酶 (xyloseisomerase,XI,EC 5.31.1.5),又称葡萄糖异构酶,此酶在细胞内可将五碳糖D-木糖转化为D-木酮糖,在微生物体内的糖代谢过程中起着重要的作用。在体外可转化葡萄糖形成果糖,并已经用于高果糖浆的工业生产,是一种重要的工业用酶。目前用于生产的木糖异构酶多来自Streptom yces,Actinoplanes,Flavobacterium等常温菌,其催化产物需要借助层析等浓缩步骤方可得到 55%的高果糖浆[1]。若能升高异构化反应的温度则有利于反应向着果糖生成的方向移动。因此寻找和开发耐热木糖异构酶有望减少生产步骤,直接获得高果糖浆[2]。近年研究发现,在一定条件下木糖异构酶还可催化生产许多制药工业重要的原料稀有糖,如核糖、甘露糖、阿拉伯糖、来苏糖等。对于高温菌产生的木糖异构酶,Kitada[3]报道了 1株B acillusTX-3可以在 55℃下生产木糖异构酶,酶的最适反应温度达到80℃;Lehmacher[4]也报道了,在 85℃催化异构化反应的嗜热酶,但国内相关研究较少。本文研究了 1株从云南腾冲温泉水样中筛选的嗜热菌 (Anoxybacillus flavither m us)所产木糖异构酶的分离纯化以及酶学性质。
1 材料与方法
1.1 实验菌株与培养基
嗜热菌Anoxybacillus flavither m usWL,分离自云南腾冲温泉[5]。
培养基:木糖 10 g,蛋白胨 2 g,酵母提取物 2 g,Na2S2O3·5H2O 1 g,Na2S·9H2O 0.3 g,MgSO40.2 g,无机盐溶液 10 mL,定容至 1 L,pH 7.5。
无机盐溶液:MnSO4· H2O 0.5 g,CuSO4·5H2O 0.01 g,CoCl2·6H2O 0.045 g,FeSO4·7H2O 0.1 g,ZnSO4· 7H2O 0.5 g,定容至 1 L。
固体培养基加入琼脂粉 17.0 g,115℃高压蒸汽灭菌 20 min。
1.2 木糖异构酶活性测定方法
采用半胱氨酸-咔唑法测定酶活性[6]:0.1 mol/LD-木糖 50μL,酶液 50μL,10 mmol/L MgCl250μL,85℃反应 15 min,沸水浴终止反应。取 100μL立即加入 13 mol/L的 H2SO46 mL,1.5%半胱氨酸盐酸盐溶液 0.2 mL,0.12%咔唑酒精溶液 0.2 mL,混匀,室温放置 2 h,于 540 nm处测定光吸收。据木酮糖标准曲线求得木酮糖量。酶活单位定义为:每分钟催化产生 1μmol木酮糖的酶量为 1个酶活力单位。
1.3 粗酶液制备及酶的纯化
1.3.1 粗酶液的制备
取发酵液离心收集菌体,用 5 mmol/L Tris-HC1(pH 7.5)离心洗涤 2次,菌体重新悬浮于缓冲液中,低温超声波破碎细胞 20 min,离心 (4℃ 10 000 r/min),上清液即为粗酶液。
1.3.2 木糖异构酶的分离纯化
硫酸铵沉淀得到粗酶制品。酶的纯化步骤为:首先采用 Sephadex G-75凝胶过滤对粗酶进行纯化,然后再进行两步阴离子交换层析来进行进一步的纯化(第一步阴离子交换层析柱分离采用纤维素 DE-52弱阴离子交换柱,第二步阴离子交换层析柱分离采用Q Sepharose Fast Flow强阴离子交换柱离子交换层析)。用溶于相同缓冲液的 0~1.0 mol/L NaCl盐溶液进行梯度洗脱,收集活性峰,测定蛋白浓度和酶活,酶液冷冻干燥后溶于 pH7.5,20 mmol/LTris-HCl缓冲液中透析 18h后上 QSFF柱。20 mmol/L,pH7.5的 Tris-HCl缓冲溶液作为初始缓冲液,流速 0.5 mL/min,0~1.0 mol/L NaCl盐溶液进行梯度洗脱,收集活性峰,测定蛋白浓度和酶活。纯化后的样品置-20℃冷冻保存备用。
1.3.3 SDS-PAGE和 Native-PAGE电泳
Native-PAGE电泳又称未变性聚丙烯酰胺凝胶电泳技术,即在不加入 SDS、疏基乙醇等变性剂的条件下对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,这样可以使生物大分子在电泳过程中保持其天然的形状和电荷,尤其是在电泳分离后仍能保持蛋白质和酶等生物大分子的生物活性。电泳后分别剪下酶条带,用 pH7.5,20 mmol/L Tris-HCl缓冲液洗涤 3次,研钵碾碎,样品加入适量 pH7.5,20 mmol/L Tris-HCl缓冲液,4℃下浸泡 24h,10 000 r/min离心 10 min除去凝胶,上清液即为纯酶溶液,测定蛋白浓度和酶活。
SDS-PAGE电泳又称变性聚丙烯酰胺凝胶电泳技术。取酶液进行 SDS-PAGE电泳。样品 10 000 r/min离心 10 min后取上清液上样,进样量 25μL。具体操作条件和步骤见文献[7]。
1.3.4 木糖异构酶酶学性质的研究
木糖异构酶最适反应温度的测定:反应温度分别为 40、50、60、70、75、80、85、90、95℃,测定酶活性。
木糖异构酶最适反应 pH的测定:反应的缓冲液pH分别为 pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,测定酶活性。
金属离子对酶活性的影响:分别向酶和底物的反应体系中加入终浓度为 0.5 mmol/L的 ZnSO4、CaCl2、CoCl2、MgSO4、FeSO4、AlCl3、CuSO4代替之前的 Mn-SO4,测定酶活性,同时以不添加金属离子的为对照组。
木糖异构酶热稳定性的测定:将酶液分别在 40、50、60、70、75、80、85、90、95℃保温 1h后测定剩余酶活力,研究该酶的热稳定性。
木糖异构酶酸碱稳定性的测定:将酶液分别在pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0缓冲液中 60℃保温 1h后测定剩余酶活力,研究该酶的酸碱稳定性。
2 结果与分析
2.1 木糖异构酶的分离纯化
来源于Anoxybacillus flavither m usWL的木糖异构酶,经过硫酸铵沉淀、凝胶过滤层析、两步阴离子交换层析后,检测蛋白浓度和酶活,酶的纯化倍数约为7.9倍。结果见图1~图3。
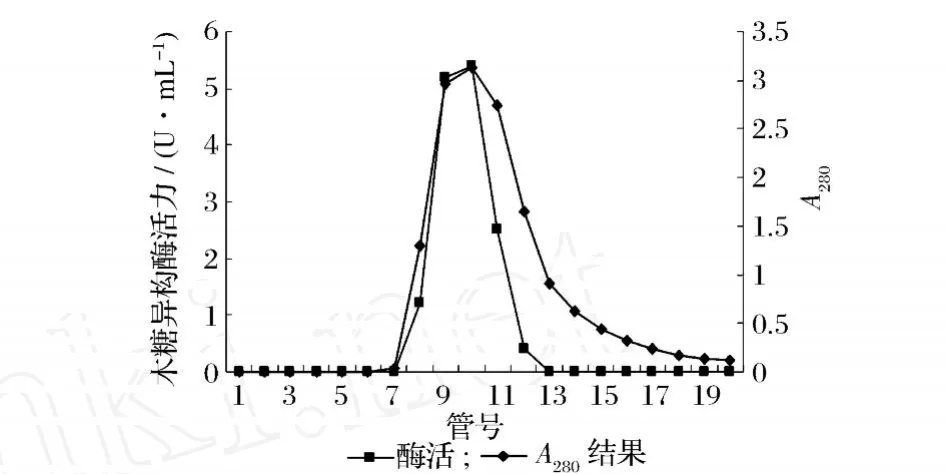
图1 菌株WL XI Sephadex G-75凝胶过滤层析谱图

图2 菌株WL XI纤维素 DE-52离子交换层析

图3 菌株WL XIQ Sepharose Fast Flow离子交换层析谱图
2.2 木糖异构酶的 SDS-PAGE和 Native-PAGE电泳分析
图4 为各级纯化处理酶液与标准蛋白在同一条件下进行的 Native-PAGE电泳图谱,其中条带 4显示的是 2步阴离子交换层析分离纯化得到的 3条蛋白带。将此 3条蛋白带分别剪下取出,分别测定木糖异构酶活性,其中分子质量为 181 ku的蛋白带具有木糖异构酶活性 (酶活测定为 12U/mg),其他 2条蛋白带无木糖异构酶活性,表明条带 4中分子量约为 181 ku的蛋白带为木糖异构酶,结果见图4。经 Native-PAGE电泳后分离得到的木糖异构酶蛋白与标准蛋白在同一条件下进行 SDS-PAGE电泳,与标准蛋白的分子量比较,酶的分子质量约为 45 ku,结果见图5。综合图4和图5的结果表明,该酶蛋白分子质量约为181 ku,由 4个分子质量约为 45 ku的亚基组成。

图4 XINative-PAGE电泳图谱

图5 XI SDS-PAGE电泳图谱
2.3 木糖异构酶的的酶学性质
2.3.1 温度对酶活性的影响
由图6可知,酶反应的最适温度为 80℃,在较低温度下该酶的活性很低。
2.3.2 pH值对酶活性的影响
由图7可知,pH值 4.0至 pH值 5.0时,酶活极低,而 pH 5.0至 pH 6.0时,酶活急剧上升,pH7.0至pH 8.0时,酶活处于稳定状态。从 pH 8.0开始酶活降低但至 pH 11.0时酶活仍保持较高水平。酶的最适 pH约在 7.0左右。
2.3.3 木糖异构酶稳定性研究
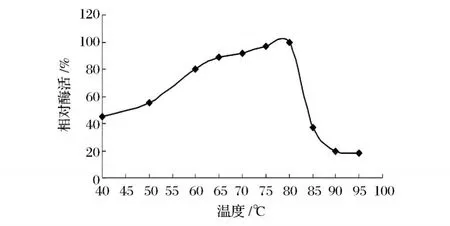
图6 温度对 XI活性的影响

图7 pH对 XI活性的影响
木糖异构酶分别在不同的温度下水浴保温 1h后的剩余酶活如图8所示,在无底物存在的条件下,60℃保温 1 h后酶活仍保持近 100%,70℃保温 1 h后酶活仍能保持近 80%,但在 70℃以上,随温度上升酶活性明显下降,至 80℃时酶活性几乎全部消失。
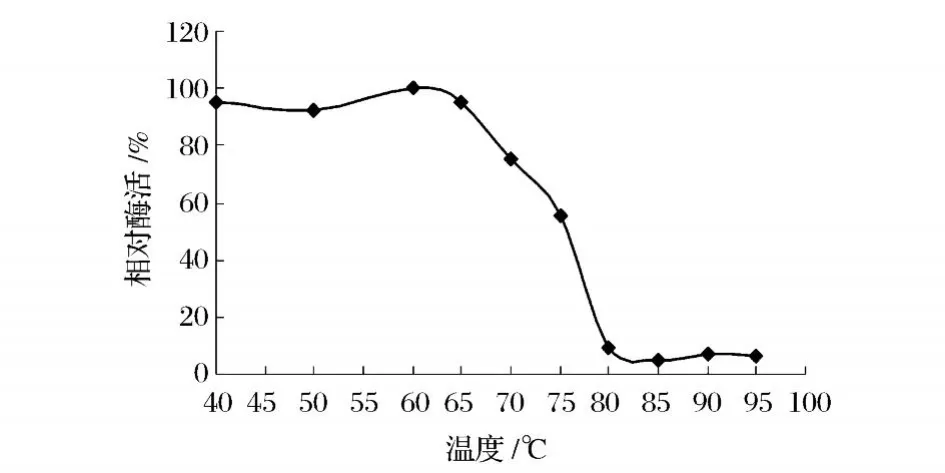
图8 XI的热稳定性
木糖异构酶分别在不同 pH的缓冲液中无底物存在的条件下,保温 1 h后的剩余酶活如图9所示,pH 4.0时酶活很低,随 pH增大酶活性明显上升,pH 5.0时酶活近 100%。pH 5.0至 pH 8.0之间酶活性稳定保持在 80%以上,在 pH 9.0以上,随 pH增大酶活性明显下降,但直到 pH 12.0时酶活性仍能保持40%左右。
2.3.4 金属离子对木糖异构酶活性的影响
添加不同的金属离子对菌株Anoxybacillus flavither m usWL木糖异构酶活性的影响见表1,Ca2+、Co2+、Mg2+、Fe2+、Mn2+均对酶活有促进作用 ,尤以Mn2+和 Co2+对酶活的促进作用明显,Zn2+、Cu2+以及 Al3+对酶活有一定程度的抑制作用。

图9 XI的酸碱稳定性
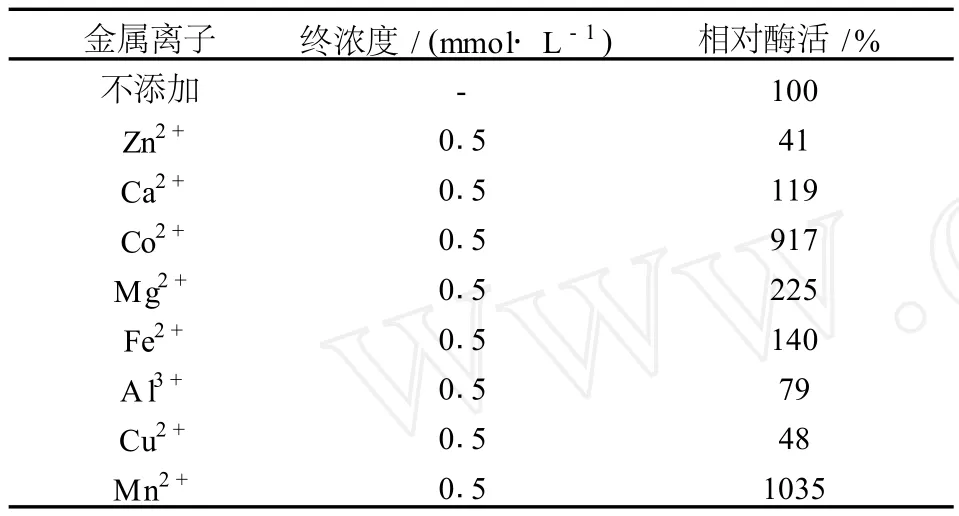
表1 金属离子对酶活性的影响
3 讨论
木糖异构酶作为微生物利用木糖的关键酶一直受到国内外的关注。目前国内外已报道的 XI分子量通常在 180-200 ku。如从Streptom ycessp.SK中分离得到的葡萄糖异构酶分子量在 180 ku左右,由 4个相同分子量的亚基组成,属于分子量较小的一类[8];从Clostridium ther m osulfurogenes和Ther m oanaerobacter等分离得到的葡萄糖异构酶均为分子量 200 ku的同型四聚物,分子量相对较大[9-10]。本实验从嗜热菌Anoxybacillus flavither m us分离得到的木糖异构酶,分子量约 181 ku,由 4个相同分子量的亚基组成。具有极好的热稳定性和酸碱稳定性,70℃保温 1 h后酶活仍能保持近 80%,pH5.0~pH8.0范围内酶活性保持在 80%以上。当前谷物转化为果糖糖浆主要是采用中温型微生物的葡糖异构酶将葡萄糖异构化为果糖,但中温型微生物的葡糖异构酶的热稳定性不高,最适作用温度为 60℃,在这个温度下果糖产量不高。目前已从嗜热菌中分离了一些热稳定的木糖异构酶,并进行了研究。如 1997年 Park[11]等从Ther m us favusAT62中分离纯化了一种木糖异构酶 (XylA),该酶为一种四聚体,其分子量为 185 ku,最适作用温度为90℃,最适 pH值 7.0,其催化活性需要二价阳离子如Mn2+、Co2+和Mg2+的存在。嗜热古细菌菌株 JWPSL2YS 489能产生一种分子质量为 200 ku的木糖异构酶,其催化活性同样需要二价阳离子如Mn2+、Co2+和Mg2+的存在。在缺少底物的情况下,82℃处理 1 h该酶仍然稳定[12]。从T.m aritim a分离纯化得到的热稳定性葡萄糖异构酶,当温度达到 100℃时,其活性保持不变;当温度继续上升到 115℃时,10 min后仍有 50%的酶活[13]。虽然嗜热菌所产生的酶耐高温,适合于高温条件的工业生产,但要使之用于大规模的工业生产还存在一些目前尚未解决的问题,如一般嗜热微生物培养条件比较苛刻;大规模发酵生产需要特殊的设备;产酶效率较低等等。这些因素限制了它们的应用。还需要通过各种方法和手段从极端环境中筛选,或通过育种,或采用分子生物学手段等得到抗性更强、酶活更高的嗜热酶生产菌株,从而实现耐高温木糖异构酶在工业生产中的应用。本实验筛选的嗜热菌Anoxybacillus flavither m usWL生长快,容易培养,产生的木糖异构酶热稳定性和酸碱稳定性良好,有望用于生产和应用。
4 结论
本课题研究的嗜热菌所产的酶为木糖异构酶,分子量为 181ku,由 4个相同分子质量的亚基组成。酶的最适反应温度为 80℃,最适 pH值 7.0。70℃保温1h后,酶活保持近 80%,pH5.0~pH8.0内保温 1h,酶活保持 80%以上。Mn2+和 Co2+对酶活性有明显促进作用。Zn2+、Cu2+、Al3+对酶活有一定程度的控制。
[1] Lama L,Nicolaus B,Calandielli V,et al.Purification and characterization of ther mostable xylose(glucose)isomerase fromBacillus ther m oantarcticus[J].JornalofMicrobiology and Biotechnology,2001,27(4):234-240.
[2] Tewari YB,Goldberg R N.Thermodynamicsof the conversion of aqueous glucose to fructose[J].Journal of Solution Chemistry,1984,13(8):523-547.
[3] KitadaM,Dobashi Y,Horikoshi K.Enzymatic properties of purified D-xylose isomerase from a thermophilic alkalophileBacillusTX-3[J].Agricultural and Biological Chemistry,1989,53(6):1 461-1 468.
[4] LehmacherA,Biss wangerH.Isolation and characterization of an extremely thermostableD-xylose isomerase fromTher-mus aquaticusHB8[J].Journal of GeneralMicrobiology,1990,136:679-686.
[5] 殷燕,张波 .一株产木糖异构酶嗜热菌的分离鉴定及其培养条件优化[J].食品与发酵工业,2010,36(3):112-116.
[6] 周世宁,黄蕾,陆勇军,等 .嗜热脂肪芽孢杆菌耐热木糖异构酶的特性[J].微生物学通报,1998,25(5):271-274.
[7] Laemmli U K.Cleavage of structural proteins during the assembly of the head ofBacteriophageT4[J].Nature,1970,227:680-685.
[8] BorgiM A,Srih-Belguith K,Ben AliM,et al.Glucose isomerase of theStreptomycessp.SK strain:purification,sequence analysis and implication of alanine 103 residue in the enzyme thermostability and acidotolerance[J].Biochi mie,2004,86(8):561-568.
[9] Lee C Y and Zeikus J G.Purification and characterization of thermostable glucose isomerase fromClostridium ther m osulfurogenesandTher moanaerobacterstrain B6A [J].Journal ofBiochemistry,1991,273:565-571.
[10] Stephen H Brown,Carsten Sjohol m,RobertM Kelly.Purification and characterization of a highly ther mostable glucose isomerase produced by the extremeTher m ophilic eubacterium,Ther m otoga m aritima[J].Biotechnology and Bioengineering,1993,41:878-886.
[11] Park B C,Koh S,Chang C,et al.Cloning and expression of the gene for xylose isomerase fromTher m us favusAT62 inEscherichia coli[J].ApplBiochem Biotechnol,1997,62:15-27.
[12] Liu S Y,W iegel J,Gherardini F C.Purification and cloning of a thermostable xylose(glucose)isomerase with an acidic pH optimum fromTher m oanaerobacteriumstrain JWPSL2YS489[J].J Bacteriol,1996,178:5 938-5 945.
[13] Brown S H,Sjholm C,Kelly R M.Purification and characterization of a highly thermostable glucose isomerase produced by the extremely thermophilic eubacteriumTherm otoga m aritim a[J].BiotechnolBioeng,1993,41:878-886.
