烙铁头蛇毒中一个具有抗补体活性金属蛋白酶的纯化和性质研究
2010-11-29闫银萍孙黔云
闫银萍,孙黔云
补体是人体重要的免疫防御系统,但过度激活会引发一系列的病理生理反应,参与多种疾病的发生发展[1]。寻找有效的补体抑制成分,能为探索相关疾病的发生发展,以及预防和治疗由补体引起的各种炎症反应及相关的病理损伤提供物质基础和参考依据。蛇毒是自然界中最复杂的动物毒素,含有多种蛋白质、多肽及酶类,很多蛇毒都对补体系统有作用[2],蛇毒已成为寻找和发现新型抗补体蛋白的重要资源库。烙铁头蛇(Trimeresurus mucrosquamatus)是我国常见剧毒蛇之一,主要分布在我国南方及台湾地区,其蛇伤较为常见,临床主要表现为局部出血、肿胀、疼痛,严重时血液不凝,全身出血等[3]。至今已从烙铁头蛇毒中分离纯化出与纤溶和血小板相关的多个活性成分[4-6],但总体上对烙铁头蛇毒尚缺乏系统深入的研究。针对烙铁头蛇毒蛋白开展相关研究对于认识和揭示烙铁头蛇伤机制和临床治疗以及潜在应用价值具有重要意义。本文报道了烙铁头蛇毒中一个具有抗补体活性金属蛋白酶的分离纯化及部分性质研究。
1 材料与方法
1.1 材料 烙铁头蛇毒产自湖南省武陵山区;眼镜蛇毒因子(cobra venom factor,CVF)参照文献[7]制备;人微血管内皮细胞株HMEC由本实验室传代培养;DEAE Sephadex A-50凝胶、Sephacryl S-100凝胶、Hitrap SP HP柱(瑞典Amersham Pharmacia Biotech公司);兔抗绵羊红细胞抗体(溶血素)、乙二醇双(2-氨基乙醚)四乙酸[Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid,EGTA)]、纤维蛋白原、苯甲酰-L-精氨酸乙酯(Nα-Benzoyl-L-arginine ethyl ester hydrochloride,BAEE)、偶氮酪蛋白(azocasein,美国Sigma公司);蛋白质分子量标准(大连TaKaRa公司);人补体单一成分C3、C5(德国Calbiochem公司);P-selectin试剂盒(武汉博士德生物有限公司);BCA蛋白定量试剂盒(江苏碧云天生物技术研究所);绵羊红细胞、兔红细胞采自贵阳医学院实验动物中心;♀昆明种小鼠购自贵阳医学院实验动物中心,合格证号:SCXK(黔)2002-0001;混合人血清由本实验室健康志愿者献血制备而得;其它试剂均为进口或国产分析纯。
1.2 仪器 AKTA Prime蛋白层析系统、Gene Quant紫外分光光度计(瑞典Amersham Pharmacia Biotech公司);Spectra MAX-190连续波长酶标仪(美国MD公司);5810R冷冻离心机(德国Eppendorf公司)。
1.3 方法
1.3.1 烙铁头蛇毒抗补体蛋白的分离纯化 1.0 g烙铁头蛇粗毒干粉溶于7 ml的50 mmol·L-1Tris-HCl缓冲液(pH 8.9),2 000 r·min-1离心 10 min后取上清上样于同种缓冲液平衡好的DEAE Sephadex A-50阴离子交换层析柱(2.6 cm×90 cm),充分洗脱后进行0~0.4 mol·L-1NaCl梯度洗脱,流速为24 ml·h-1,每管收集6 ml,测定各洗脱峰抗补体活性。将活性峰冻干后溶于1 ml 10 mmol·L-1PB缓冲液(pH 7.5),上样于同种缓冲液平衡好的Sephacryl S-100凝胶柱(1.6 cm×90 cm),流速为15 ml·h-1,每管 3 ml。收集活性峰上样于 AKTA Prime 1 ml HiTrap SP HP阳离子交换层析柱,流速为1 ml·min-1,收集活性峰。SDS-PAGE检测纯度,更换缓冲液为 PBS缓冲液,BCA蛋白定量后于-80℃冻存备用。
1.3.2 分子量及等电点测定 15%SDS-PAGE测定目标蛋白在还原与非还原条件下的表观分子量,方法参照文献[8]。蛋白质分子量标准为磷酸酶b(97.2 ku)、牛血清蛋白(66.4 ku)、卵清蛋白(44.3 ku)、碳酸苷酶(29.0 ku)、胰蛋白酶抑制剂(20.1 ku)、溶菌酶(14.3 ku)。
等电聚焦测定目标蛋白变性条件下的等电点,方法参照文献[8]。
1.3.3 抗补体活性测定
1.3.3.1 经典途径溶血抑制作用测定 将样品溶液、人血清(GGVB++缓冲液1∶10稀释)各50 μl混合后于37℃预孵30 min或不预孵,加入100 μl致敏绵羊红细胞(5×1011cells·L-1,GGVB++缓冲液配制),37℃水浴孵育30 min后,加入1 ml冷生理盐水终止反应,2 000 r·min-1离心10 min,取上清于405 nm测定吸光度。
1.3.3.2 替代途径溶血抑制作用测定 样品溶液、人血清(GVB-缓冲液1∶3稀释)各50 μl混合后于37℃预孵30 min或不预孵,加入100 μl兔红细胞(1.5×1011cells·L-1,GVB-Mg-EGTA 缓冲液配制),37℃水浴孵育30 min后再加入0.5 ml冷生理盐水终止反应,2 000 r·min-1离心10 min,取上清于405 nm测定吸光度。
1.3.4 补体单一成分C3、C5酶切裂解检测 10 μl目标蛋白(5 μg)分别与 5 μl人 C3、C5蛋白(各 5 μg)于37℃水浴孵育4 h,12%SDS-PAGE检测。
1.3.5 P-selectin检测 22 μg目标蛋白与50 μl人血清(PBS缓冲液1∶10稀释)37℃预孵30 min,加至孵育24 h的以5×107cells·L-1接种于96孔板的人微血管内皮细胞(HMEC)中,培养20 min后,取细胞上清,2 000 r·min-1离心10 min,取上清液按试剂盒说明书测定P-selectin。以眼镜蛇毒因子(CVF)激活补体诱导内皮细胞释放P-selectin作为阳性对照。
1.3.6 蛋白水解酶活性检测
1.3.6.1 纤维蛋白原水解活性 参照文献[8]的方法加以改动。300 μl质量分数为0.2%纤维蛋白原溶液(600 μg,50 mol·L-1Tris-HCl,pH 7.5,0.15 mol·L-1NaCl配制)加入150 μl目标蛋白溶液(10 μg)于37℃水浴孵育1/12、1/2、1、3、6、9、12、24 h 和36 h后,12%SDS-PAGE检测。
1.3.6.2 精氨酸酯酶活性 参照文献[8]的方法。BAEE作为底物,100 μg目标蛋白加至3 ml BAEE(1 mol·L-1,67 mmol·L-1,pH 7.0 的 PB 配制)中,于37℃水浴孵育6 h后,253 nm测定吸光度。烙铁头粗毒作为阳性对照。
1.3.6.3 偶氮酪蛋白水解活性 参照文献[8]的方法。100 μg目标蛋白加入1 ml azocasein(5 g·L-1,60 mmol·L-1NaHCO3配制)于37℃水浴孵育6 h后,加入1 ml 1.16 mol·L-1高氯酸终止反应,溶液过滤后于390 nm测定吸光度。烙铁头粗毒作为阳性对照。
1.3.7 蛋白水解酶抑制作用研究 2.5 μg目标蛋白分别与 EDTA(10 mmol·L-1)、1,10-phenanthroline(10 mmol·L-1)、PMSF(10 mmol·L-1)、SBTI(0.5 g·L-1)、EGTA(50 mmol·L-1)于 37℃水浴孵育 1 h,以及与 EGTA(10 mmol·L-1)预孵 1、2、3 h,再加入质量分数为0.2%的纤维蛋白原溶液于37℃水浴孵育1 h,12%SDS-PAGE检测。
1.3.8 水肿活性检测 参照文献[9]的方法加以改动。♀昆明种小鼠(体质量约18~20 g,n=6),右、左后足分别注射0.1 μg·g-1目标蛋白和等体积PBS缓冲液,1 h后处死,于相同位置剪下左、右后足,称重后计算肿胀率/%=[(右足重量-左足重量)/左足重量]×100%。
1.3.9 出血毒活性检测 参照文献[10]的方法加以改动。♀昆明种小鼠(体质量约18~20 g,n=6)背部皮下注射2.5 μg·g-1目标蛋白,24 h处死小鼠后剥皮检测。烙铁头粗毒作为阳性对照。
2 结果
2.1 TMAC-1的分离纯化 烙铁头蛇毒经DEAE Sephadex A-50阴离子交换层析得到14个蛋白洗脱峰,其中45~65管和250~260管具有抗补体活性(Fig 1A);收集45~65管活性峰冻干并溶解后上样至Sephacryl S-100凝胶层析,洗脱峰30~36管和46~56管具有抗补体活性(Fig 1B);收集30~36管活性峰上样至HiTrap SP HP阳离子交换柱,第1个离子峰具有抗补体活性(Fig 1C),收集即得目标蛋白,命名为TMAC-1。

Fig 1 The purification of TMAC-1
2.2 理化性质 15%SDS-PAGE检测表明,TMAC-1在还原条件下分子量约为25 ku,非还原条件下分子量约为24 ku(Fig 2A)。等电聚焦电泳显示TMAC-1等电点为9.0(Fig 2B)。
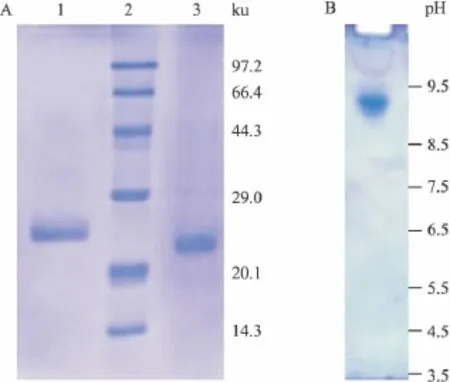
Fig 2 Electrophoresis of TMAC-1
2.3 抗补体活性测定 TMAC-1在预孵和不预孵条件下均能抑制补体经典途径和替代途径的溶血,并呈现剂量依赖性(Fig 3)。在预孵条件下,对经典途径和替代途径溶血的IC50分别为62、29 mg·L-1;不预孵条件下,其 IC50分别为263、246 mg·L-1。
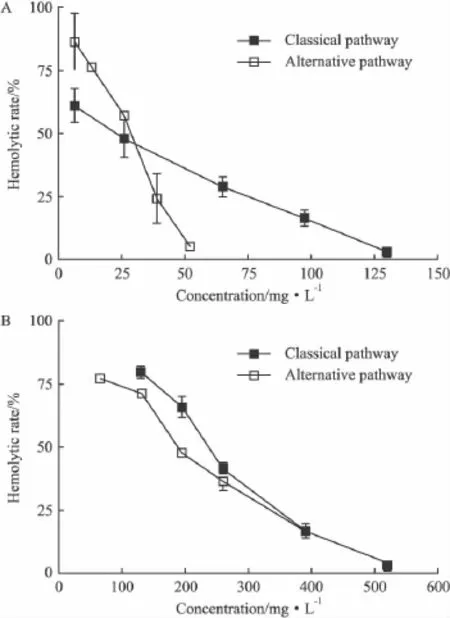
Fig 3 Inhibitory effect of TMAC-1 on complement hemolysisA and B:Represented the inhibitory effect of TMAC-1 on the classical pathway and the alternative pathway of complement with preincubation or without preincubation,respectively
2.4 补体单一成分C3、C5裂解作用 TMAC-1对C3、C5有裂解作用(Fig 4)。在还原电泳条件下,经5 μg TMAC-1作用4 h后,可见C3的α链被降解,β链未见明显降解,而C5的α链和β链被完全降解。

Fig 4 Digest of C3 and C5 by TMAC-1
2.5 P-selectin测定 TMAC-1与人血清充分孵育的混合物不能诱导人微血管内皮细胞释放P-selectin(Fig 5)。
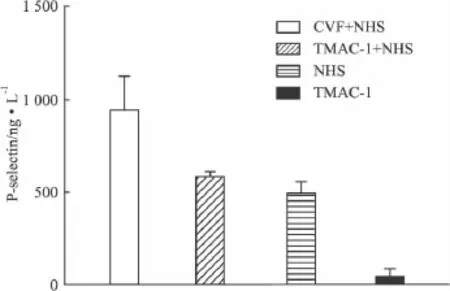
Fig 5 Effect of TMAC-1 on reducing HMEC to release P-selectinThe difference between(TMAC-1+NHS)and NHS is not significant on statistics
2.6 蛋白水解酶活性及抑制剂对蛋白水解酶活性的影响
2.6.1 纤维蛋白原水解活性 TMAC-1能够降解纤维蛋白原(Fig 6A)。10 μg样品与600 μg纤维蛋白原作用结果显示TMAC-1在36 h内能够依次降解纤维蛋白原的Aα链、Bβ链、和γ链。
2.6.2 抑制剂对纤维蛋白原水解活性的影响TMAC-1对纤维蛋白原水解作用能被EDTA(10 mmol·L-1)、1,10-phenanthroline(10 mmol·L-1)、EGTA(50 mmol·L-1)完全抑制,不受 PMSF(10 mmol·L-1)、SBTI(0.5 g·L-1)的抑制(Fig 6B)。

Fig 6 Fibrinogenolytic activity of TMAC-1
2.6.3 其他蛋白水解酶活性 TMAC-1无BAEE水解活性,具有微弱的偶氮酪蛋白水解活性。
2.7 水肿活性 0.1 μg·g-1TMAC-1诱导的小鼠足跖肿胀率为(36.7±3.7)%,见Fig 7。

Fig 7 Effect of TMAC-1 on inducing edema 1:PBS;2:TMAC-1
2.8 出血毒活性 2.5 μg·g-1TMAC-1注射小鼠皮下,24 h后未发现出血毒性。
3 讨论
本实验经过DEAE Sephadex A-50阴离子交换层析、Sephacryl S-100分子筛、Hitrap SP HP阳离子交换层析从湖南产烙铁头蛇毒中分离纯化出一个分子量为25 ku、等电点为9.0的抗补体蛋白TMAC-1。该蛋白不具有出血毒活性,具有水肿活性,能够依次降解纤维蛋白原的Aα、Bβ、γ链,该活性能够被金属蛋白酶抑制剂完全抑制,不受丝氨酸蛋白酶抑制剂的影响,同时TMAC-1不具有精氨酸酯酶活性,上述结果提示TMAC-1是一个非出血性的金属蛋白酶。
目前为止,已从各类蛇毒中分离纯化出很多金属蛋白酶,根据结构域的不同将金属蛋白酶分为4类:仅含金属蛋白酶结构域的P-Ⅰ型;含有金属蛋白酶和disintegrin结构域或disintegrin-like结构域的P-Ⅱ型;含有金属蛋白酶结构域、disintegrin-like结构域和富含Cys结构域的P-Ⅲ型;以及包含金属蛋白酶结构域、distintergrin-like结构域、Cys结构域和C-型凝集素结构域的 P-Ⅳ型[11]。P-Ⅰ型金属蛋白酶分子质量约为20~30 ku,根据分子质量我们推测TMAC-1可能是一个只含有金属蛋白酶结构域的P-Ⅰ型金属蛋白酶。
目前已报道的烙铁头蛇毒中有多种活性成分[3-6],其中从台湾产烙铁头中分离纯化有TM-1、TM-2和 TM-3等金属蛋白酶[3],分子质量均在24 ku左右,它们能够裂解纤维蛋白原的Aα和Bβ链。本实验从湖南产烙铁头蛇毒中分离纯化出的金属蛋白酶TMAC-1,能够依次降解Aα链、Bβ链和γ链,这在金属蛋白酶中是较为少见的。并且该活性在EGTA终浓度为10 mmol·L-1时或延长预孵时间至3 h也不能被完全抑制,但当EGTA浓度增大后该活性能被完全抑制,但这一现象具体原因还需进一步深入研究。
目前已发现了多个作用于补体的蛋白酶,如从Crotalus molossus molossus蛇毒中分离纯化出的抑制豚鼠补体的金属蛋白酶 M5[12],Naja oxiana眼镜蛇毒中抑制经典途径C3转化酶形成的金属蛋白酶oxiagin[13],以及从 Trimeramaturus flavoviridis蛇毒中分离出异源性的 C3/C5转化酶 flavoxobin[14],它是一种丝氨酸蛋白酶,通过直接酶切补体C3、C5成分来激活补体替代途径并生成活性片段。本工作从湖南产烙铁头蛇毒中分离纯化出具有抗补体作用的金属蛋白酶TMAC-1,对补体的经典途径和替代途径的溶血均有抑制作用。SDS-PAGE结果显示,TMAC-1能够裂解C3、C5,但与血清孵育产物不能刺激HMEC释放P-selectin,从而推测TMAC-1是通过抑制补体而不是激活补体来发挥抗补体作用。又因TMAC-1对补体替代途径溶血的抑制作用较对经典途径的强,故而我们推测,TMAC-1可能还有其他更重要的靶标成分,如替代某些特有的补体成分:B因子、D因子等,从而抑制补体激活,但其确切的抗补体作用机制还需进一步研究探讨。
烙铁头蛇咬伤一般表现为肿胀、出血、疼痛等,其中的炎症反应主要是由于毒液中的金属蛋白酶引起的。蛇毒金属蛋白酶可通过金属蛋白酶结构域或去整合素结构域破坏细胞外基质,或者诱导内皮细胞释放促炎症因子或黏附分子,从而参与炎症的发生发展[11,15]。抗补体作用研究显示 TMAC-1能够裂解C3、C5,但TMAC-1本身或其酶切补体的产物都不能诱导内皮细胞释放P-selectin,表明其酶切补体并不能产生生理活性片段,这将有利于TMAC-1在抑制补体上的应用。而TMAC-1能够诱导小鼠足跖肿胀,这可能是与其酶切补体成分无关,而是由其自身的作用导致的。
本文从烙铁头蛇毒中分离纯化出一个具有抗补体活性的金属蛋白酶TMAC-1,通过酶切补体特定成分而抑制补体激活。TMAC-1能够依次降解纤维蛋白原的Aα链、Bβ链和γ链,能诱导水肿,但不具有出血毒活性。本工作将有助于加深对烙铁头蛇毒蛋白及蛇伤机制的认识,有助于烙铁头蛇伤的治疗,但其酶切补体的生物学意义以及潜在的应用价值,还需进一步研究。
[1]Zipfel P F,Skerka C.Complement regulators and inhibitory proteins[J].Nat Rev Immunol,2009,9(10):729-40.
[2]Eggertsen G,Fohlman J,Sjöquist J.In vitro studies on complement inactivation by snake venom[J].Toxicon,1980,18(1):87-96.
[3]Huang K F,Hung C C,Pan F M,et al.Characterization of multiple metalloproteinases with fibrinogenolytic acticity from the venom of Taiwan Habu(Trimeresurus mucrosquamatus):protein microsequencing coupled with cDNA sequence analysis[J].Biochem Biophys Res Commun,1995,216(1):223-33.
[4]Hung C C,Chiou S H.Fibrinogenolytic proteases isolated from the snake venom of Taiwan Habu:serine proteases with kallikrein-like and angiotensin-degrading activities[J].Biochem Biophys Res Commun,2001,281(4):1012-8.
[5]Wei Q,Lu Q M,Jin Y,et al.Purification and cloning of a novel C-type lectin-like protein with platelet aggregation activity from Trimeresurus mucrosquamatus venom[J].Toxicon,2002,40(9):1331-8.
[6]Wei J F,Wei Q,Lu Q M,et al.Purification,characterization and biological activity of an L-amino oxidase from Trimeresurus mucrosquamatus venom[J].Acta Biochim Biophys Sin,2003,35(3):219-24.
[7]Sun Q Y,Chen G,Guo H,et al.Prolonged cardiac xenograft survival in guinea pig-to-rat model by a highly active cobra venom factor[J].Toxicon,2003,42(3):257-62.
[8]Sun Q Y,Li M,Yang F M.Purification and characterization of a metalloproteinase with weak fibrinogenolytic activity from Naja atra venom[J].Chin J Biochem Mol Biol,2007,23(10):835-43.
[9]Gutiérrez J M,Romero M,Díaz C,et al.Isolation and characterization of a metalloproteinase with weak hemorrhagic activity from the cenom of the snake Bothrops asper(terciopelo)[J].Toxicon,1995,33(1):19-29.
[10]Ownby C L,Bjarnason J,Tu A T.Hemorrhagic toxins from rattlesnake(Crotalus atrox)venom.Pathogenesis of hemorrhage induced by three purified toxins[J].Am J Pathol,1978,93(1):201-18.
[11]Fox J W,Serrano S M.Structural considerations of the snake venom metalloproteinases,key members of the M12 reprolysin family of metalloproteinases[J].Toxicon,2005,45(8):969-85.
[12]Chen T,Real E D.Purification of M5,a fibrinolytic proteinase from Crotalus mollosus molusus venom that attacks complement[J].Int J Biochem Cell Biol,1997,29(5):789-99.
[13]Shoibonov B B,Osipov A V,Kryukova E V,et al.Oxiagin from the Naja oxiana cobra venom is the first reprolysin inhibiting the classical patheway of complement[J].Mol Immunol,2005,42(10):1141-53.
[14]Yamamoto C,Tsuru D,Oda-Usda N,et al.Flavoxobin,a serine protease from Trimeresurus flavoviridis(habu snake)venom,independently cleaves Arg726-Ser727 of human C3 and acts a novel,hererologous C3 convertase[J].Immunology,2002,107(1):111-7.
[15]叶巧玲,孙黔云,李 敏.眼镜蛇毒金属蛋白酶atrase A诱导人内皮细胞释放炎症介质及凋亡[J].中国药理学通报,2009,25(8):1001-6.
[15]Ye Q L,Sun Q Y,Li M.Inflammatory mediators releasing and apotosis of endothelial cell induced by cobra venom metalloproteinase atrase A[J].Chin Pharmacol Bull,2009,25(8):1001-6.
