丹酚酸C诱导肝癌HepG2细胞有丝分裂阻滞及凋亡的研究
2010-11-29程金建
杨 华,程金建,梁 钢
丹参是治疗心脑血管疾病的常用中药之一,有着悠久的临床应用历史。其水溶性有效成分主要是多种酚酸类化合物,包括丹酚酸A、B、C、D等。目前对丹参水溶性成分的研究取得了一定成就,发现丹酚酸类化合物具有多方面的药理作用[1-2]。遗憾的是,大部分研究都集中于总丹酚酸、丹酚酸A、丹酚酸B等化学成分,而对其它有效单体的研究较少。从化学结构来看,丹酚酸既有咖啡酰缩酚酸结构又有新木脂素骨架。新木脂素是一类广泛存在于多种高等植物的天然产物,具有广泛的药理活性,包括抗肿瘤、抗氧化、抗炎及免疫调节、镇痛以及心血管方面的活性[3-4],其中抗肿瘤活性一直是新木脂素药理作用研究的热点,小檗科鬼臼属植物中的鬼臼毒素类木脂素及其半合成衍生物VP-16(etoposide)和VM-26(teniposide)已开发成为抗肿瘤药物应用于临床[5]。丹参水溶性成分中的丹酚酸 C(salvianolic acid C,Sal C)是具有2-芳基苯并呋喃结构的新木脂素,研究显示,许多天然或合成的苯并呋喃类新木脂素化合物具有良好的抗肿瘤活性。从中药花椒中提取到的2-芳基苯并呋喃化合物ailanthoidol,对乳腺癌细胞 MCF-7有抗增殖作用[6],云南拟单性木兰中分离得到的3个苯并呋喃类木脂素,对人肿瘤细胞株HCT-8、SIHa及GLC-82具有明显的生长抑制作用[7]。Pieters等[8]合成了一系列苯并呋喃类化合物,体外实验表明,这些化合物对60种人肿瘤细胞均有不同程度的细胞毒作用。另有研究报道[9],合成的一系列苯并呋喃类化合物具有明显的抑制肿瘤血管生成作用。本研究旨在检测丹酚酸C对人肿瘤细胞的增殖抑制作用以及对HepG2细胞周期和凋亡的影响,并探索相关的机制。
1 材料与方法
1.1 药物与试剂 丹酚酸C购自上海沪云医药开发有限公司,为黄色粉末,纯度 >98%,用生理盐水溶解。秋水仙碱为Calbiochem公司产品,微管蛋白聚合活性检测试剂购自Cytoskeleton公司,Caspase活性检测试剂盒为南京凯基生物科技发展有限公司产品。
1.2 细胞培养与实验分组 人肝癌细胞株HepG2、人宫颈癌细胞株HeLa、人结肠癌细胞株HT29、人肺癌细胞株A549、人鼻咽癌细胞株CNE2和人白血病细胞株HL-60均用含体积分数0.10小牛血清的RPMI 1640培养液置37℃、5%CO2孵育箱培养。实验均在细胞对数生长期进行,分别设溶剂对照(Control)组和 5、10、20 μmol·L-1丹酚酸 C 组。
1.3 方法
1.3.1 MTT法检测丹酚酸C的抗增殖作用 取对数生长期细胞接种于96孔板,贴壁后加入不同浓度的丹酚酸C,每个浓度设4个平行孔,培养72 h后加入MTT溶液,继续培养4 h,弃去培养液,加入150 μl二甲基亚砜,振荡10 min,用酶标仪测定570/630 nm双波长吸光度(A)值,以Bliss法计算半数抑制浓度(IC50)。
1.3.2 流式细胞术检测细胞周期及细胞凋亡 分别收集不同时间、不同浓度丹酚酸C处理的HepG2细胞,PBS洗涤两次,用体积分数为0.70的乙醇固定过夜。弃去乙醇,再次悬浮细胞于PBS,溴化丙啶染色5 min,4℃避光30 min。在流式细胞仪上检测细胞DNA含量,得出细胞分布图以及凋亡细胞所占比例。LYSIS软件分析。
1.3.3 Giemsa染色观察有丝分裂阻滞 丹酚酸C处理HepG2细胞24 h后,离心收集细胞,加入细胞固定液固定,滴片于载玻片上,晾干后将载玻片置于Giemsa染液中浸染,显微镜下观察。处于有丝分裂期(M期)的细胞核膜消失,染色质松散分布于胞质。随机计数200个细胞,计算M期细胞所占的比例,即有丝分裂指数(MD)。
1.3.4 微管蛋白聚合活性测定 按试剂说明用General Tubulin Buffer溶解微管蛋白粉末并置冰浴,微管蛋白溶液分为溶剂对照组、不同剂量丹酚酸C组和秋水仙素阳性对照组,分别加入相应药物后,混合溶液加入冰浴的比色杯中,紫外分光光度计340 nm下调零;随后将比色杯置37℃恒温水浴保温,每5 min测定一次吸光度(A)值,直到40~45 min A值无明显上升时止;以时间(min)为横坐标,A值(A340nm)为纵坐标,绘制各组微管蛋白聚合曲线,取各组在45 min时的A值,计算药物对微管蛋白聚合的抑制率:抑制率/%=(A对照-A加药)/A对照×100%。
1.3.5 Caspase-3和 Caspase-6活性检测 按Caspase活性检测试剂盒说明,收集不同浓度丹酚酸C处理的HepG2细胞5×106个,加入Lysis Buffer冰上裂解20 min,离心收集上清,加入反应缓冲液和Caspase底物(Caspase-3底物为 DEVD-pNA,Caspase-6底物为IEVD-pNA),37℃避光孵育4 h,酶标仪测定405 nm波长处的吸光度值(A405nm)。
1.4 统计学分析 采用SPSS12.0统计软件进行统计学处理,数据以±s表示。细胞周期分析、有丝分裂指数测定和Caspase活性检测的实验组和对照组均采用非参数Kruskal-Wallis检验,微管蛋白聚合活性检测实验组和对照组采用Friedman秩和检验。实验结果至少重复3次。
2 结果
2.1 丹酚酸C体外抗肿瘤细胞增殖作用 丹酚酸C对HepG2等细胞的生长抑制作用结果见Tab 1。由表可知,肝癌细胞HepG2对丹酚酸C比较敏感,鼻咽癌细胞CNE2和白血病细胞HL-60对丹酚酸C的敏感性相对较差。
Tab 1 Inhibitory effect of Sal C on the proliferation of human tumor cell lines(±s,n=6)

Tab 1 Inhibitory effect of Sal C on the proliferation of human tumor cell lines(±s,n=6)
Cell type Cell line IC50/μmol·L -1 Hepatocellular cancer HepG2 22.6 ±1.3 Cervical cancer HeLa 26.8 ±1.7 Colorectal cancer HT29 29.3 ±1.9 Lung cancer A549 36.2 ±2.6 Nasopharyngeal cancer CNE2 44.7 ±2.2 Leukemia HL-60 57.3 ±2.8
2.2 丹酚酸C对HepG2细胞周期分布和凋亡的影响 流式细胞仪分析显示,不同剂量的丹酚酸C分别作用HepG2细胞24 h后,细胞出现不同程度的G2/M期阻滞(P<0.05):对照组细胞G2/M期比例为 0.160 ± 0.031,5、10、20 μmol·L-1丹酚酸 C 组G2/M期细胞比例分别为0.253±0.028、0.388±0.032、0.440 ±0.053,见 Fig 1;细胞凋亡率呈剂量依赖性和时间依赖性上升,见Tab 2。

Fig 1 Effect of Sal C on cell cycle distribution of HepG2 cellsA:Control;B,C and D:5,10 and 20 μmol·L -1Sal C group
Tab 2 Induction of apoptosis by Sal C in HepG2 cells( ± s,n=4)

Tab 2 Induction of apoptosis by Sal C in HepG2 cells( ± s,n=4)
*P<0.05 vs control
C/μmol·L -1Apoptotic cells/%24 h 48 h 72 h Control 0.5 ±0.1 2.9 ±0.8 4.9 ±1.3 5 7.2 ±1.2* 23.8 ±2.5* 47.4 ±6.3*10 8.2 ±1.8* 39.6 ±5.6* 56.9 ±7.1*20 15.1 ±1.9* 44.0 ±6.1* 58.6 ±7.7*
2.3 丹酚酸C诱导细胞有丝分裂阻滞 Giemsa染色结果显示,不同剂量丹酚酸C分别处理HepG2细胞24 h后,细胞呈现不同程度的有丝分裂阻滞。处于有丝分裂期(M期)的细胞核膜消失,染色体深染且松散分布于胞质中(Fig 2 B,C,D),间期细胞核膜完整,胞核呈圆形或椭圆形,染色均匀(Fig 2 A)。随机计数200个细胞,计算其中有丝分裂期细胞所占的比例即有丝分裂指数(MD),对照组的有丝分裂指数为0.032 ±0.008,5、10、20 μmol·L-1丹酚酸C组的有丝分裂指数分别为0.108±0.017、0.337±0.021、0.263±0.015,丹酚酸C使有丝分裂指数明显提高(P<0.05)。

Fig 2 Mitotic blockade by Sal C in HepG2 cells(×300)A:Control cells;B,C and D:5,10 and 20 μmol·L -1Sal C-treated cells
2.4 丹酚酸C对微管蛋白聚合活性的影响 微管蛋白溶液在0~4℃是无色透明溶液,在37℃保温时,微管蛋白逐渐聚合成微管,溶液在340 nm的吸光度(A值)逐渐上升,并在一定时间内达到坪值。根据测得的A值对保温时间作图,可以绘制出特征性的“S”型聚合曲线。干扰微管蛋白聚合的药物可以使曲线形态发生改变,曲线坪值也随之发生变化。实验结果显示,随着37℃保温时间的延长,溶剂对照组A值经过短暂的潜伏期(5 min)后开始逐渐升高,在45 min时基本达到坪值;阳性对照秋水仙素组A值在整个保温过程中有轻微上升,其曲线坪值明显低于对照组(P<0.05),对微管蛋白聚合的抑制率为 0.656;5、10、20 μmol·L-1丹酚酸 C 组的曲线坪值与对照组比较有不同程度的降低(P<0.05),对微管蛋白聚合的抑制率分别为0.259、0.567 和0.600,见 Fig 3。
2.5 丹酚酸 C对 HepG2细胞 Caspase-3和Caspase-6活性的影响 不同剂量丹酚酸C分别处理 HepG2细胞 48 h后,细胞中 Caspase-3和Caspase-6的活性均明显升高,与对照组比较差异具有显著性(P < 0.05)。5、10、20 μmol·L-1用药组Caspase-3活性分别是对照组的4.1倍、5.2倍、5.6倍,Caspase-6活性分别是对照组的3.0倍、3.8倍、4.1倍,见 Fig 4。
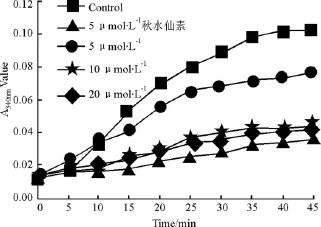
Fig 3 Inhibitory effect of Sal C on tubulin polymerization

Fig 4 Increased activities of Caspase-3 and Caspase-6 in HepG2 cells treated with Sal C±s,n=4)*P<0.05 vs control
3 讨论
中药的活性成分结构新颖,安全性高,不良反应少,从中药中开发新的抗肿瘤药物具有极大的潜力。许多研究表明,丹参水溶性成分具有抗肿瘤作用,Liu等[10]报道,丹参的水溶性提取物能明显抑制人肝癌细胞株HepG2的增殖并引起细胞形态的改变,最终导致细胞凋亡;沈云婕 等[11]发现,注射用丹参多酚酸盐可抑制人肺腺癌SPC-A-1细胞、人肝癌SMMC-7721细胞、B淋巴瘤Raji细胞和白血病HL-60细胞的生长并诱导凋亡。上述报道多以丹参水溶性成分的混合物为研究对象,本研究发现丹参水溶性单体成分丹酚酸C对人肝癌HepG2细胞有较明显的增殖抑制作用,这与上述研究报道具有互补性。
流式细胞仪分析显示,丹酚酸C作用细胞24 h即可诱导明显的G2/M期阻滞。由于流式细胞仪不能区分处于G2期和M期的细胞,故进行Giemsa染色观察细胞的有丝分裂情况,正常情况下,细胞的有丝分裂指数为0.03~0.05,而丹酚酸C使HepG2细胞的有丝分裂指数升高至0.337,提示发生有丝分裂阻滞。在有丝分裂期(M期),为了保证遗传物质平均分配到两个子代细胞,姐妹染色单体的着丝点必须与纺锤体两极发出的纺锤体微管相结合,才能实现染色单体的分离。纺锤体在细胞进入M期时由胞质中的微管蛋白聚合而成,若纺锤体装置出现异常,姐妹染色单体就不能正确分离和移动,从而发生M期阻滞[12]。作用于微管蛋白的化合物能够引起M期纺锤体微管结构损伤,使细胞阻滞于M期,这类化合物已作为抗肿瘤药物成功应用于临床,并取得了良好的治疗效果,如长春碱类和紫杉醇类抗肿瘤药[13]。本研究中,丹酚酸C能够抑制微管蛋白聚合,其抑制作用与已知的微管蛋白抑制剂秋水仙素类似,推测丹酚酸C诱导M期阻滞的机制可能与其抑制微管蛋白聚合有关。
药物通过损伤纺锤体微管结构而使细胞阻滞于M期,若损伤无法修复,就会引起细胞凋亡。目前已知几乎所有的抗肿瘤药都是通过诱导细胞凋亡清除肿瘤细胞的。在细胞凋亡过程中,Caspase家族成员发挥重要作用,其中下游Caspase(如Caspase-3,6和7等)活化后直接对凋亡细胞中的重要底物进行剪切,使细胞解体[14]。本研究结果显示,随着丹酚酸C作用时间的延长,细胞凋亡率增加,同时细胞中Caspase-3和Caspase-6的活性明显升高,可能是药物不可逆地抑制微管蛋白聚合,细胞周期阻滞无法进行,通过一系列信号传导途径使Caspase活化,从而引起细胞凋亡。
综上所述,丹参水溶性成分丹酚酸C具有抑制肿瘤细胞增殖的作用,并且可能通过抑制微管蛋白聚合、诱导肿瘤细胞凋亡来发挥抗肿瘤作用。作为治疗心脑血管疾病的常用药,丹参水溶性成分的安全性和稳定性得到了积极评价,因此,作为丹参水溶性单体成分,丹酚酸C的抗肿瘤作用值得进行深入研究。
[1]杜冠华,张均田.丹参现代研究概况与进展(续一)[J].医药导报,2004,23(6):355-60.
[1]Du G H,Zhang J T.The general situation and progress of the modern research of red sage root(Radix Salviae miltiorrhizae)[J].Herald Med,2004,23(6):355-60.
[2]范焕琼,崔 燎.丹酚酸B对体外培养新生大鼠颅骨成骨细胞的影响[J].中国药理学通报,2008,24(7):978-9.
[2]Fan H Q,Cui L.Effects of salvianolic acid B on osteoblast in vitro[J].Chin Pharmacol Bull,2008,24(7):978 -9.
[3]Saleem M,Kim H J,Ali M S,Lee Y S.An update on bioactive plant lignans[J].Nat Prod Rep,2005,22(6):696 -716.
[4]王希斌,刘华钢,杨 斌,等.两面针中木脂素化合物结晶-8对致痛大鼠脑内β-内啡肽表达的影响[J].中国药理学通报,2009,25(9):1256-7.
[4]Wang X B,Liu H G,Yang B,et al.Effect of crystal-8 from Zanthoxylum nitidum(Roxb.)DC.on the expression of β-endorphine in the brain of painful rats[J].Chin Pharmacol Bull,2009,25(9):1256-7.
[5]郑晓亮,刘雪莉,钱伯初.植物提取物诱导肿瘤细胞凋亡机制研究进展[J].中国药理学通报,2004,20(11):1201-5.
[5]Zheng X L,Liu X L,Qian B C.Progress in tumor cell apoptosis induced by plant extracts[J].Chin Pharmacol Bull,2004,20(11):1201-5.
[6]Fokialakis N,Magiatis P,Mitaku S,et al.Estrogenic activity of phenylpropanoids from sarcomelicope megistophylla and structure determination of a new norneolignan[J].Planta Med,2003,69(6):566-8.
[7]程永现,周 俊,谭宁华.云南拟单性木兰的化学成分[J].云南植物研究,2001,23(3):352-6.
[7]Cheng Y X,Zhou J,Tan N H.The chemical constituents of parakmeria yunnanensis[J].Acta Botan Yunnan,2001,23(3):352-6.
[8]Pieters L,Dyck S V,Gao M,et al.Synthesis and biological evaluation of dihydrobenzofuran lignans and related compounds as potential antitumor agents that inhibit tubulin polymerization[J].J Med Chem,1999,42(26):5475-81.
[9]Apers S,Paper D,Burgermeister J,et al.Antiangiogenic activity of synthetic dihydrobenzofuran lignans[J].J Nat Prod,2002,65(5):718-20.
[10]Liu J,Shen H M,Ong C N.Salvia miltiorrhiza inhibits cell growth and induces apoptosis in human hepatoma HepG2 cells[J].Cancer Lett,2000,153(1-2):85 -93.
[11]沈云婕,王松梅,朱 珺,潘銮凤.丹参多酚酸盐体外抗肿瘤作用研究[J].中国药房,2008,19(30):2332-5.
[11]Shen Y J,Wang S M,Zhu J,Pan L F.Anti-tumor activity and its mechanism of depsides salts from Salvia miltiorrhiza in vitro[J].China Pharmacy,2008,19(30):2332 -5.
[12]Rieder C L,Salmon E D.The vertebrate cell kinetochore and its roles during mitosis[J].Trends Cell Biol,1998,8(8):310 -8.
[13]李 燕,王永华,房 华,等.紫杉醇类衍生物的定量结构-抗癌活性关系研究进展[J].中国药理学通报,2008,24(3):288-93.
[13]Li Y,Wang Y H,Fang H,et al.Research progress in the quantitative structure-antitumor activity relationship studies of taxol derivatives[J].Chin Pharmacol Bull,2008,24(3):288 -93.
[14]张嘉杰,王广发,吴曙光.抗肿瘤药物与miRNA靶点相互作用研究进展[J].中国药理学通报,2008,24(11):1409-11.
[14]Zhang J J,Wang G F,Wu S G.Interactions of anticancer drugs and miRNA targets[J].Chin Pharmacol Bull,2008,24(11):1409-11.
