姜黄素对Saos-2细胞增殖和凋亡的影响
2010-11-29吴燕峰梁新军夏仁云沈慧勇
吴燕峰,梁新军,郭 宇,夏 侃,夏仁云,沈慧勇
骨肉瘤是最常见的骨的原发性恶性肿瘤,好发于青少年,对化疗和放疗等传统治疗方法敏感性低,预后较差,易复发和转移,5年生存率低[1]。为此,发现并建立新的、有效的骨肉瘤的防治措施势在必行。
姜黄素(Curcuma)是一种从植物根茎中提取的多酚类化合物,主要具有抗氧化、抗炎及抗肿瘤等多种生物学功能[2]。近年来,国内外研究表明[3-5],姜黄素在体外对多种肿瘤细胞的生长具有抑制作用,但其机制尚不十分明确。本实验探讨了姜黄素对人骨肉瘤Saos-2细胞的增殖抑制和诱导凋亡的影响并检测了其对凋亡相关基因Fas表达的调控,为进一步明确姜黄素的抗肿瘤机制提供理论依据。
1 材料与方法
1.1 药品与试剂 DMEM培养基、新鲜小牛血清为Gibco公司产品;姜黄素购自美国 Sigma公司,用DMSO溶解配制成0.01 mol·L-1的储存液分装备用,使用时用无血清DMEM培养基稀释到所需浓度,DMSO的含量小于0.1%;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、胰酶均为美国Sigma公司产品;Fas兔抗人多克隆抗体为美国Santa Cruz公司产品。
1.2 细胞培养 人骨肉瘤细胞系Saos-2培养于含10%新鲜小牛血清的DMEM培养基中,置于37℃,5%CO2饱和湿度的培养箱中培养,细胞呈贴壁生长。
1.3 MTT实验 取对数生长期的Saos-2细胞,用含10%小牛血清的DMEM培养液配成单个细胞悬液,以每孔1×104接种于96孔培养板。培养板置于37℃,5%CO2饱和湿度的培养箱内培育,使细胞增殖至铺满每孔底部。实验分空白对照组和姜黄素作用组(5、10、20、40 μmol·L-1),每组设 3 个复孔。分别在 37℃、5%CO2培养箱中培养 24、48、72 h后,每孔加入20 μl MTT(5 g·L-1),继续在 37℃、5%CO2培养箱中培养4 h。吸尽上清,再加入DMSO 150 μl,振荡10 min,使其充分溶解,在96 孔酶标仪上测定波长490 nm的吸光度(A),计算细胞生长抑制率。计算公式为:细胞生长抑制率/%=(比色对照组吸光度平均值-实验组吸光度平均值)/比色对照组吸光度平均值×100%。
1.4 流式细胞仪检测细胞凋亡 选取对数生长期的Saos-2细胞分别接种于6孔板中,分组同上,每组作用48 h,各组重复3次。胰酶消化,收集1×106细胞,1 000 r·min-1离心5 min,弃上清。用70%乙醇1 ml固定。离心,弃上清。PBS洗2遍。加入适量Annexin V-FITC和PI,避光染色0.5 h。上机检测,分析 5 ~40 μmol·L-1细胞凋亡率。
1.5 Hoechst 33258检测细胞凋亡 选取对数生长期的Saos-2细胞接种于6孔板,行细胞爬片,采用经MTT和流式检测作用最明显的20 μmol·L-1姜黄素作用,含等体积DMSO的DMEM培养基作为对照。收集作用后48 h的细胞,PBS洗2次,用75%的乙醇4℃固定5 min,PBS冲洗,Hoechst 33258染色10 min后置于荧光显微镜下观察。
1.6 Western blot分析细胞Fas蛋白表达的变化收集不同浓度姜黄素作用48 h后的Saos-2细胞约1×107,提取其胞质蛋白;取50 μg蛋白质样品进行SDS-PAGE电泳,并转至硝酸纤维膜上,5%封闭液室温封闭2~4 h后,用含0.05%Tween-20的TBS缓冲液(TBST)漂洗3次,每次10 min,加入相应的兔抗人Fas多克隆抗体(1∶1 000),4℃孵育过夜,TBST漂洗3次,每次10 min,再加入相应的辣根过氧化物标记的二抗(1∶500),37℃摇床温育2 h,增强化学发光显色系统显色,重复实验3次。
2 结果
2.1 姜黄素对骨肉瘤细胞的增殖抑制作用 不同浓度姜黄素对Saos-2细胞的生长有不同程度的抑制,浓度越高,作用时间越长,抑制作用越明显,光学显微镜下,姜黄素作用后的Saos-2细胞出现皱缩、变圆、脱落;部分细胞体积缩小,贴壁细胞数量减少。当姜黄素浓度为20 μmol·L-1时抑制作用明显增强,与对照组相比,差异有显著性(P<0.05)。见Fig 1。

Fig 1 The proliferation inhibition of Saos-2 cells induced by curcumaThe inhibition rate rised significantly when the concentration of curcuma was over 20 μmol·L-1,*P <0.05 vs control
2.2 姜黄素诱导骨肉瘤细胞凋亡 Annexin V/PI双染检测可区分坏死与凋亡的细胞,本实验我们使用此方法检测显示不同浓度姜黄素可以诱导Saos-2细胞凋亡。当姜黄素浓度为20 μmol·L-1时,细胞凋亡率明显升高(P <0.05),浓度为 40 μmol·L-1时,凋亡率与control组比较明显升高,但与姜黄素20μmol·L-1组比较差异无显著性(P >0.05)。见Fig 2。

Fig 2 The apoptosis of human osteosarcoma cells Saos-2 induced by curcuma was detected by flow cytometryThe effect rised significantly when the concentration of curcuma was over 20 μmol·L -1.*P <0.05 vs control
2.3 Hoechst 33258荧光染色法观察细胞形态学改变 荧光显微镜观察,发现20 μmol·L-1姜黄素作用后,Saos-2细胞胞核出现核固缩、碎裂,产生凋亡小体,如Fig 3所示。
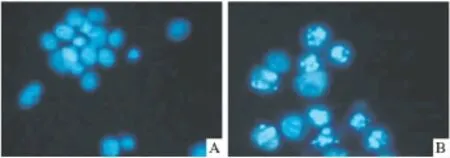
Fig 3 The morphological alteration after treated with curcuma was confirmed by Hoechst 33258 stainingA:Control;B:Treated with 20 μmol·L -1curcuma
2.4 姜黄素对骨肉瘤细胞Fas蛋白表达的影响Western blot检测姜黄素作用前后骨肉瘤细胞Fas蛋白表达变化,显示Fas在人骨肉瘤细胞中呈低表达,姜黄素处理细胞48 h后,骨肉瘤细胞的Fas蛋白表达强度较前增高,且其作用随姜黄素浓度增高而明显(Fig 4)。

Fig 4 The protein expression of Fas after treated with curcuma
3 讨论
骨肉瘤为最常见的严重危害青少年健康的恶性肿瘤之一。尽管近年来临床治疗取得了很大进展,但死亡率和致残率仍然很高。如何延缓其生长及转移,进一步提高其治疗效果仍是骨肉瘤治疗的难题之一[6]。寻找具有高抗肿瘤活性的新型药物是目前骨肉瘤的研究热点之一。
姜黄素是一种多酚类物质,近年来研究发现姜黄素具有潜在的抗肿瘤作用而得到广泛的关注。目前认为姜黄素主要通过(1)抑制肿瘤血管生成;(2)上调caspases蛋白酶诱导凋亡;(3)抑制核转录因子的表达;(4)诱导细胞周期阻滞;(5)调节凋亡抑制基因的表达等多种机制起到诱导肿瘤细胞凋亡而对肿瘤起到治疗作用[3~5]。
在本实验中,我们采用不同浓度的姜黄素体外作用于人骨肉瘤系Saos-2,通过MTT检测细胞增殖发现,不同浓度姜黄素可以抑制骨肉瘤细胞的增殖,且其抑制率与姜黄素的浓度和作用时间有关,当姜黄素浓度为20 μmol·L-1,作用时间48 h时抑制作用明显增强,与对照组相比,差异有显著性(P<0.05,见Fig 1)。与国外其他学者研究结果相似[7],提示姜黄素可以体外抑制骨肉瘤细胞的增殖,对骨肉瘤细胞起到杀伤作用。
目前认为,细胞凋亡是细胞监测系统重要的组成部分。在细胞凋亡的早期细胞膜表面的磷脂酰丝氨酸(PS)从膜内转移到膜外,Annexin V可与PS结合,而在早期凋亡阶段细胞胞膜是完整的,PI不能通过胞膜,只有在细胞坏死时才可进入胞内与胞核中的核酸结合发出荧光。因此Annexin V和PI双染可作为凋亡检测的有力手段[8]。我们的流式结果显示,姜黄素可体外诱导人骨肉瘤细胞Saos-2发生凋亡,且其凋亡率随着姜黄素浓度的增加而增加。Hoechst 33258可透过细胞膜并对DNA染色而发出强烈的蓝色荧光,常用来进行凋亡细胞的形态学检测。我们通过荧光显微镜下观察显示20 μmol·L-1的姜黄素可诱导骨肉瘤细胞发生凋亡,细胞核胞核固缩、碎裂,出现凋亡小体。这些结果都说明,姜黄素可以诱导骨肉瘤细胞的凋亡。
研究表明,肿瘤坏死因子(TNF)超家族的成员Fas与其天然配体(Fa sL)或相应单克隆抗体相结合,通过激活胱冬酶(Caspase)家族等过程完成细胞凋亡信号传递,是细胞凋亡的主要途径之一[9]。我们通过Western blot检测发现Fas蛋白在人骨肉瘤细胞Saos-2中呈低表达,而经过姜黄素作用后,Fas蛋白与对照组相比明显增强,提示姜黄素通过上调Fas的表达,增加骨肉瘤细胞对凋亡诱导的敏感性,重新启动了肿瘤细胞凋亡的级联反应,加速肿瘤细胞凋亡,从而达到肿瘤治疗的目的。
综上所述,姜黄素可以抑制骨肉瘤细胞Saos-2增殖,并诱导其凋亡,作用机制涉及上调Fas蛋白表达,可能启动了细胞凋亡的信号转导的级联过程有关。
[1]Levings P P,McGarry S V,Currie T P,et al.Expression of an exogenous human Oct-4 promoter identifies tumor-initiating cells in osteosarcoma[J].Cancer Res,2009,69(14):5648 -55.
[2]Katsuyama Y,Kita T,Horinouchi S.Identification and characterization of multiple curcumin synthases from the herb Curcuma longa[J].FEBS Lett,2009,583(17):2799 - 803.
[3]Milacic V,Banerjee S,Landis-Piwowar K R,et al.Curcumin inhibits the proteasome activity in human colon cancer cells in vitro and in vivo[J].Cancer Res,2008,68(18):7283 -92.
[4]谢朝阳,祝其锋,吴斌华.姜黄素影响Aβ_(25-35)诱导PC12细胞周期变化与细胞凋亡的可能机制[J].中国药理学通报,2009,25(2):217 -21.
[4]Xie C Y,Zhu Q F,Wu B H.Effective mechanism of curcumin on abnormal cell cycle and apoptosis of serum-deprived PC12 cells induced by β-amyloid peptide(25-35)[J].Chin Pharmacol Bul,2009,25(2):217 -21.
[5]Karmakar S,Banik N L,Ray S K.Curcumin suppressed anti-apoptotic signals and activated cysteine proteases for apoptosis in human malignant glioblastoma U87MG cells[J].Neurochem Res,2007,32(12):2235-42.
[6]Liang X,Da M,Zhuang Z,et al.Effects of Survivin on cell proliferation and apoptosis in MG-63 cells in vitro[J].Cell Biol Int,2009,33(1):119-24.
[7]Reuter S,Eifes S,Dicato M,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J].Biochem Pharmacol,2008,76(11):1340 -51.
[8]Papenfuss K,Cordier S M,Walczak H.Death receptors as targets for anti-cancer therapy[J].J Cell Mol Med,2008,12(6B):2566-85.
[9]Peacock J W,Palmer J,Fink D,et al.PTEN loss promotes mitochondrially dependent typeⅡFas-induced apoptosis via PEA-15[J].Mol Cell Biol,2009,29(5):1222 -34.
