绞股蓝有效成分杀灭钉螺效果和毒理研究
2010-11-26梁慧耿鹏倪红马安宁熊哲
梁慧,耿鹏,倪红,马安宁,熊哲
(1. 武汉大学 基础医学院, 湖北 武汉 430070;2.湖北大学 生命科学学院,湖北 武汉 430062;3.湖北大学 资源环境学院,湖北 武汉 430062)
目前,杀灭钉螺(Oncomelaniahupensis)仍是控制血吸虫病流行的重要手段[1].化学药物是国内外使用较多的灭螺药,如氯硝柳胺(Niclosamide),五氯酚钠(Na-pcp)等,但这些灭螺药物对人畜、水生动植物有危害,其残留物在环境中不易降解[2].从1933年至今已有1 000多种植物用于灭螺试验,其中发现有20多种具有强烈的灭螺作用.而我们通过研究获得的阶段性成果证实:绞股蓝﹑夹竹桃﹑天南星、羊蹄、枫杨﹑天名精等十几种植物对钉螺具有很强的毒杀作用[3].绞股蓝是一种经济作物,在我国广泛种植,本实验通过提取绞股蓝有效成分总皂甙与总黄酮类物质[4],探讨它们对钉螺的协同灭螺效果,并通过扫描电镜和透射电镜以及测定药液对钉螺各部位胆碱酯酶(CHE)与乳酸脱氢酶(LDH)活性的影响来探讨其杀螺机理[5-7].为寻求到一种低毒、高效、价格低廉的灭螺药物,提供一定实验依据.
1 材料和方法
1.1材料绞股蓝 (Gynostemmapentaphyllum) 购于湖北神农架;钉螺(Oncomelaniahupensis)采自荆州地区.
1.2主要仪器旋转蒸发仪(型号: RE-52AA,上海亚荣)、傅立叶变换红外光谱仪(规格型号:SPECTRUM ONE,技术指标: 检测器 MIRTGS,扫描范围:4 000~450 cm-1,分辨率:0.5~4.0 cm-1,红外光源:MIR);Hitachi H-600型扫描电镜.
1.3 绞股蓝有效成分的提取和初步鉴定
1.3.1 绞股蓝有效成分Ⅰ和Ⅱ的提取 参见文献[8-9]进行,略有改动.
1.3.2 上述有效成分的鉴定 将上述2种有效成分分别用傅立叶变换红外光谱仪和化学试剂进行鉴定分析,再与标准物质图谱对照,初步鉴定它们的结构.
1.4绞股蓝水提物的制备将绞股蓝全草洗净风干,粉碎,按干重和水体积1∶10的比例,加入去氯清水,在室温(约25 ℃)浸泡3 d 后,纱布过滤,滤渣再按上述处理2次,合并滤液,在水浴锅中蒸发水分,并将剩余物在65 ℃ 烘箱中烘至恒重,得绞股蓝水提物,将其磨成粉并过80目筛,待用.
1.5绞股蓝有效成分灭螺实验将绞股蓝水提物粗粉、绞股蓝有效成分Ⅰ和Ⅱ以及Ⅰ和Ⅱ等比例混合物分别用去氯清水配成浓度梯度为0.062 5、0.125、0.250、0.500、1.000 g/L 的溶液,采用WHO“杀螺剂实验室终筛方法”中的浸泡法,进行浸杀钉螺实验.同时以去氯清水饲养的钉螺作为对照.钉螺75只为1组(每一种处理为一组),每15 只装入一个尼龙网袋中,分别将各组(5袋/组)钉螺浸入盛有500 mL 的上述不同浓度溶液的玻璃缸中,每隔24 h 从各处理中随机取出1袋钉螺,作存活检查,统计死亡率.上述每一实验重复3次,取其平均值作为实验结果,实验在25 ℃下进行.
1.6 杀螺毒理分析
1.6.1 电镜样品制备 分别取出在绞股蓝混合液0.500 g/L 浓度下浸泡24 h 后的钉螺和去氯清水饲养的钉螺,分离取出其肝部、头部、足部后放入2.5% 戊二醛溶液中固定,再分别用乙醇梯度脱水,乙腈置换,真空干燥,喷金,在Hitachi H-600 型扫描电镜下观察[10].
1.6.2 钉螺各部位胆碱酯酶(CHE)、乳酸脱氢酶(LDH)的酶活性测定 分别取出经绞股蓝混合液不同浓度浸泡48 h后的钉螺与去氯清水饲养的钉螺,分离出钉螺肝部、头部、足部,分别加预冷的0.2 mol/L pH 7.1磷酸缓冲液(0.1 mL /只)制样,每样30只钉螺,冰浴匀浆,4 ℃条件离心(12 000 r/min,10 min),取上清液待测[7].用南京建成生物工程研究所的试剂盒进行测试.
2 结果与分析
2.1绞股蓝有效成分的红外光谱鉴定绞股蓝有效成分Ⅰ和Ⅱ的红外光图谱(infrared absorption spectroscopy,IR)见图1、2.
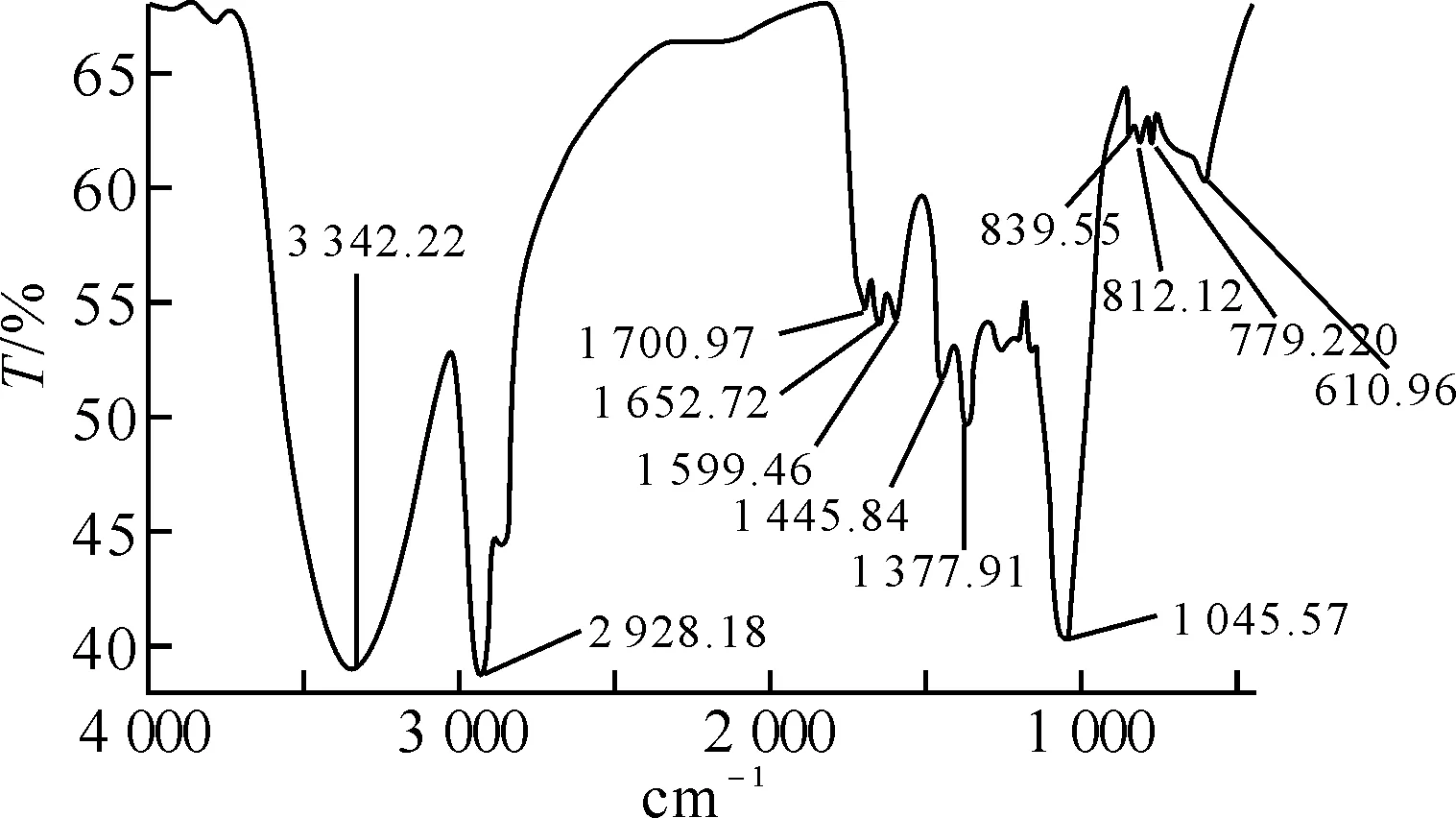
图1 绞股蓝有效成分Ⅰ的红外图谱
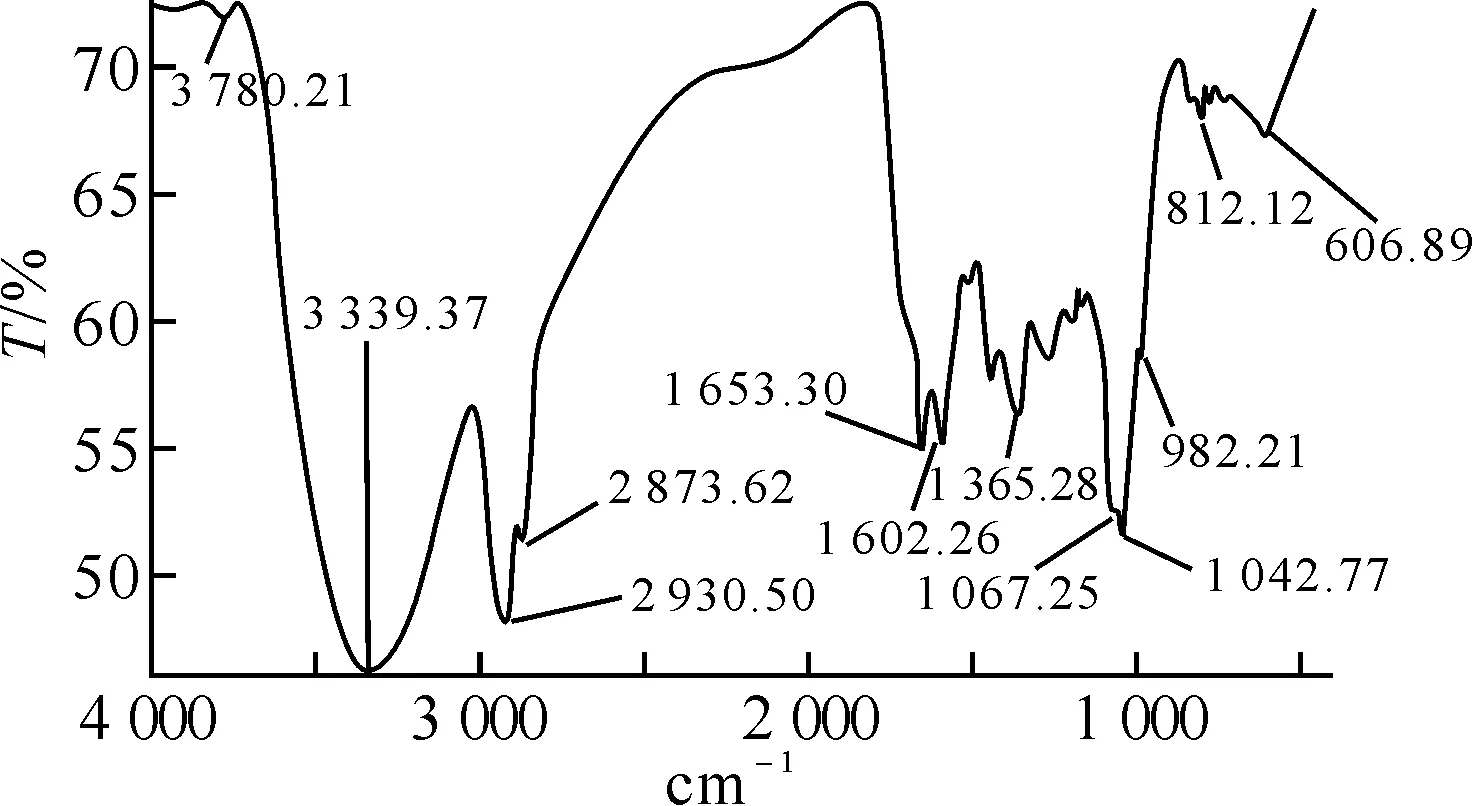
图2 绞股蓝有效成分Ⅱ的红外图谱

2.2绞股蓝有效成分的灭螺效果将绞股蓝水提物和绞股蓝单一有效成分以及它们等比例混合物配成5种不同浓度的水溶液,分别浸杀钉螺,毒杀效果结果见表1.实验表明:随处理液浓度的增加和时间的延长,各种处理条件下的钉螺死亡率呈上升趋势,杀螺效果依次为:绞股蓝混合液>单一成分>水提物,有效成分Ⅰ和Ⅱ灭螺效果相当,混合液浓度为0.250 g/L,72 h就能达到93.33%杀螺效果.
2.3 杀螺毒理分析
2.3.1 SEM电镜分析 用0.500 g/L 绞股蓝混合液处理钉螺24 h 后分别取出肝部、头部和足部,做扫描电镜观察,结果见图3~8.从图中可见,对照组钉螺肝脏外被的内脏囊表面呈网状结构,随肝脏实质组织一起形成沟回(图3),经处理后的钉螺肝脏表面节后受到破坏,沟回部分消失,肝脏部分溶蚀,出现网架结构(图4);对照组钉螺头部(图5)表面有成行的迂曲皱褶,皱褶上有密集的颗粒,呈球状或椭圆形,经处理后的钉螺头部皱褶被破坏,形成凹凸的嵴,呈索状排列(图6);对照组足跖肌表面有清晰成行的褶皱,褶皱不迂回(图7),经处理后的钉螺足部褶皱出现缺失,且显得杂乱(图8).

图3、5、7 分别为对照钉螺肝部、头部和足部;图4、6、8 分别为0.500 g/L 混合液处理钉螺24 h后的钉螺肝部、头部和足部
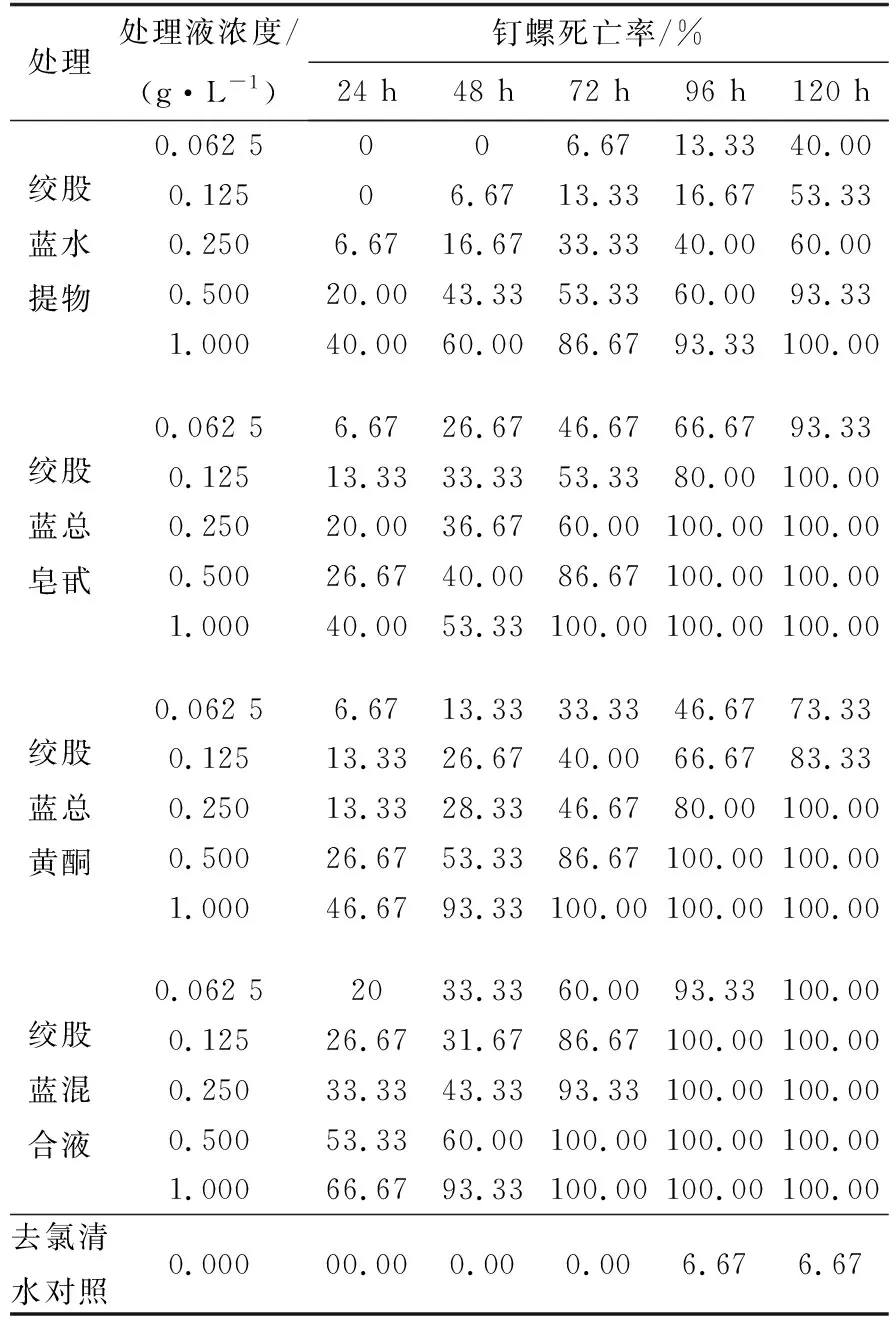
表1 绞股蓝水提物及各有效成分灭螺效果比较
2.3.2 CHE与LDH酶活性变化分析 经不同浓度绞股蓝混合液浸泡钉螺48 h后,测得钉螺的肝部、全身和头足部的CHE与LDH酶的活性变化,结果见图9、图10.
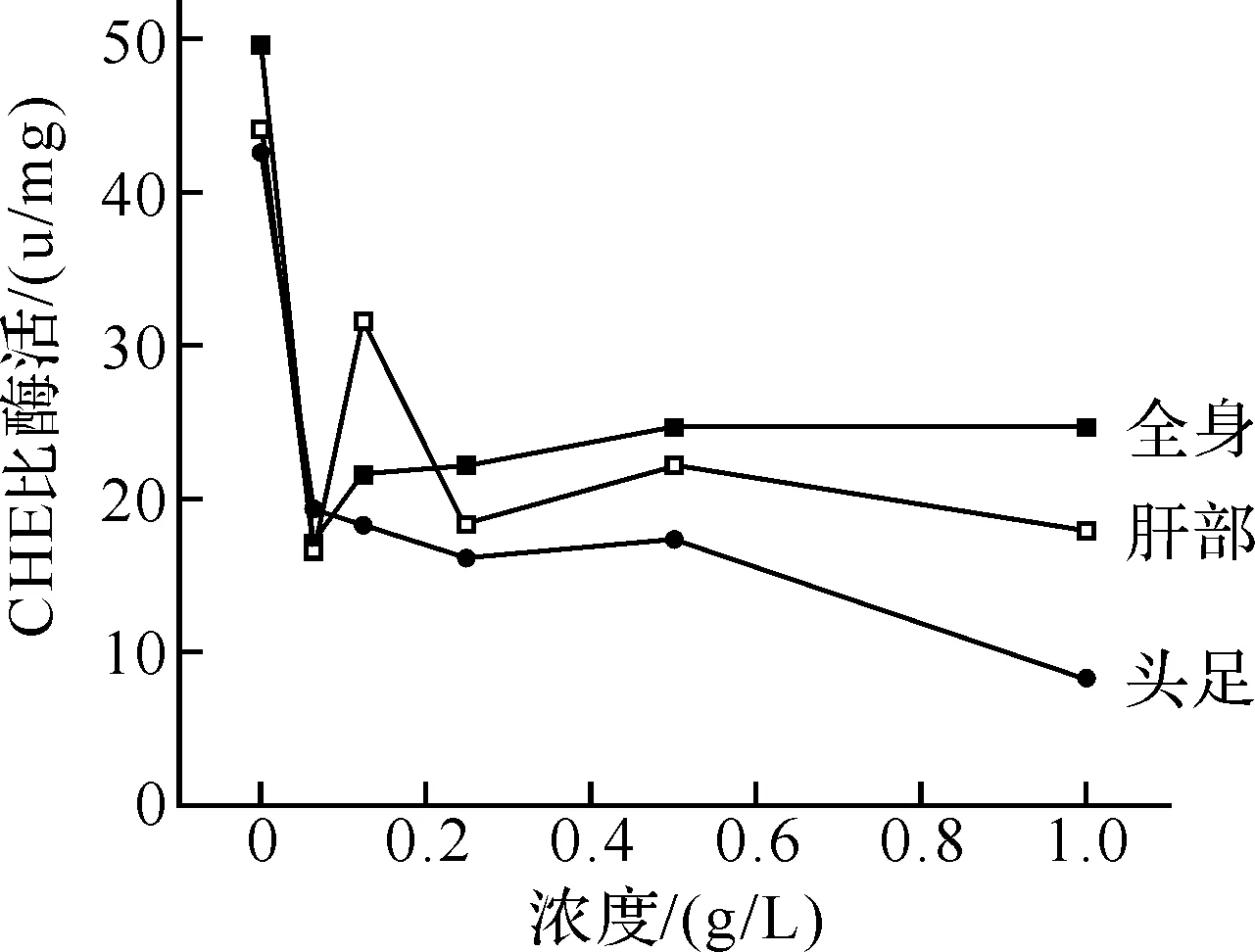
图9 不同浓度混合液对钉螺各部位CHE酶活的影响

图10 不同浓度混合液对钉螺各部位LDH酶活的影响
由图9可知,随着处理液浓度的升高,全身与肝部的CHE酶活性有一定升高,但随着浓度的增加,酶活性逐步减弱.而头足部则是在混合液浓度较大时,酶活力减弱较多,这表明,高浓度的绞股蓝混合液对钉螺头足部CHE影响较大,中毒相对于全身与肝部也较深.
由图10可知,钉螺的头足部、肝部和全身的LDH酶活力随着混合液中浓度的增加变化不尽相同.在低浓度下,3 种酶活急剧下降后又迅速上升,随后开始逐步下降,全身的LDH酶活随着浓度的增加变化不大,而肝部的LDH酶活则随着浓度的增加一直下降,而头足部的LDH酶活则随着浓度的增加而增加,这表明,高浓度的绞股蓝混合液使钉螺肝部LDH酶活下降明显.
3 讨论
3.1绞股蓝有效成分的灭螺效果据报道绞股蓝整株水浸液[3]与绞股蓝皂甙类物质具有很好的杀螺效果[11].本实验以提取出的绞股蓝总皂甙和总黄酮类物质为毒杀钉螺成分,比较了绞股蓝单一有效成分和它们的混合成分水溶液灭螺效果,实验表明,随着药液浓度的升高与时间的延长,其对钉螺的毒杀效果逐渐增强,在相同浓度条件下,绞股蓝混合液灭螺效果优于单一组分,不同绞股蓝有效成分有协同灭螺作用.但两种有效成分的最佳配比以及与其它植物源灭螺成分的协同灭螺作用还有待进一步研究.
3.2 杀螺毒理分析
3.2.1 扫描电镜表征 通过对钉螺的头足部与肝脏的扫描电镜观察,绞股蓝混合有效成分溶液对钉螺毒杀作用显著,混合液浸杀后的钉螺头部表面皱褶破坏,形成凹凸的嵴,褶皱消失,出现溃烂变形;钉螺足部的足跖肌及壳轴肌纤维被破坏,出现缺失,且显得杂乱,可见有许多小孔洞,肝部部分溶蚀,迂回消失,看到网状结构,说明绞股蓝混合液对钉螺组织具有机械性破坏作用,且这种损伤作用随浸泡时间的延长而逐渐加重,这与谭苹报道的结果相一致[10,12].
3.2.2 CHE、LDH的测定酶活力 用酶促动力学法测定绞股蓝混合液浸泡后的钉螺肝部、头足部和整个软体的胆碱酯酶(CHE)和乳酸脱氢酶(LDH)的酶活性发现,随着药液浓度的增加,钉螺头足部CHE受抑制明显,CHE是一类糖蛋白,存在于钉螺头足部及神经干,检测其变化在临床上就有应用[13].CHE的降低标志着钉螺运动功能丧失,CHE是钉螺神经性质和功能的参考指标.LDH 是无氧呼吸过程中的重要酶[14],实验表明,在肝部LDH的酶活性受明显抑制,LDH酶活性的下降说明绞股蓝混合液影响钉螺糖酵解代谢,当混合药液浓度比较低时,混合液刺激了钉螺头部CHE和肝部LDH的合成,两种酶活性均有升高,这表明钉螺表现出应激反应,用以增强钉螺的解毒能力;当混合药液浓度比较高时,由于混合药液作用强度超过了钉螺生理阈限及解毒能力,抑制了酶的活性,钉螺物质代谢和能量代谢出现紊乱,从而导致钉螺死亡,这与陈盛霞报道的相一致[15].
参考文献:
[1] 王万贤,杨毅,柯文山,等.枫杨水浸液灭螺实验研究[J].应用生态学报,1999,10(4):478-480.
[2] WHO Expert Committee on the Control of Schistosomiasis.The control of schistosomiasis: WHO technical expert series 830[M].Geneva: World Health Organization,1993: 58-64.
[3] 马安宁,王万贤,杨毅,等.灭螺植物资源的开发利用研究[J].自然资源学报,2000,15(1):40-45.
[4] 侯金华,王万贤,倪 红,等.葫芦科植物绞股蓝(Gynostemmapentaphyllum)灭螺初步研究[J].湖北大学学报:自然科学版,2006,28(3):306-308.
[5] 江苏新医学院.中药大辞典[M].上海:上海科技出版社,1979:88-590.
[6] 柯文山,王万贤,杨毅,等.夹竹桃对钉螺肝损伤的超微结构观察[J].电子显微学报,2002,2(21):1-2.
[7] 杨坤,周晓农,梁幼生,等.春季温度变化对钉螺酶活性的影响[J].中国人兽共患病杂志,2004,20(6):123-125.
[8] 郭文源,王万贤.绞股蓝栽培与产品开发[M].成都:电子科技大学出版社,1993:77-79.
[9] 方乍浦,曹宪仪.绞股蓝中黄酮甙、有机酸的分离和鉴定[J].中国中药杂质,1989,14(11):36-38.
[10] 谭苹,何昌浩,刘冰,等.槟榔碱与杀螺药合用对钉螺头足部影响的扫描电镜观察[J].中国血吸虫病防治杂志,2001,l3(1):21-23.
[11] 项秀丽,杨毅,王万贤,等.绞股蓝总皂甙灭螺活性研究[J].湖北大学学报:自然科学版,2008,30(1):87-89.
[12] 谭苹,杨建明,梁慧,等.空心莲子草对钉螺组织影响的扫描电镜观察[J].电子显微学报,2006,25 (3):257-260.
[13] 潘琦.肝硬化患者血清白蛋白、胆碱酯酶及前白蛋白检测意义[J].中国中医现代远程教育,2009,12(12):298-298.
[14] 周静.乳酸脱氢酶的分离纯化及其性质的研究[J].赤峰学院学报:自然科学版,2009,25(9):111-113.
[15] 陈盛霞,吴亮,杨小明,等.银杏外种皮对钉螺的杀灭机理[J].动物学报,2007,53(1)):190-194.
