龟皮胶原蛋白的提取及结构表征(Ⅰ)
2010-11-26黄文印大中朱泽瑞
黄文,印大中,朱泽瑞
(1.湖南第一师范学院 数理系,湖南 长沙 410002;2.湖南师范大学 生命科学学院, 湖南 长沙 410081)
胶原是生物体内的一种纤维蛋白,主要存在于皮肤、骨、软骨及肌腱等组织中,占人体或其他动物体总蛋白含量的25%~33%[1].来源于动物皮的胶原一般统称为皮胶原,其主要组成为Ⅰ型胶原和Ⅲ型胶原,它们都属于成纤维胶原.成纤维胶原因其化学组成、交联和螺旋结构的特点而具有较强的机械性能、低免疫原性、较好的生物相容性和可生物降解性等生物学特性,因而广泛应用于生物、医药、食品及材料等领域[2].人们对于猪皮或牛皮等哺乳动物胶原的研究比较充分,而水产、两栖、爬行等其他动物皮中的胶原蛋白的研究和开发较少.随着养殖业的发展及中药材龟板的取用,将会产生大量的龟皮,但对龟皮的研究非常有限.本研究就乌龟胶原蛋白的提取、胶原蛋白分子量测定以及氨基酸成分分析做了一些分析,为开发和利用龟皮胶原蛋白提供科学依据.
1 材料与仪器
1.1主要原料乌龟(湖南四进生物开发股份有限公司提供),SDS-聚丙烯酰胺凝胶电泳试剂,透析袋(14 000 ku),胃蛋白酶、Ⅰ型标准胶原蛋白、高分子标准蛋白(均购自美国Sigma公司),氯化钠,氢氧化钠,丙酮,冰醋酸,盐酸等试剂均为分析纯.
1.2仪器和设备DYY-10型(ECP3000)三恒电泳仪,DYCZ-22A型垂直平板电泳槽,524型恒温磁力搅拌器,LC-6A型日本岛津高效液相色谱仪,凯氏定氮仪,D-37520 Osterode超速冷冻离心机(德国).
2 方法与步骤
2.1 胶原蛋白的提取
2.1.1 预处理 将乌龟处死去头,锯开两边的骨桥,剔除龟肉,取龟的四肢及头部、尾部的皮肤,洗净.将洗净的龟皮切成5 mm×5 mm的小块,丙酮脱脂10 h,风干,贮存于4 ℃下备用.
2.1.2 胶原蛋白的酶解 本实验采用胃蛋白酶酶解法,胃蛋白酶可以在胶原链的非螺旋区的特定位点打断胶原肽健,最大程度地保持了其天然结构,适合用作生物医用材料.将预处理后的龟皮1 g,用双蒸水洗涤3~4次,分别浸泡于 pH 2.5 的0.5 mol的冰醋酸中,静置于4 ℃下24 h,待皮块膨胀均匀后取出,加5 mL双蒸水打浆.在浆液中加入1%的胃蛋白酶,于4 ℃下酶解24 h,每2 h搅拌10~20 min.
2.1.3 胶原蛋白的分离纯化 将酶解液离心分离(8 000~10 000 r/min),取上清液以1 mol/L的NaOH溶液调pH至7左右,静置24 h.再次离心,弃上清液,以0.1 mol/L的醋酸溶液将沉淀溶解,溶液pH在2.5~3.在溶解液中加入固体NaCl,使溶液中盐含量1.0 mol/L,静置24 h,离心弃上清液,沉淀用0.1 mol/L醋酸溶液溶解,于0.05 mol/L醋酸溶液中透析2~3 d,(透析袋尺寸为14 000 ku),每5 h更换1次透析液,得纯胶原溶液,置于4 ℃下保存备用.
2.2胶原蛋白分子量测定采用SDS-聚丙烯酰胺凝胶电泳方法,分离胶浓度为5%;积层胶浓度为3%;电极缓冲液为SDS-Tris-甘氨酸,电泳电流30 mA,电压200 V,电泳时间为4~5 h.
2.3胶原蛋白的氨基酸成分分析称取胶原蛋白样品50 mg,加10 mL 6 mol/L HCl于(110±1) ℃水解24 h后过滤,取滤液0.5 mL抽干,加2 mL蒸馏水,混匀过滤,取滤液10 μL用邻苯二甲醛衍生剂于室温下衍生3 min,注样测定.采用岛津LC-6A 高效液相色谱仪进行检测.仪器工作条件:色谱分析柱为Waters的C18分析柱(150×4.6 mm);洗脱液A液为50 mmol醋酸钠(pH 6.8,含17%甲醇,1%四氢呋喃),洗脱液B液为50 mmol醋酸钠(pH 6.8,含77%甲醇,1%四氢呋喃);柱温30 ℃;流量1.0 mL/min.荧光分析采用ex 338 nm/em 425 nm 检测.采用凯氏定氮法测定胶原蛋白含量(换算因子为5.55).
3 结果与分析
3.1龟皮胶原蛋白的分子量测定结果蛋白质分子量有多种测定方法,其中用聚丙烯酰胺凝胶电泳方法(SDS-PAGE)经济,且比较准确,本实验主要检测了龟皮胶原蛋白多肽产品分子量的分布.从Ⅰ型标准胶原蛋白与龟皮胶原蛋白的电泳图谱(图1)可以看出,龟皮胶原蛋白由3条明显的主带构成,保持了Ⅰ型胶原的基本结构,这表明龟皮胶原蛋白为Ⅰ型胶原蛋白.但龟皮胶原蛋白的含量明显比Ⅰ型胶原蛋白含量高(电泳图谱颜色较深).Ⅰ型胶原占生物体胶原总量的90%左右,一般为透明、无分支的原胶原,是由3条α肽链组成.2条α链形成的肽链二聚体叫β-肽链,3条α链形成的肽链三聚体叫γ-肽链[3].肽链的螺旋区含有338个(Gly-X-Y)重复序列,X常为脯氨酸,Y常为羟脯氨酸或羟赖氨酸.α链中吡咯环的存在使N—C键不能自由旋转,构成左手螺旋.3条α链依靠侧链残基相连,形成了原胶原(tropocollagen)分子特有的3股螺旋结构[4].
经48 h胃蛋白酶进一步水解后(图2),龟皮胶原蛋白的区带数由3条分化成5条.原因可能是3条原有的结构肽链被逐渐酶解形成小分子肽链,故原有结构肽链的含量降低,带型减弱,而新形成的两条小分子肽链含量不断增加,带型极强.根据电泳图谱中分子相对迁移率区分为单股α1链、α2链,二聚体β1链、β2链和三聚体γ链.经采用高分子标准蛋白测定,以相对迁移率(X=Rf)对相对分子质量(Y=M)作图(图3),作拟合曲线,得到回归方程Y=-85.958X+106.89,其线性回归系数R2=0.996 3.
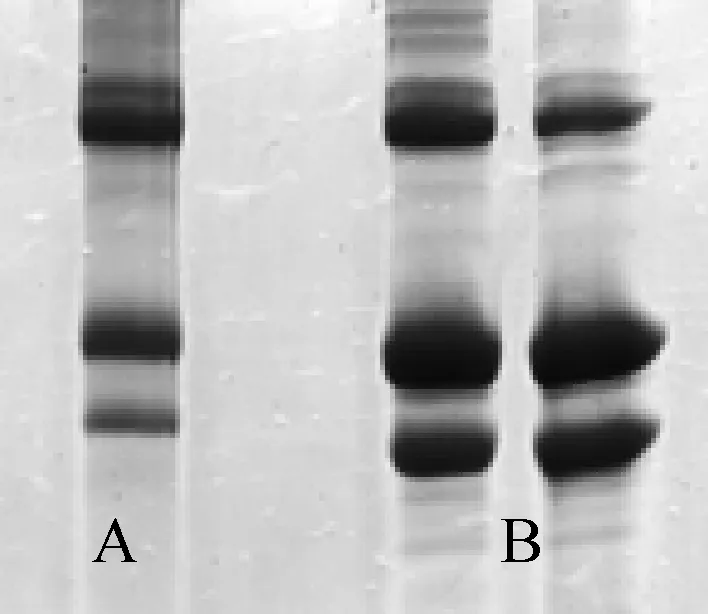
图1 标准胶原蛋白与龟皮胶原蛋白的SDS电泳图谱A标准胶原蛋白;B龟皮胶原蛋白
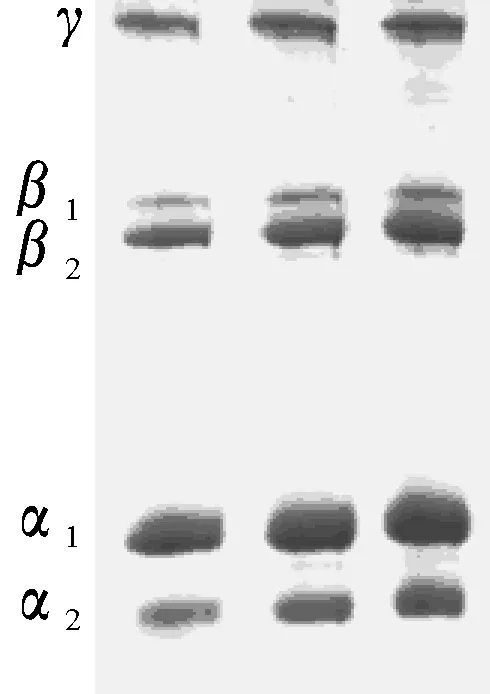
图2 48 h酶解后龟皮胶原蛋白的SDS电泳图谱(点样量:从左至右分别为8、10、12 μL)
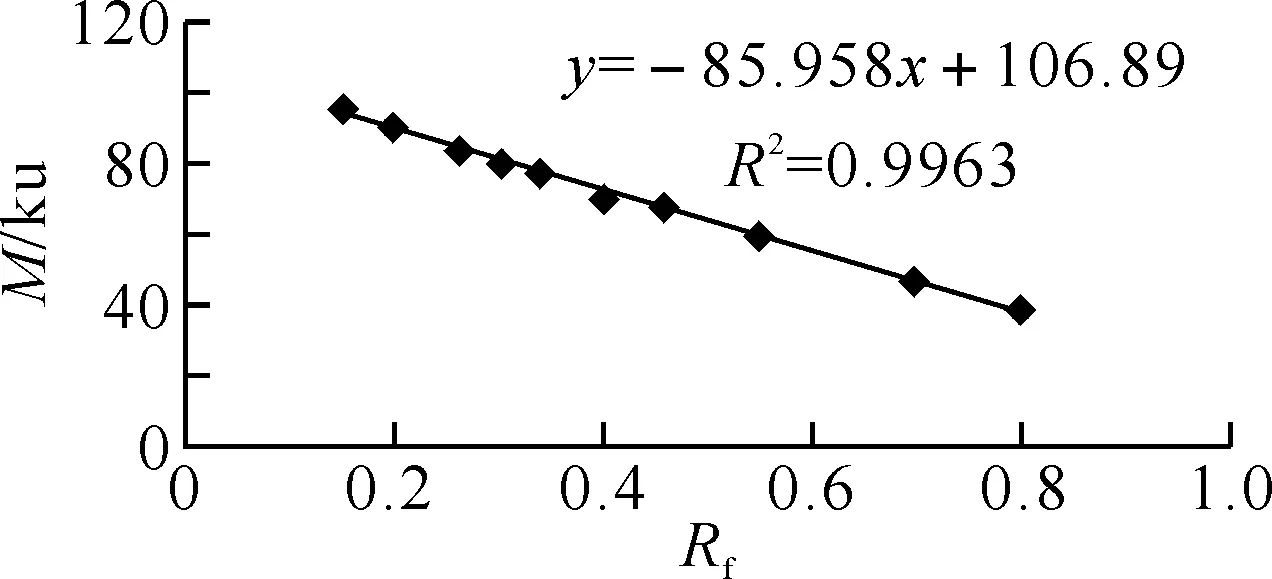
图3 蛋白质标记相对迁移率(Rf)与相对分子量(M)的关系曲线

胶原蛋白组分γβ1β2α1α2Rf0.3000.4700.5090.7660.831M/ku80.62166.40563.11741.69036.276
由回归方程和龟皮胶原蛋白各组分的相对迁移率,可以计算出各组分的相对分子量,结果见表1.由此推算出龟皮胶原蛋白的分子量约为288 ku.
3.2龟皮胶原蛋白与Ⅰ型胶原标准蛋白的氨基酸成分分析将龟皮胶原蛋白和Ⅰ型胶原蛋白样品进行液相色谱分析,得结果如表2.

表2 龟皮胶原蛋白与Ⅰ型胶原蛋白的氨基酸成分分析 mg/100 mg
从表2的相关系数比较可以看出龟皮胶原蛋白与Ⅰ型胶原标准蛋白的氨基酸成分呈高度正相关,进一步说明龟皮胶原蛋白为Ⅰ型胶原蛋白.15种氨基酸含量比较发现:龟皮中有甘氨酸(Gly)、丙氨酸(Ala)、赖氨酸(Lys)、苏氨酸(Thr)、酪氨酸(Tyr)5种氨基酸含量高于Ⅰ型胶原标准蛋白,其余10种氨基酸含量低于Ⅰ型胶原标准蛋白.
龟皮与Ⅰ型胶原标准蛋白的氨基酸含量的方差分析表明(见表3):F>F14,15,0.01,即P<0.01,胶原蛋白中15种氨基酸之间的含量差异达到极显著水平(F=33.74**,).由于龟皮胶原蛋白的含量高于Ⅰ型胶原蛋白,且与Ⅰ型胶原蛋白的氨基酸含量差异显著,因此,龟皮胶原蛋白可以作为一种重要的皮胶原进行开发和利用.
进一步将龟皮胶原蛋白氨基酸含量进行多重比较(表4)表明:15种氨基酸中甘氨酸的含量最高,与其它14种氨基酸的含量差异极显著;其次是谷氨酸,它与精氨酸、丙氨酸差异不显著,与天冬氨酸差异显著,与其它氨基酸差异极显著;再其次是精氨酸,它与丙氨酸、天冬氨酸和赖氨酸差异不显著,与丝氨酸、苏氨酸差异显著,与其它氨基酸差异极显著;而丙氨酸和天冬氨酸除了与酪氨酸、组氨酸和蛋氨酸差异显著外,与赖氨酸、丝氨酸、苏氨酸、苯丙氨、亮氨酸、异亮氨、缬氨酸的差异不显著.由此看来,胶原中15种氨基酸可归纳为四类:第Ⅰ类为高含量氨基酸1种,即甘氨酸(Gly);第Ⅱ类为次高含量氨基酸3种,即谷氨酸(Glu)、精氨酸(Arg)和丙氨酸(Ala);第Ⅲ类为一般含量氨基酸9种,即天冬氨酸(Asp)、赖氨酸(Lys)、丝氨酸(Ser)、苏氨酸(Thr)、亮氨酸(Leu)、苯丙氨酸(Phe)、异亮氨酸(Ile)、缬氨酸(Val)、酪氨酸(Tyr);第Ⅳ类为微量氨基酸2种,即组氨酸(His)和蛋氨酸(Met).

表3 Ⅰ型与龟皮胶原蛋白氨基酸含量的方差分析

表4 龟皮胶原中15种氨基酸含量的多重比较
4 结论
(1)龟皮胶原蛋白SDS-PAGE电泳结果分析表明,龟皮胶原为Ⅰ型胶原蛋白.酶解后3条肽链分化成5条,表明龟皮胶原蛋白的3条肽链中仅有两个断点,测得各肽链的分子量约为80.621 、66.405、63.117、41.690、36.276 ku,龟皮胶原蛋白的分子量约为288 ku.
(2)三种胶原蛋白的氨基酸含量比较表明:龟皮与Ⅰ型胶原的相关系数为0.997 1,这说明龟皮胶原蛋白极相似于Ⅰ型胶原蛋白.目前的研究工作已知:人类的Ⅰ型胶原是大直径交叉条状纤维的分子聚集体,α1链位于第17号染色体,遗传编码区长达4 392个核苷酸,编码产物由1 464个氨基酸组成,含有51个外显子;α2链位于7号染色体,遗传编码区长达4 098个核苷酸,编码产物由1 366个氨基酸组成,含有52个外显子[6].从进化的角度看,Ⅰ型胶原属比较原始的胶原,龟皮胶原与它相似,反映了乌龟物种的原始性.
(3)龟皮胶原中15种氨基酸比较发现,龟皮中有甘氨酸、苏氨酸、丙氨酸、酪氨酸、赖氨酸5种氨基酸含量高于Ⅰ型胶原标准蛋白.丙氨酸作为糖异生途径的前体物既可作为生物能量的物质基础,又可以别构抑制丙酮酸激酶的活性,给予生物合成前体过剩的信号.丙氨酸含量高,预示着乌龟肝脏中谷丙转氨酶的活性强,可使乌龟体内维持较高的氮水平,以达到高能储蓄和低能消耗的目的.酪氨酸在一系列酶的作用下可转变为乙酰CoA.乙酰CoA是生物代谢的能量载体,说明乌龟形成能量载体的原料充足,这对乌龟能量的储存十分有利.
参考文献:
[1] Lee C H, Anuj S, Lee Y.Biomedical applications of collagen[J].Inter J of Pharma,2001,22(6):1-22.
[2] 王娜,林炜,穆畅道.皮胶原的结构、性质与提取方法[J].皮革科学与工程,2006,16(2):42-47.
[3] 刘苏锐,王坤余,琚海燕.猪皮Ⅰ型胶原蛋白的提取及其结构表征[J].中国皮革,2007,36(7):43-49.
[4] 李贺,刘白玲,陈华林,等.酶法提取猪皮胶原及结构表征[J].中国皮革,2002,31(23):14-16.
[5] 肖世维,但年华,曾睿,等.从动物皮中提取胶原蛋白的方法[J].西部皮革,2009,31(15):17-21.
[6] 张达江,王亮.Ⅰ型胶原蛋白的结构、功能及其应用研究的现状与前景[J].生物技术通讯,2006,179(2):265-269.
