胰腺癌细胞系BxPC3及胰腺癌组织Ras相关区域家族1A启动子CpG岛的甲基化状态
2010-11-24彭泉蔡辉华高文涛钱祝银苗毅
彭泉 蔡辉华 高文涛 钱祝银 苗毅
·论著·
胰腺癌细胞系BxPC3及胰腺癌组织Ras相关区域家族1A启动子CpG岛的甲基化状态
彭泉 蔡辉华 高文涛 钱祝银 苗毅
目的检测Ras相关区域家族1A(Ras association domain family 1A, RASSF1A)在胰腺癌细胞株BxPC3及胰腺癌组织中的甲基化状态,探讨其启动子异常甲基化在胰腺癌发病机制中的可能作用。方法采用结合重亚硫酸盐的限制性内切酶法(combined bisulfite restriction analysis,COBRA)检测胰腺癌细胞株BxPC3、5例正常胰腺组织、13对胰腺癌及相应癌旁正常胰腺组织中RASSF1A启动子CpG岛的甲基化状态,计算其甲基化率。以甲基化酶抑制剂5-Aza-dC(5-Aza-2-deoxycitydine)处理BxPC3,观察处理前后甲基化率变化情况及RASSF1A mRNA表达变化。结果在BxPC3细胞株中,RASSF1A启动子的CpG岛甲基化率为62.90%;正常胰腺、癌旁及癌组织中平均分别为9.14%、53.79%和55.82%。与正常胰腺组织相比,胰腺癌旁及癌组织的RASSF1A启动子甲基化率明显增高(P值lt;0.01),而癌旁及癌组织之间无明显差异(Pgt;0.05)。BxPC3经5-Aza-dC处理后,RASSF1A的CpG岛甲基化率显著下降至42.50%(Plt;0.05),同时RASSF1A mRNA表达增强。结论RASSF1A启动子CpG岛异常甲基化是胰腺癌发生发展中的早期事件,可能参与胰腺癌的发病过程。
胰腺肿瘤; 甲基化; CpG岛
胰腺癌恶性程度较高,预后较差,其发病的分子机制至今不是十分清楚。研究显示,遗传表型改变,特别是抑癌基因启动子CpG岛的异常甲基化与胰腺癌的发病关系密切[1-2]。人类Ras相关区域家族1A(RASSF1A)是从第3号染色体短臂3p21.3 克隆出来的肿瘤抑制基因,在许多肿瘤中表达缺失。在此,本研究定量分析RASSF1A启动子区CpG岛中的甲基化状态,探讨该基因异常甲基化与胰腺癌之间的关系。
材料和方法
一、DNA及RNA抽提
胰腺癌细胞BxPC3购自上海市细胞库,由南京医科大学第一附属医院实验室提供。常规培养传代。取对数生长期细胞,按每孔107个细胞接种于6孔板,培养24 h后换液,加入含5 μmol/L 5-Aza-dC的培养液继续培养96 h,每24 h更换同样培养液。以不加5-Aza-dC的培养细胞作为对照组。应用DNA提取试剂盒(美国Omega公司)提取细胞DNA。应用Trizol一步法提取总RNA。
收集南京医科大学第一附属医院普外科手术切除的13例胰腺癌及相应癌旁正常胰腺组织和5例正常胰腺组织(均签署知情同意书并经医院伦理委员会审核),取0.2 g置入研磨中加液氮研成粉末,分为两份,分别按上述方法提取DNA和总RNA。
二、RASSF1A基因甲基化率检测
采用结合重亚硫酸盐的限制性内切酶法(combined bisulfite restriction analysis, COBRA)[3]检测基因甲基化。参考Herman等[4]的方法,先将DNA进行亚硫酸氢盐修饰。以修饰后的DNA作为模板进行PCR扩增。RASSF1A上游序列5′-GGGGGAGTTTGAGTTTATTGA-3′,下游序列5′-CTACCCCTTAACTACCCCTTCC-3′,PCR退火温度为66℃,反应35个循环。以经甲基化酶处理与未处理的正常人外周血细胞DNA分别作为阳性和阴性对照。PCR产物经回收、纯化后用HpyCH4Ⅲ酶切8 h,行聚丙烯酰胺凝胶垂直电泳,EB染色,成像。完全被酶切表示完全甲基化,出现2条带:line2和line3;完全不被酶切表示无甲基化,出现1条带:line1;部分被酶切表示部分甲基化,3个条带均出现。Quantity One软件进行灰度分析,甲基化率(%)=2、3条带灰度值/3个条带总灰度值的百分值。
三、RASSF1A mRNA水平检测
上游引物5′-GTGGAGCGGGACACGAA-3′,下游引物5′-GCTGTTGATCTGGGCATTGT-3′,以1 μg总RNA作为模板反转录合成cDNA。然后进行PCR扩增,退火温度为63℃。PCR产物经2.0%琼脂糖凝胶电泳分离,成像。
四、细胞凋亡检测
采用上述同样方法制备细胞爬片,进行5-Aza-dC处理,应用TUNEL法检测细胞凋亡。
五、统计学处理
率的比较采用χ2检验,Plt;0.05有统计学意义。
结 果
一、细胞凋亡
经5-Aza-dC处理后,BxPC3细胞出现明显的凋亡(图1)。
二、RASSF1A基因甲基化率
BxPC3细胞RASSF1A启动子CpG岛甲基化率为62.90%,经过5-Aza-dC处理后,甲基化率明显下降到42.50%(Plt;0.05)。正常胰腺组织、胰腺癌组织和相应癌旁正常胰腺组织RASSF1A启动子CpG岛甲基化率分别为9.14%、55.82%、53.79%,癌及癌旁组织的甲基化率较正常胰腺组织明显增高(Plt;0.01,图2)
三、RASSF1A mRNA的表达
BxPC3细胞RASSF1AmRNA轻度表达,经5-Aza-dC处理后,RASSF1A mRNA表达上调(图3)。

图1未处理组(a)和5-Aza-dC处理后(b)BxPC3细胞的凋亡(×400)
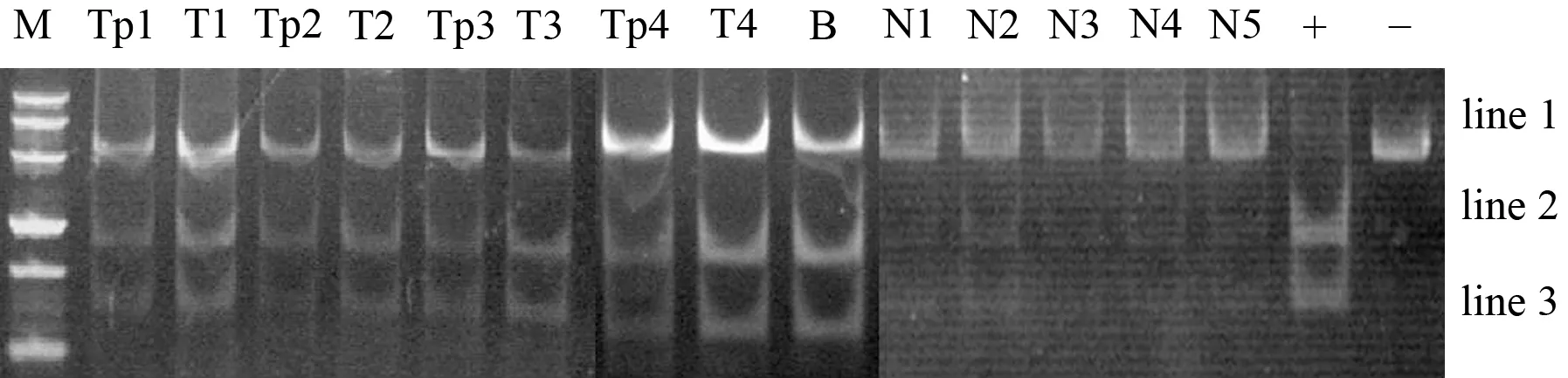
图2正常细胞(N)、BxPC3细胞(B)、癌(T)和癌旁(Tp)组织的COBRA图(+:阳性对照;-:阴性对照)

图3BxPC3经5-Aza-dC处理前后,RASSF1A mRNA的表达
讨 论
如今的研究表明,表观遗传学改变已经成为肿瘤研究中最重要的分子事件之一。表观遗传学主要包括DNA甲基化、基因印迹和组蛋白修饰。
RASSF1基因由于使用不同的剪接和启动子而有不同的转录本,包括RASSF1A、RASSF1B、RASSF1C,其中以RASSF1A最为重要,全长1873 bp,含340个氨基酸的开放阅读框,编码产物相对分子质量为38 800。RASSF1A作为抑癌基因的机制目前存在两种观点。一种观点认为,RASSF1A从翻译水平上抑制cyclinD1的聚集,阻断cyclinD1介导的细胞增殖旁路,从而阻止细胞从G1向S期转变[5]。另一种观点认为,RASSF1A可能是Ras下游信号转导中的一个效应物[6],与Ras蛋白以三磷酸鸟苷依赖的形式相互作用,表现出受体活性,诱导细胞凋亡[6-7]。
目前认为,RASSF1A基因表达失活主要是与启动子区特异的高甲基化、杂合子丢失及染色体缺失有关[7-9]。同时可见DNA甲基化转移酶Ⅰ异常增高[10]。本文结果显示,胰腺癌及癌旁组织的RASSF1A甲基化率明显高于正常胰腺组织,而胰腺癌及癌旁之间无明显差异。因为癌旁胰腺组织在形态学上未见癌细胞,说明RASSF1A启动子异常甲基化对胰腺癌的发生发展来说可能是早期事件。
在胰腺癌细胞株BxPC3细胞中,RASSF1A启动子明显甲基化(62.90%),在mRNA少量表达。但经过抑制甲基化后又重新表达。由于基因的序列没有改变,且甲基化是可逆性的基因修饰过程,故可在胰腺癌或癌前病变中通过去甲基化处理,有可能对肿瘤的预防和及早治疗发挥积极的作用。目前5-Aza-dC治疗恶性血液病取得了显著的疗效[9],这表明该药有可能应用于胰腺癌的治疗。
[1] Shimizu K,Hanaoka M,Kato A,et al.Reduced expression of the E-cadherin gene and its aberrant DNA methylation in hamster pancreatic tumors.Biochem Biophys Res Commun,2005,336:49-53.
[2] Martin ST,Sato N,Dhara S,et al.Aberrant methylation of the Human Hedgehog interacting protein (HHIP) gene in pancreatic neoplasms.Cancer Biol Ther,2005,4:728-733.
[3] Xiong Z,Laird PW.COBRA:a sensitive and quantitative DNA methylation assay.Nucleic Acids Res,1997,25:2532-2534.
[4] Herman JG,Graff JR,Myöhänen S,et al.Methylation specific PCR:a novel PCR assay for methylation status of CpG island.Proc Natl Acad Sci USA,1996,93:9821-9826.
[5] Shivakumar L,Minna J,Sakamaki T,et al.The RASSF1A tumor suppressor blocks cell cycle progression and inhibits cyclinD1 accumulation.Mol Cell Biol,2002,22:4309-4318.
[6] Khokhlatchev A,Rabizadeh S,Xavier R,et al.Identification of a novel Ras-regulated proapoptotic pathway.Curr Biol,2002,12:253-265.
[7] Ortiz-Vega S,Khokhlatchev A,Nedwidek M,et al.The putative tumor suppressor RASSF1A homodimerizes and heterodimerizes with the Ras-GTP binding protein Nore1.Oncogene,2002,21:1381-1390.
[8] Yu MY,Tong JH,Chan PK,et al.Hypermethylation of the tumor suppressor gene RASSF1A and frequent concomitant loss of heterozygosity at 3p21 in cervical cancers.Int J Cancer,2003,105:204-209.
[9] Chan MW,Chan LW,Tang NL.Frequent hypermethylation of promoter region of RASSF1A in tumor rissues and voided urine of urinary bladder cancer patients.Int J Cancer,2003,104:611-616.
[10] Paulsen M,Ferguson-Smith AC.DNA methylation in genomic imprinting development and deseases.J Pathol,2001,195:97-110.
2009-07-22)
(本文编辑:吕芳萍)
AberrantmethylationofRasassociationdomainfamily1ApromoterCpGislandinpancreaticcancercelllineBxPC3andtissues
PENGQuan,CAIHui-hua,GAOWen-tao,QIANZhu-yin,MIAOYi.
DepartmentofGeneralSurgery,FirstAffiliatedHospital,NanjingMedicalUniversity,Nanjing210029,China
QIANZhu-yin,Email:qianzhusilver@163.com
ObjectiveTo determine the methylation status and expression of Ras association domain family 1A (RASSF1A), and the possible effect between promoter aberrant methylation and pathogenesis of pancreatic cancer.MethodsThe methylation status of RASSF1A promoter CpG island (CGI) pancreatic cancer cell line BxPC3 was detected in 5 cases of normal pancreatic tissue and 13 pairs of pancreatic cancer tissues (tumor and peri-tumor) by using COBRA (combined bisulfite restriction analysis) and the methylation rate was calculated. The RASSF1A mRNA expression of BxPC3 was compared between pre- and post-treatment of the inhibitor of DNA methyltransferase (5-Aza-2-deoxycitydine, 5-Aza-dC).ResultsThe average methylation rate of RASSF1A promoter CGI was 62.90% in BXPC3, 9.14% in normal pancreas, 53.79% in peri-tumors (TP), and 55.82% in tumors. The methylation rates in peri-tumors and tumors were significantly increased when compared with that of normal pancreas (Plt;0.01),while there was no significant difference between in peri-tumors and tumors (Pgt;0.05). After 5-Aza-dC treatting BxPC3 cells, the methylation rates decreased to 42.5% (Plt;0.05) and RASSF1A mRNA expression was enhanced.ConclusionsAberrant hypermethylation of RASSF1A promoter CGI could be considered as an early event in the process of pancreatic cancer and participates in the pathogenesis of pancreatic cancer.
Pancreatic neoplasms; Methylation; CpG island
10.3760/cma.j.issn.1674-1935.2010.02.008
国家自然科学基金面上项目(30500492);江苏省自然科学基金(BK2006241)
210029 南京,南京医科大学第一附属医院普外科
钱祝银,Email:qianzhusilver@163.com
