基质辅助激光解吸电离质谱和电喷雾电离质谱在辣根过氧化物酶糖肽结构分析中的应用
2010-10-21陈瑶函晏国全周新文杨芃原
陈瑶函, 晏国全, 周新文, 杨芃原*
(1.复旦大学化学系,上海200032;2.复旦大学生物医学研究院,上海200032)
基质辅助激光解吸电离质谱和电喷雾电离质谱在辣根过氧化物酶糖肽结构分析中的应用
陈瑶函1,2, 晏国全1, 周新文2, 杨芃原1,2*
(1.复旦大学化学系,上海200032;2.复旦大学生物医学研究院,上海200032)
糖链结构的质谱解析是今后糖蛋白分析中的重要研究内容,其中完整糖肽的分析,由于可以同时获得糖基化位点和对应糖链的结构信息,更具有重要意义和研究前景。本工作对质谱软电离技术在完整糖肽分析中的应用进行了研究,其中包括了基质辅助激光解吸电离(matrix-assisted laser desorption ionization,MALD I)和电喷雾电离(electrosp ray ionization,ESI)技术。通过平行使用两种串联质谱(tandem mass spectrometry,MS/MS)分析策略:MALD I-MS/MS和ESI-MS/MS对目标糖蛋白——辣根过氧化物酶进行分析,并讨论了其互补性。结果表明,MALD I和ESI技术各有优劣,结合串联质谱分析,可获得糖肽的糖链结构信息;两条路线互补使用,在揭示蛋白质糖基化修饰(位点和结构)的研究中十分必要。
基质辅助激光解吸电离质谱;电喷雾电离质谱;串联质谱;液相色谱;辣根过氧化物酶;糖肽
Abstract:The mass spectrometric analysis of glycan composition and structure is a difficult but essential part in future study following the present glycoprotein identification.Intactgly copeptides analysis is an attracting field,in considering its capability to provide glycosite and corresponding glycan structure information at the same time.mass spectrometry has been proven to be an important and a key tool for glycan analysis over the past few years.Making use of two soft ionization techniques—matrix-assisted laser desorp tion ionization(MALD I)and electrospray ionization(ESI),through tandem mass spectrometry(MS/MS)analysis,the information for glycans of the glycopep tides can be obtained in the investigation.Meanwhile,by comparing the MALD I-MS/MS and ESI-MS/MS app roaches using model glycoprotein(horseradish peroxidase,HRP),the complementary results have been verified experimentally.We believe that the combination of the two techniques is necessary and will provide useful information for the understanding of protein glycosylation.
Key words:matrix-assistedlaser desorp tionionization(MALD I);electrosp rayionization(ESI);tandem mass spectrometry(MS/MS);liquid Chromatography(LC);horseradish peroxidase;glycopep tide
蛋白质的糖基化是生物体中最普遍和最重要的蛋白质翻译后修饰之一,人体中大约有50%的蛋白质发生糖基化[1]。糖基化与蛋白质的物理化学性质、生物功能密切相关,涉及蛋白质折叠、定位、信号传导、细胞黏附等等生物过程的众多方面。一些疾病也和蛋白质的糖基化水平、糖链结构的变化相关[2,3]。糖蛋白的研究正得到越来越多的关注。
目前研究较多的糖基化蛋白质主要是N-链接糖蛋白和O-链接糖蛋白。前者的糖基化发生在氨基酸序列Asn-Xxx-Ser/Thr(Xxx≠Pro)的Asn残基上,糖链具有由2个乙酰葡糖胺(N-acetylglucosam ine,G lcNAc)和3个甘露糖(m annose,M an)组成的五糖核心结构;后者发生在Ser或Thr残基上,没有明显的氨基酸序列特征,且糖链核心结构不单一。蛋白质的糖基化具有宏观和微观的不均一性,即糖基化位点的多样性以及同一位点糖链结构的多样性,这都增加了糖蛋白研究的难度。
糖链结构的质谱分析方式主要有两种:一种是将已从蛋白质或肽段上切除的糖链进行衍生化,通过凝集素、色谱、质谱等手段进行分析,即糖组学(glycomics)分析;另一种方式不将糖链与蛋白质或肽段分离,直接进行完整的糖肽的串联质谱分析(tandem mass spectrometry,MS/MS),获得肽段序列和糖链结构信息。前者可以针对性地对某类糖型(pattern)进行研究,或者对整个体系中某些糖型的变化趋势进行反映,现已形成大量的研究成果[9-11];后者可以将位点和糖链结构对应起来[12,13],提供了解糖链与蛋白质功能关系的重要信息,但是由于受到分离方式、富集特异性以及糖肽在质谱中响应等的限制,目前该领域还处在不断的发展之中,实现高通量的分析仍有距离[14]。
鉴于从完整糖肽获得糖基化位点和结构信息的重要性,我们对最常用的两种软电离离子化方式在完整糖肽分析中的应用进行了比较。采用MALD IMS/MS和LC/ESI-MS/MS两条路线,用一个具有多个糖基化位点的糖蛋白——辣根过氧化物酶(horseradish peroxidase,HRP)作为测试对象,目标是准确、详尽地获得酶解产物中的糖基化信息,以对实际样品中目标糖蛋白的研究进行指导。结果表明,MALD I和ESI两种模式均有其优点,但要全面获得糖肽信息,两种方法的结合使用是十分必要的。
1 实验部分
1.1 试剂与仪器
标准蛋白质辣根过氧化物酶、酶解用碳酸氢铵(NH4HCO3)、2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)均购自Sigm a-A ldrich公司。测序级胰蛋白酶(sequencing grade modified trypsin)购自Prom ega公司。甲酸、三氟乙酸购自Fluka公司。乙腈购自Fisher Scientific公司。实验用水为M illi-Q Filtration System(M illipore公司)二次纯化水。其他试剂若无特别说明均为国产分析纯。
AX IMA-Q ITTMMALD I TO F MS购自Shimadzu Biotech公司(Kyoto,Japan)。LTQ-O rbitrap XL System购自Therm o Electron公司(B rem en,Germ any)。
1.2 样品前处理
标准蛋白质HRP溶解于25mmol/L NH4HCO3中,使蛋白质的终质量浓度为50~100ng/μL,热变性[15]。溶液冷却后,加入胰蛋白酶(按照胰蛋白酶与标准蛋白质质量比为1∶50的比例加入),于37℃下酶解过夜。将酶解溶液真空离心干燥,以备后续实验使用。
1.3 色谱和质谱条件
MALD I质谱分析在AX IMA-Q ITTMMALD I TO F MS上进行。DHB溶解于含0.1%(体积分数,下同)三氟乙酸的30%乙腈水溶液中,终质量浓度为12.5m g/mL,作为基质。点样方式选择“基质-样品-基质”式[15]。另外,为了提高每次实验样品点之间的重复性,在最后一层基质结晶以后,用小于基质体积的乙醇对样品点进行重结晶,以提高结晶的均一性[16]。MALD I质量扫描范围分为m/z750+,m/z2 000+,m/z3 000+几个区域,依据母离子和碎片离子的质量选择最佳的质量扫描范围。
ESI质谱分析在LTQ-O rbitrap XL System s上进行。真空离心干燥的蛋白酶解肽段溶于0.1%甲酸水溶液后上样,通过Waters公司的nanoACQUITY U PLC BEH C18柱(200mm×75μm,1.7 μm)分离后,进行在线电喷雾串联质谱分析。流动相A为含0.1%甲酸的水,流动相B为含0.1%甲酸的乙腈,梯度洗脱程序为50m in内流动相B的体积分数由初始的5%上升至最终的50%,流速为300 nL/m in。肽段串级分析为data-dependent模式(data-dependentMS/MS acquisition),选择信号强度在前6位的母离子,动态排除0.5m in。
2 结果与讨论
由于研究目标是准确、详尽地获得目标蛋白的糖基化信息以对实际样品的研究进行指导,因此在对HRP进行分析时,将其看作一个经过分离得到的、确定发生N-糖基化的目标蛋白质,且蛋白质的序列已知(质谱鉴定,此处略),后续的糖肽结构分析在此基础上进行。
2.1 MALD I-M S/M S糖肽分析
对于已知蛋白质的糖肽,MALD I-MS/MS分析中未进行糖肽水平上的富集,关键是在肽质谱指纹(pep tide mass fingerp rint,PM F)图谱中寻找糖肽并手动进行串联质谱分析。研究从已知的蛋白质序列入手,找出包含潜在糖基化位点的理论酶解肽段,在大于这些理论肽段相对分子质量(Mr)的范围内进行PM F的筛选。对于N-糖基化,糖链的存在一般会造成至少892(五糖核心Mr)的Mr增量。基于这种思路,我们对大量的在一级谱图中有足够信号强度的质谱峰进行了串联质谱分析。结果表明,具有特征糖链碎裂的MS/MS谱图基本来自m/z2 000+范围。值得说明的是,HRP无法用常见的糖苷酶PNGase F切除糖链的N-糖蛋白,因此寻找它的糖肽比较繁琐(或需选用其他的糖苷水解酶)。对于其他PNGase F酶可以发挥作用的糖蛋白,对比其切除糖链前后的PM F谱图,可以较快捷地寻找其糖肽。
在CID(collision induced dissociation)模式下,糖苷键比肽键更易碎裂。糖肽的最终确定是根据MALD I-MS/MS分析中糖链的碎裂特征实现的[17-19]。图1列举了两张糖肽串联质谱图,它们反映了将MALD I-MS/MS用于糖肽分析时产生的普遍特征。组成糖链的单糖具有特定的Mr,产生了特征质谱峰间距(N-乙酰葡萄糖胺(GlcNAc,203),甘露糖(m annose,162),海藻糖(fucose,146),木糖(xylose,132)等),如图1中两谱图峰间水平箭头上方数值标示。与糖基化位点Asn直接连接的GlcNAc(inner-most GlcNAc),在串联质谱分析时发生跨环断裂(cross-ring cleavage)会形成具有特定的质量差(83和120)的3个连续峰,如图1中两谱图中标注为P,P*,P-GlcNAc的质谱峰,分别代表了上述3个特征连续峰。Mr最小者(P)即可指示该糖肽肽段部分的Mr,若与预测的潜在糖基化位点所在肽段吻合,则初步获得了糖基化位点的信息(一般适于只含有一个潜在位点的肽段)。另外,在低Mr段也能发现少量对应于该肽段的部分酰胺键碎裂产生的离子(b和y离子),可进一步地证实糖基化位点。
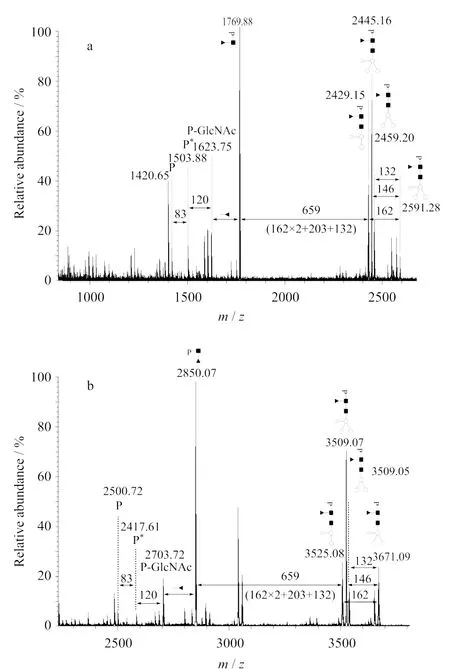
图1 糖肽((a)m/z2591.3和(b)m/z3671.1)的MALD I-M S/M S谱图Fig.1 Tandem mass spectra of two glycopeptides of(a)m/z2591.3and(b)m/z3671.1by MALD I analysis
2.2 HPLC/ES I-M S/M S糖肽分析
LC连接ESI质谱在线分析,理论上来说,只要样品量足够多和液相色谱的分离效果足够好,自动获取的串联质谱图中即包含了糖肽的信息。与MALD I-MS/MS类似,C ID模式下ESI-MS/MS分析中的糖肽谱图也具有一定的特征,除了同样具有反映组成糖链的单糖的Mr的特征质谱峰间距之外,在谱图的低分子质量端,还具有特征地从糖肽主体碎落的寡糖碎片离子(glycan fragment ions,如[G lcNAc+H]+(204),[G lcNAcM an+H]+(366),[G lcNAcManM an+H]+(528)等)。通过提取离子色谱图(extracted ion Chromatogram,XIC),可以初步确定糖肽的色谱保留时间,对产生这些特征寡糖碎片离子的串联质谱图进行筛选,可进一步缩小寻找范围。
图2列举了两张糖肽ESI-MS/MS串联质谱图。带多电荷的母离子在碎裂过程中大致产生了两类容易识别的子离子,即寡糖碎片离子和糖肽相关离子(包括丢失部分寡糖的糖肽)。前者(图2中实线方框标识部分)即用作XIC筛选,后者在谱图中表现为具有单糖特征的质量差值的一组质谱峰(图2中虚线方框标识部分)。另外,仅带最内侧乙酰葡糖胺的糖肽峰(图2中椭圆框标识部分)在实验中往往呈现出较高的峰强,该离子常被挑选作为第三级质谱分析对象,以进一步确定糖基化位点。
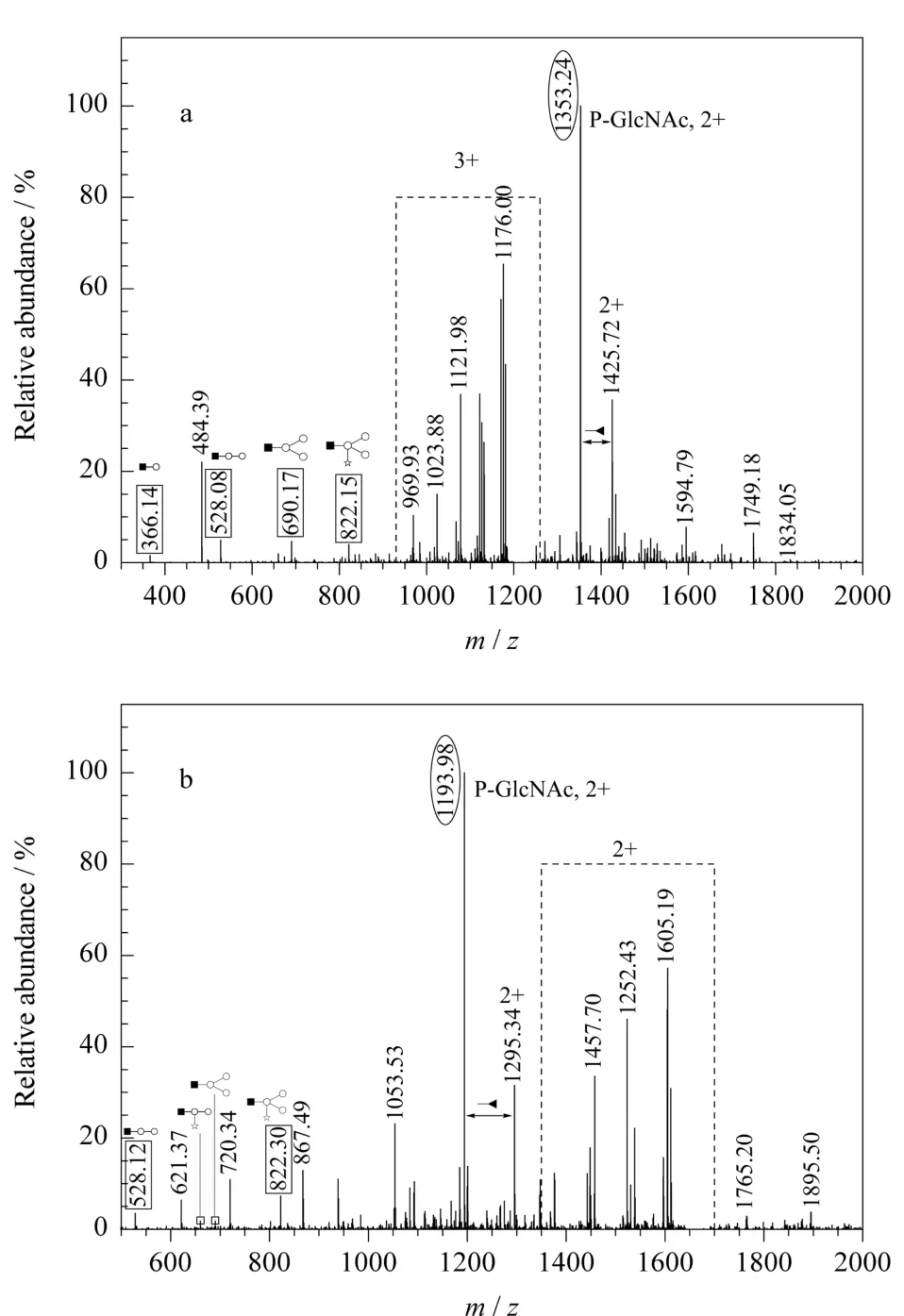
图2 糖肽((a)m/z1225.2,正三价离子(3+)和(b)m/z 1678.2,正二价离子(2+))的ES I-M S/M S谱图Fig.2 Tandem mass spectra of two glycopeptides of(a)m/z1225.2,chargestate3+and(b)m/z 1678.2,chargestate2+by ES Iana lysis The symbols are the same as in Fig.1.
2.3 MALD I和ES I-M S/M S解析糖肽的比较
我们对两种方式产生的串联质谱图进行了详尽的筛选和确认,以尽可能获得全面的目标蛋白质的糖基化信息,结果如表1所示,得到确认的位点(包括其糖链结构)为7个。根据N etNG lyc(蛋白质的N-型糖基化位点预测软件(http://www.cbs.dtu.dk/services/N etNG lyc/)的预测,HRP氨基酸序列中的9个NXS/T结构发生糖基化的可能性(表1中的potential)各有不同,例如,N287在进行蛋白质鉴定时即已被覆盖,说明其未发生糖基化(或仅部分发生糖基化),这与预测结果相符(“-”),表现合理。另外,位点N187(“++”)所在糖肽实际上也被检测到,但是由于该糖肽包含两个发生糖基化的位点(另一个为N199),我们未能通过手工分析从其谱图中获取足够的信息说明该位点的糖链结构。
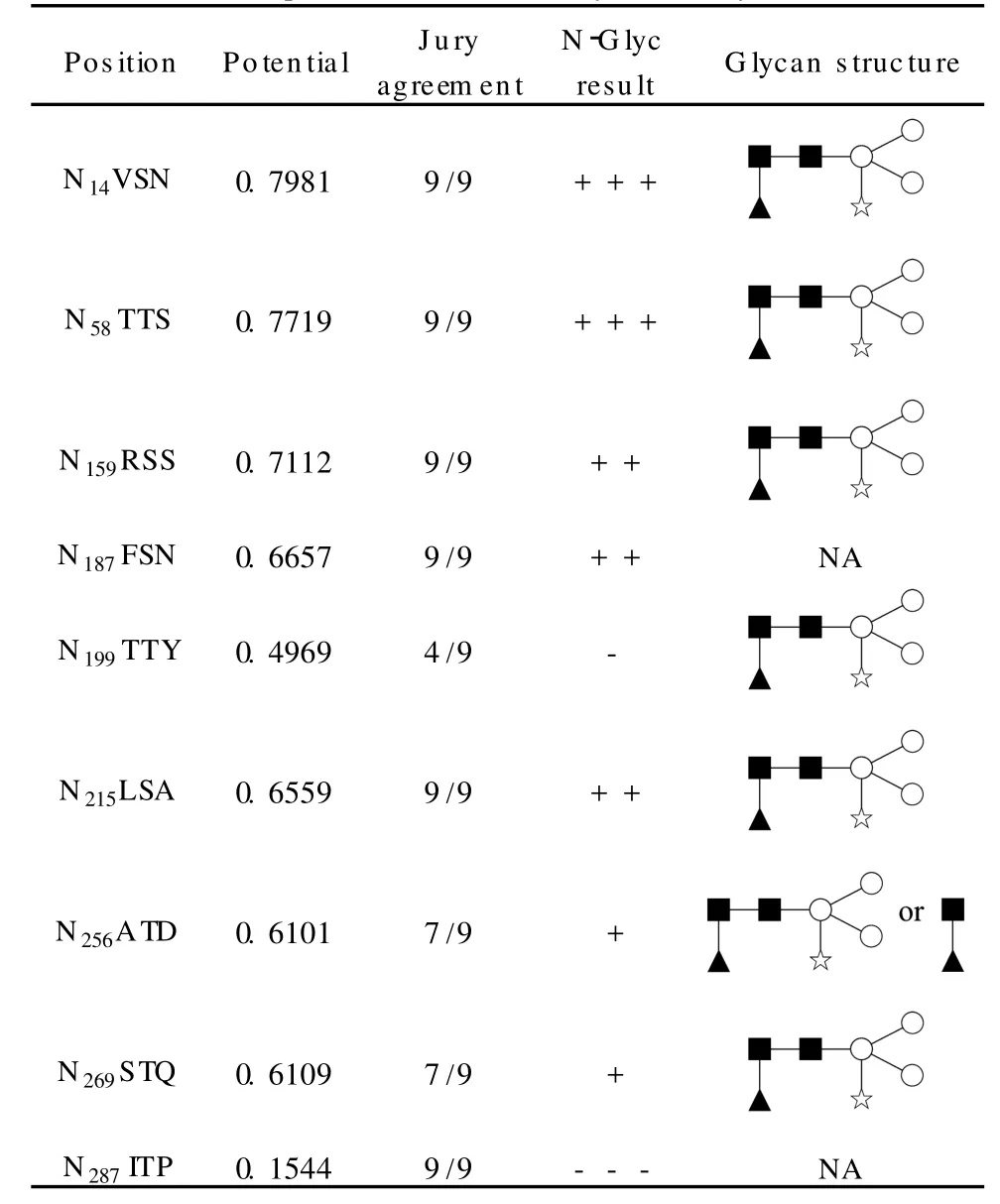
表1 HRP糖基化位点和相应的糖链结构及N e tNG lyc预测结果*Table1 Glycosites and corresponding glycanstructures and prediction results by NetNGlyc*
MALD I和ESI质谱在CID模式下产生的糖肽串联质谱图均主要表现为糖链的碎裂,而肽段部分碎裂处于次要。在涉及具体的结构解析和位点确定时,两种方式各有优劣。首先,对于未在肽段水平上进行富集的样品,在定位糖肽方面,LC-ESI方式较MALD I更客观、方便:ESI-MS/MS低分子质量端呈现的寡糖碎片是对糖肽进行定位和确认的重要依据之一,XIC方式可便捷地提供这样的信息,这较于MALD I方式(受到基质峰和扫描范围限制)只能在PM F中手工寻找更为方便。其次,对于糖链结构的解析,ESI方式提供的糖链组成信息更完全:糖肽相关峰特别是糖链最内侧G lcNAc后端糖链丢失后的相关的质谱峰(如图3中虚线框内部分),在ESIMS/MS中表现为有特征质量差值的峰连续出现(如图2虚线框标识);而MALD I-MS/MS中呈现出一个断层(如图1中659的质量差),虽然单糖有特征质量,可以从质量差上面推导出其组成,但若遭遇结构比较复杂的糖肽其可靠性则有待考察。再次,对于糖基化位点的确定,MALD I方式能较为准确地指示肽段的Mr:MALD I-MS/MS引起最内侧G lc-NAc跨环断裂,产生具有特征质量差值的3个连续峰(P,P*,P-G lcNAc)是N-糖基化肽碎裂的普遍特征,而ESI方式在肽段部分虽然也有一定的规律(如图2),在实验中P-G lcNAc均表现为强度最强的峰,但仅凭强度来判断比较牵强,易受干扰,一般需要三级质谱确定(三级谱图中会出现类似MALD I二级谱图的3个特征连续峰,图略)。
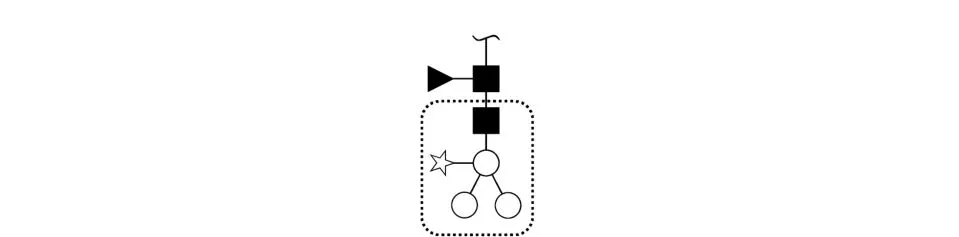
图3 HRP糖链结构示意图Fig.3 G lycan structu re of HRP
另外,两者同样都遇到谱图解析的问题:首先,此处HRP糖链较短,结构容易根据生物学合成方式推断,对于其他带较长糖链的肽段,连接方式的各种可能性大量增加,仅靠串联质谱图中的单糖特征质量差来判断,信息量显然不足,这需要软件的协助以及结合其他分析手段(如气相色谱-质谱联用等);其次,谱图中存在的可以进一步证明肽段来源和糖基化位点的b和y离子(包括带糖链或不完整糖链的b和y离子),在人工分析不完善的情况下,若有软件协助挖掘,则可充分利用串联质谱图获得更可靠的糖基化信息。
3 结论
完整糖肽结构的分析因其重要性备受科研工作者的关注。由于目前没有一种方法能全面地获得糖肽结构的所有信息,所以各种手段的联合使用显得尤为重要。除了互补地使用MALD I和ESI两种软电离技术之外,负离子检测模式[20]以及C ID和ETD(electron transfer dissociation)两种离子化方式的联合[21],虽还未形成通量化的成果,但也正在越来越多地应用到这个领域。另外,糖肽解析软件也亟待开发完善,以便快速、客观、全面地获得糖肽结构信息。
[1] Apweiler R,Herm jakob H,Sharon N.Biochim Biophys Acta,1999,1473(1):4
[2] Dube D H,Bertozzi C R.Nat Rev Drug Discov,2005,4(6):477
[3] Taylor A D,Hancock W S,Hincap e M,et al.Genome M ed,2009,1(6):57
[4] Sun BY,Ranish J A,U tleg A G,et al.Mol Cell Proteomics,2007,6(1):141
[5] Liu T,Q ian W J,Gritsenko M A,et al.mol Cell Proteomics,2006,5(10):1899
[6] Schiess R,M ueller L N,Schm idt A,et al.mol Cell Proteomics,2009,8(4):624
[7] Cao J,Shen C P,Wang H,et al.J Proteome Res,2009,8(2):662
[8] Chen R,Jiang X N,Sun D G,et al.J Proteome Res,2009,8(2):651
[9] Alvarez-Manilla G,Warren N L,Abney T,et al.Glycobiology,2007,17(7):677
[10] Toyoda M,Ito H,Matsuno Y,et al.Anal Chem,2008,80(13):5211
[11] Kim Y G,Gil G C,Jang K S,et al.J mass Spectrom,2009,44(7):1087
[12] Seipert R R,Dodds E D,Levrilla C B.J Proteom e Res,2009,8(2):493
[13] Peltoniem i H,Joenvaara S,Renkonen R.Glycobiolgy,2009,19(7):707
[14] Dalpathado D S,Desaire H.Analyst,2008,133(6):731
[15] Zhou W,Liu X H,Zhou X W,et al.Chinese Journal of Chromatography(周玮,刘晓慧,周新文,等.色谱),2007,25(5):623
[16] Morelle W,M ichalski J C.Nat Protoc,2007,2(7):1585
[17] WuhrerM,Catalina M I,DeelderA M,et al.J Chromatogr B,2007,849(1/2):115
[18] Wada Y,TajiriM,Yoshida S.Anal Chem,2004,76(22):6560
[19] Dom on B,Costello C E.Glycoconjugate J,1988,5(4):397
[20] Motari E,Zheng X C,Su X D,et al.Am J B iom ed Sci,2009,1(1):1
[21] Perdivara I,Petrovich R,Allinquant B.J Proteom e Res,2009,8(2):631
Combination of matrix-assisted laser desorption ionization and electrospray ionization mass spectrometry for the analysis
of in tactgly copeptides from horse radish peroxidase
CHEN Yaohan1,2,YAN Guoquan1,ZHOU Xinwen2,YANG Pengyuan1,2*
(1.Department of Chemistry,Fudan University,Shanghai 200032,China;2.Institutes of Biomedica l Sciences,Fudan University,Shanghai 200032,China)
O658
A
1000-8713(2010)02-0135-05
*通讯联系人:杨芃原,教授,博士生导师.Tel:(021)54237416,E-m ail:pyyang@fudan.edu.cn.
国家自然科学基金课题(Nos.20735005,20975024)、国家“863”课题(No.2006AA02A308)和上海市科委课题(No.07JC140030).
2009-10-17
DO I:10.3724/SP.J.1123.2010.00135
