花生致敏糖蛋白Ara h1糖链决定簇的质谱分析
2016-11-03彭艺芳王承健王晶晶李玲梅晋万军师红丹黄琳娟王仲孚
彭艺芳, 王承健, 王晶晶, 李玲梅, 晋万军, 强 珊, 师红丹,张 英, 黄琳娟, 王仲孚
(西部资源生物与现代生物技术教育部重点实验室, 陕西省生物技术重点实验室,西北大学生命科学学院, 西安 710069)
花生致敏糖蛋白Ara h1糖链决定簇的质谱分析
彭艺芳, 王承健, 王晶晶, 李玲梅, 晋万军, 强珊, 师红丹,张英, 黄琳娟, 王仲孚
(西部资源生物与现代生物技术教育部重点实验室, 陕西省生物技术重点实验室,西北大学生命科学学院, 西安 710069)
以花生种子总蛋白及其主要致敏糖蛋白Ara h1为研究对象, 采用“一釜法”对蛋白上的糖链进行释放并同时进行衍生化标记, 通过C18固相萃取柱纯化, 以电喷雾质谱(ESI-MS)、 多级串联质谱(MSn)和亲水性液相色谱-质谱联用(HILIC-MS)进行结构解析和定量分析. 结果表明, 蛋白Ara h1共有10条N-糖链, 其中7条为高甘露糖型, 2条为木糖修饰, 另外1条为与过敏原相关的核心α1,3-Fuc修饰N-糖链, 其含量约占总糖链的12.45%.
花生过敏; 致敏糖蛋白Ara h1; 糖链结构; 电喷雾质谱; 亲水性液相色谱-质谱联用
食物过敏是一类人体由于摄入某些食物而产生的变态反应, 患者可表现出过敏性休克、 荨麻疹等症状, 严重时甚至危及生命[1,2]. 在发达国家成人食物过敏的患病率约为1%~2%, 而儿童则达到4%~8%[3,4]. 目前, 世界卫生组织和农业组织认定的可引起人体过敏的食物有牛奶、 鸡蛋、 大豆、 花生、 小麦、 坚果类、 鱼及贝壳类海产品等8类, 其中90%均能被过敏患者的血清识别, 而花生过敏则占到食物过敏的10%~47%[5,6]. 迄今, 已经被国际过敏原命名小组(JUIC)确认的花生过敏原有11种(Ara h1~Ara h11), 其中Ara h1和Ara h2是主要的过敏原, 可被90%的花生过敏患者血清识别[7].
研究发现, 糖基化蛋白在过敏反应中发挥着重要作用, 而且蛋白上含有核心α1,3-Fuc修饰N-糖链是过敏反应中IgE抗体识别的重要抗原表位[8,9]. 因此, 核心α1,3-Fuc修饰N-糖链的定性和定量分析对食物过敏研究具有重要意义. Ree等[8]和Kolarich[10]等以PNGase F酶解法释放并分析了过敏蛋白Ara h1上的N-糖链结构, 但是由于所用的酶具有局限性, 不能完全释放蛋白上的所有糖链, 导致丢失了部分结构信息. 因此, 有必要采用其它方法进一步对Ara h1上的糖链结构进行全面研究.
近年来, 我们[11]建立了一种可以定量释放植物糖蛋白上所有N-糖链的方法, 再加之生物质谱技术(Bio-MS)的快速发展, 为蛋白质组学和糖组学研究提供了重要手段[12,13]. 基于此, 为了进一步研究过敏蛋白Ara h1上的糖链结构, 本文以花生种子总蛋白和过敏蛋白Ara h1为对象, 采用本课题组[14]发展的可进行糖蛋白N-糖链的非还原性释放及同时标记1-苯基-3-甲基-5-吡唑啉酮(PMP)的“一釜法”, 替代传统的酶法释放糖蛋白上的糖链, 并通过电喷雾质谱(ESI-MS)、 多级串联质谱(MSn)和亲水液相色谱-质谱联用(HILIC-MS)等方法对糖链进行定性和定量分析, 为花生过敏原糖链决定簇的致敏性研究提供了参考.
1 实验部分
1.1试剂与仪器
河南新花生(白沙)购自超市; 糖苷酶F(PNGase F)和糖苷酶A(PNGase A)购自Sigma-Aldrich公司; 1-苯基-3-甲基-5-吡唑啉酮(PMP)购自阿拉丁公司; 标准蛋白Markers购自美国Fermentas公司; 透析袋(截留分子量8000~14000); 十二烷基磺酸钠(SDS)、 乙基苯基聚乙二醇(NP-40)、 二硫苏糖醇(DTT)、 硫酸铵、 甲醇、 乙腈、 丙酮和二氯甲烷等均为分析纯.
DD-5M型低温离心机(湖南湘仪离心机仪器有限公司); 超低温HetoPowerDry LL3000型真空冷冻干燥仪(丹麦Heto-Holten公司); DYY-6C型电泳仪(北京六一仪器厂); 石墨碳柱(150 mg/4 mL, 美国Alltech Associates公司); C18柱(100 mg/mL, 美国Waters公司); LTQ-XL电喷雾电离质谱仪(美国Thermo Scientific公司).
1.2实验过程
1.2.1花生总蛋白的提取新鲜花生去除红衣, 用粉碎机粉碎. 将花生粉末与丙酮按照1 g/10 mL比例混合, 于4 ℃下搅拌2 h脱脂, 然后在4 ℃下离心30 min(8000 r/min), 弃去上层清液, 将所得沉淀反复脱脂2次, 风干后得到脱脂花生粉. 将脱脂花生粉与Tris-HCl缓冲液(50 mmol/L, pH=8.0)按照1 g/10 mL比例混合, 于4 ℃下搅拌12 h, 然后在4 ℃下离心30 min(10000 r/min), 取上层清液. 向沉淀中加入Tris-HCl缓冲液(50 mmol/L, pH=8.0)重复浸提2次, 将所得上层清液合并, 取部分冷冻干燥, 即得花生总蛋白, 于-20 ℃保存.
1.2.2Ara h1的分离纯化将上述所得上层清液边搅拌边缓慢加入一定量的硫酸铵粉末, 使其充分溶解并使其饱和度分别达到10%和100%, 然后于4 ℃下离心10 min(11500 r/min). 将100%饱和度所得沉淀溶解后装入透析袋, 在4 ℃下透析2 d(每天换水3次). 对透析后的溶液进行冷冻干燥, 得到花生粗蛋白粉末, 于-20 ℃保存.
称取花生粗蛋白粉末100 mg, 溶于1.5 mL Tris-HCl缓冲液(50 mmol/L, pH=8.0)中, 振荡, 离心, 上样至用Tris-HCl缓冲液(50 mmol/L, pH=8.0)洗脱平衡后的DEAE-sepharose fast flow阴离子交换柱, 采用含有0~0.4 mol/L NaCl的Tris-HCl缓冲液进行梯度洗脱, 流速约为1 mL/min, 5 mL/管, 收集洗脱液, 在280 nm波长下测定吸光值. 根据吸光值, 分管收集样品, 透析, 冷冻干燥, 得到纯度较高的过敏蛋白Ara h1[15].
1.2.3蛋白Ara h1的纯度鉴定及胶条蛋白的回收采用浓度为12%的分离胶, 3%的浓缩胶, 对花生总蛋白样品进行SDS-PAGE分析; 然后用考马斯亮蓝G-250染色, 再用脱色液进行脱色; 最后使用凝胶成像仪分析胶片. 收集电泳所得胶片, 将目的条带用刀片切下回收, 加入乙腈(体积分数50%)进行脱色, 然后研磨, 干燥, 得到含目的蛋白的凝胶粉末, 于-20 ℃保存.
1.2.4花生总蛋白糖链的PNGase F酶解法释放和纯化称取10 mg花生总蛋白, 加入700 μL水和80 μL蛋白变性液(含有4.96 mg DTT和4 mg SDS), 于100 ℃干热变性10 min, 冷却至室温. 加入80 μL磷酸钠缓冲液(1 mol/L, pH=7.5)和80 μLNP-40溶液(体积分数10%), 再加入2 μL PNGase F, 于37 ℃反应24 h. 反应结束后样品用C18小柱和石墨碳柱纯化, 纯化方法参照文献[16,17], 纯化后得到花生总蛋白糖链样品, 干燥浓缩后于-20 ℃保存, 用于PMP衍生化和ESI-MS分析.
1.2.5花生总蛋白糖链PNGase A酶解法释放和纯化称取10 mg花生总蛋白, 将其溶于2.5 mL含有6 mg胃蛋白酶的盐酸缓冲液(pH=2)中, 于37 ℃反应16 h, 反应结束后于100 ℃干热5 min. 将样品用氮气吹干, 加入2 mL柠檬酸缓冲液(0.1 mol/L, pH=5)和2.5 μL PNGase A, 于37 ℃反应48 h. 反应结束后参照文献[18]用C18小柱和石墨碳柱纯化, 纯化后得到花生总蛋白糖链样品, 干燥浓缩后于-20 ℃保存, 用于PMP衍生化和ESI-MS分析.
1.2.6还原性糖链的PMP衍生化将酶解后的糖链样品旋转蒸干, 加入1 mL 0.3 mol/L NaOH溶液和1 mL(0.5 mol/L) PMP-甲醇溶液, 于70 ℃反应30 min. 反应结束后, 参照文献[19]方法用C18小柱纯化, 纯化后得到糖链样品, 干燥浓缩后于-20 ℃保存, 用于ESI-MS分析.
1.2.7花生总蛋白和蛋白Ara h1糖链的“一釜法”释放称取花生总蛋白10 mg, 加入含有0.7 mol/L PMP的NaOH溶液8 mL, 充分摇匀后, 于75 ℃反应32 h. 另外称取10 mg总蛋白进行凝胶电泳, 切胶回收所有过敏蛋白Ara h1条带, 向凝胶粉末中加入上述PMP-NaOH溶液, 于75 ℃反应32 h. 反应结束后, 参照文献[14]方法用C18小柱纯化糖链, 得到衍生化的总蛋白和Ara h1糖链样品, 干燥浓缩后于-20 ℃保存, 用于ESI-MS分析.
1.2.8糖链样品的全甲基化首先向干燥的糖链样品中加入500 μL DMSO, 迅速封口后超声5 min, 使样品充分溶解, 然后加入1/2体积的干燥NaOH粉末, 封口后超声1 h. 反应结束后, 用滴管缓慢滴加500 μL CH3I, 室温下避光振荡2 h. 待反应完成后, 参照文献[20]方法, 萃取糖链样品得到全甲基化的糖链, 用于MSn检测分析.
1.2.9质谱分析条件一级质谱参数:离子源电喷雾(ESI)电压4000 V, 辅助气体压力0.507 MPa, 鞘气压力3.04 MPa, 毛细管电压350 V, 毛细管温度275 ℃, 毛细管透镜电压250 V, 上样量2 μL, 流速200 μL/min, 流动相为V(水)∶V(甲醇)=1∶1, 正离子模式扫描, 扫描范围m/z900~2000. 二级质谱参数:离子源电喷雾(ESI)电压4000 V, 辅助气体压力0.507 MPa, 鞘气压力2.03 MPa, 毛细管电压37 V, 毛细管温度300 ℃, 毛细管透镜电压250 V, 上样量2 μL, 流速20 μL/min, 流动相为V(水)∶V(甲醇)=1∶1, 碰撞气体为氦气, 狭缝宽度m/z3.0, 归一化碰撞能量为50%. 扫描数据由Xcalibur软件采集. 通过GlycoWorkbench软件进一步对多级裂解所得碎片进行分析确认. HILIC-MS分析条件参考文献[21].
2 结果与讨论
2.1花生总蛋白的SDS-PAGE分离及Ara h1纯度的鉴定
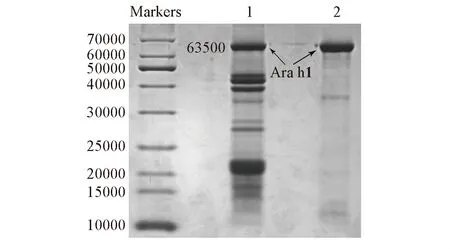
Fig.1 Purity evaluation for the purified Ara h1 by SDS-PAGE Lane 1 is the total protein, lane 2 is the purified Ara h1.
对花生总蛋白和纯化所得过敏蛋白Ara h1进行SDS-PAGE分析, 结果如图1所示. 泳道1为总蛋白, 泳道2为蛋白Ara h1. 结果表明, 经过脱脂、 浸提等步骤后得到的总蛋白共有10条带, 结合文献[15,22]报道可知, 最上面一条分子量约为63500的条带为过敏蛋白Ara h1, 其余各条带可能是过敏蛋白Ara h3和Ara h2的不同亚基. 经过阴离子柱层析纯化后, 得到的蛋白几乎只含有蛋白Ara h1这一条带(图1泳道2), 证明纯化后所得蛋白纯度较高, 可用于进一步的糖链分析研究.
2.2花生总蛋白及Ara h1糖链的质谱分析
为了确定花生种子总蛋白上的糖链种类, 首先以不同的方法释放总蛋白上的糖链, 质谱检测结果如图S1(A)~(C)所示(见本文支持信息). 由图S1(A)可知, 采用PNGase F酶解法得到的总蛋白糖链共有9种, 其中,m/z1045.37和1126.08均为[M+H+K]2+型双电荷离子峰, 其余均为单电荷[M+Na]+型离子峰. 由图S1(B)和(C)可知, 运用化学法和PNGase A酶解法所释放的花生总蛋白糖链数目一致, 均为10条, 其中,m/z1045.25和1126.15为[M+H+K]2+型离子峰,m/z1373.42为[M+H]+型离子峰, 其余都为[M+Na]+型离子峰. 通过比较这3种方法所得总蛋白糖链后发现, PNGase F酶法比其它2种方法少了1条m/z1541.33的糖链, 通过GlycoWorkbench软件预测可知该糖链含有1个Fuc残基, 而其余各条糖链均相同. PNGase F酶解法没有释放核心α1,3-Fuc修饰N-糖链的活性, 而PNGase A酶解法与化学法对N-糖链的释放则没有这种选择性, 因此可以推测,m/z1541.33很可能是1条核心α1,3-Fuc修饰的N-糖链. 但是, 此结构尚需其它分析手段进行分析和验证.
图S1(D)为化学法释放的切胶所得过敏蛋白Ara h1的糖链质谱图. 通过对比发现, 运用化学法释放的过敏蛋白Ara h1糖链的种类与化学法释放的总蛋白糖链一致, 均为10条. 这说明过敏蛋白Ara h1是花生中主要的糖蛋白, 而且很可能带有核心α1,3-Fuc修饰N-糖链.
2.3花生总蛋白及Ara h1糖链的HILIC-MS和MSn分析
由于相同分子量的糖链可能会存在同分异构体, 为了进一步分析糖链结构, 对所得糖链进行了在线HILIC-MS和MS/MS分析, 所得萃取离子流色谱图(EIC)如图S2所示(见本文支持信息), MS/MS分析结果如图S3所示(见本文支持信息).
图S2(A1~A10)~(C1~C10)为不同方法释放所得总蛋白N-糖链的EIC图谱, 通过比较发现, 酶法与化学法所得同一种糖链的出峰时间基本一致, 而且所有糖链均未发现同分异构体的存在. 图S2(D1~D10)为化学法释放的过敏蛋白Ara h1糖链的EIC图谱, 其数目、 种类及出峰时间均与总蛋白基本一致.
图S2(B1~B10)~(D1~D10)显示提取的m/z1557.25的离子流中出现了2个峰, 经过分析后发现出峰时间在54 min后的峰为m/z1541.33所对应糖链的[M+K]+型离子峰, 而不是m/z1557.25所对应糖链的同分异构体. 此外, 在PNGase F酶解法释放的糖链中未提取到m/z1541.33的离子峰, 而其它2种方法在对应的时间上都有显著的离子信号, 而且均为单一色谱峰.
通过MS/MS分析得到了各种糖链的序列结构信息(见图S3). 通过分析m/z1541.25这条糖链的MS/MS谱图, 发现2个m/z分别为1395.33和712.17的特征峰, 通过计算该糖链残基的分子量可知, 当糖链脱掉1个分子量为146的残基和132的残基时, 可以产生这2个特征峰, 同时结合文献[8]报道的植物中所含该分子量的残基为Fuc和Xyl, 确定m/z1541.25是1条同时含有Xyl与核心Fuc残基的糖链. 因此, 结合上述MS与在线HILIC-MS分析结果可以确定, 花生总蛋白与Ara h1均含有1条同时被Xyl与核心α1,3-Fuc修饰的N-糖链. 此外, 还新发现了m/z1045.25, 1126.10, 1263.17和1911.67其它4条糖链的存在.
2.4过敏蛋白糖链结构的全甲基化及MSn分析
甲基化属于一种常见的糖链衍生化分析方法, 经过甲基化后的糖链疏水性增强; 且未经过甲基化处理时, 糖链发生穿环裂解后在不同部位发生断裂, 产生的裂解碎片不具有唯一性, 无法准确判定糖链的连接方式. 经甲基化处理后, 采用MSn分析时会产生一系列特征性的碎片离子峰, 从而可精确判定糖链的连接方式. 因此, 为了进一步分析各种糖链的连接方式, 并对其序列结构进行验证, 本文对各种糖链进行全甲基化衍生, 然后进行了MSn分析.
如图S4(见本文支持信息)所示, 糖链H3N2FucXyl(PMP)2(m/z1541.25)经过全甲基化衍生后, 变为m/z1863.50, 以MSn进行分析时产生一系列碎片离子峰. 所选择的MSn裂解路径如下:MS2(m/z1054.33)→MS3(m/z880.17)→MS4(m/z635.25)→MS5(m/z417.17)→MS6(m/z199.92). 通过计算谱图中的离子碎片峰分子量, 结合GlycoWorkbench软件对这些碎片离子峰进行归属, 发现当N-乙酰葡糖胺的2,4位糖苷键发生穿环裂解断裂后, 连接在该糖残基3位C上的Fuc会脱落, 此时形成的碎片分子量为1302.17. 若是1,6连接的Fuc, 则不会形成这样的碎片, 因此可以确定Fuc的连接方式为α1,3. 另外, 发现当与木糖相连的甘露糖0,4位糖苷键发生穿环裂解后会形成分子量为1585.42的离子峰, 再结合文献[8,10]对花生过敏蛋白Ara h1糖链的结构研究结果, 可以确定出Xyl的连接方式为β1,2. 这表明该糖链为同时带有β1,2-Xyl修饰与核心α1,3-Fuc修饰N-糖链. 其它糖链的分析结果均与此类似. 由此可以进一步确定, 花生总蛋白与Ara h1均含有同时被β1,2-Xyl与核心α1,3-Fuc修饰N-糖链.
2.5花生总蛋白及Ara h1糖链的定量分析
基于质谱和液相色谱质谱联用分析所得数据, 对花生过敏蛋白Ara h1糖链的单糖组成、 分子量、 离子型、 糖结构、 出峰时间、 糖型及释放方法等数据进行归纳总结, 结果如表1所示.
根据各种糖链的EIC色谱峰面积可计算出每条糖链在总糖链中所占比例, 结果示于图2. 可见, “一釜法”与PNGase A酶解法释放的部分糖链在丰度分布上存在一定差异, 尤其是“一釜法”对核心α1,3-Fuc修饰N-糖链的释放效率明显高于PNGase A酶法. 另外, 发现总蛋白中的糖链含量与过敏蛋白Ara h1的糖链在丰度分布上几乎一致, 表明在花生蛋白中Ara h1是主要的过敏原糖蛋白.
另外, 对不同糖链的糖型及其所占比例进行了分析, 统计结果如图3所示. 可见, 过敏蛋白Ara h1的糖链可分为核心五糖结构、 杂合型、 复杂型和高甘露糖型4种类型. 其中, 五糖核心型糖链有1条, 占总糖链的3.58%; 复杂型糖链有2条, 占22.07%; 杂合型糖链有1条, 占29.10%; 高甘露糖型糖链有6条, 占45.25%. 在所有类型糖链中高甘露糖型所占比例最高. 值得注意的是, 致敏蛋白Ara h1中核心α1,3-Fuc修饰N-糖链占到了总糖链的12.45%, 说明致敏蛋白Ara h1具有过敏相关糖链决定簇结构.

Table 1 Compositions, proposed structures, release methods and types of N-glycans from Ara h1
a. [M+H]+;b. [M+Na]+;c. [M+K]+;d. [M+H+K]2+. H:Hexose; N:N-acetyl hexosamine; F:fucose; X:xylose.

Fig.2 Quantitative analysis of the N-glycans released by three different methodsa.; b.; c.; d.; e.; f.; g.; h.; i.; j..
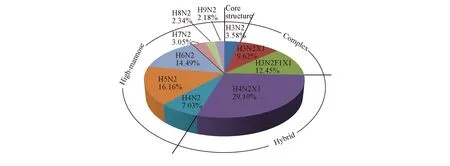
Fig.3 Quantitative analysis of the N-glycans released from Ara h1
3 结 论
通过MS, HILIC-MS及MSn分析, 发现花生总蛋白与致敏蛋白Ara h1均含有典型的核心α1,3-Fuc修饰及β1,2-Xyl修饰的糖链, 其PMP标记物在MS分析中的质荷比为1541.33, 无同分异构体存在, 其单糖组成为H3N2FucXyl, 含量约占总糖链的12.45%. 此外, 还发现了3条高甘露糖型糖链H7N2, H8N2和H9N2, 以及1条五糖核心型糖链H3N2. 研究结果表明, 本实验室发展的化学法可以完全释放含有核心α1,3-Fuc修饰的糖链, 且释放效率较高, 因此在研究过敏蛋白糖链结构上值得推广.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160147.
[1]Sampson H. A., Mendelson L., Rosen J. P.,NewEngl.J.Med., 1992, 327(6), 380—384
[2]Sicherer S. H., Burks A. W., Sampson H. A.,Pediatrics, 1998, 102(1), 1—6
[3]Sampson H. A.,J.AllergyClin.Immun., 1999, 103, 717—728
[4]Mills E. N. C., Mackie A. R., Burney P., Beyer K., Frewe L., Madsen C., Botjes E., Crevel R. W. R., Van R. R.,Allergy, 2007, 62(7), 717—722
[5]Poms R. E., Capelletti C., Anklam E.,Mol.Nutr.FoodRes., 2004, 48(6), 459—464
[6]Li H., Zhang H. Y.,Chin.J.Microbiol.Immunol., 2001, 4(21, Suppl.), 12—15(李宏, 张宏誉. 中华微生物学和免疫学杂志, 2001, 4(21, 增刊), 12—15)
[7]Pele M.,Rom.Biotech.Lett., 2010, 15(2), 5204—5212
[8]Ree R. V., Cabanes-Macheteau M., Akkerdaas J., Milazzo J. P., Loutelier-Bourhis C., Rayon C., Villalba M., Koppelman S., Aalberse R., Rodriguez R., Faye L., Lerouge P.,J.Biol.Chem., 2000, 275(15), 11451—11458
[9]Hantusch J. B.,J.AllergyClin.Immun., 2008, 121(1), 185—190
[10]Kolarich D., Altmann F.,Anal.Biochem., 2000, 285(1), 64—75
[11]Wang C. J., Wang Z. F.,Chin.Bull.LifeSci., 2011, 23(6), 569—576(王承健, 王仲孚. 生命科学, 2011, 23(6), 569—576)
[12]Shi M. Y., Yin L., Cai L. L., Wang C., Liu X. D., Zhao S., Sun Y. T., Fawcett J. P., Zhao L. M., Yang Y., Gu J. K.,Chem.Res.ChineseUniversities, 2014, 30(6), 900—904
[13]Pan L. L., Wang C. J., Yuan J. B., Zhang Y., Huang L. J., Wang Z. F.,Chem.J.ChineseUniversities, 2014, 35(2), 237—243(潘丽英, 王承健, 袁江北, 张英, 黄琳娟, 王仲孚. 高等学校化学学报, 2014, 35(2), 237—243)
[14]Yuan J. B., Wang C. J., Sun Y. J., Huang L. J., Wang Z. F.,Anal.Biochem., 2014, 462, 1—9
[15]Eriyanto Y., Marquis C. P., Lee N. A.,J.Agr.FoodChem., 2012, 60(41), 10352—10358
[16]Kubelka V., Altmann F., Staudacher E., Tretter V., Marz L., Hard K., Kamerling J. P., Vliegenthart J. F.,Eur.J.Biochem., 1993, 213(3), 1193—1204
[17]Cao W. Q., Huang J. M., Cao J., Yang P. Y.,Chem.Res.ChineseUniversities, 2014, 30(5), 726—730
[18]Damm J. B. L., Kamerling J. P., Dedem G. W. K. V., Vliegenthart J. F. G.,GlycoconjugateJ., 1987, 4(2), 129—144
[19]Honda S., Akao E., Suzuki S., Okuda M., Kakehi K., Nakamura J.,Anal.Biochem., 1989, 180(2), 351—357
[20]Solouki T., Reinhold B. B., Costello C. E., O’Malley M., Guan S., Marshall A. G.,Anal.Chem., 1998, 70(5), 857—864
[21]Wang C. J., Yuan J. B., Wang Z. F., Huang L. J.,J.Chromatogr.A, 2013, 1274(2), 107—117
[22]Masuyama K., Yamamoto K., Ito K., Kitagawa E., Yamaki K.,J.FoodSci.Tech.Mys., 2014, 20(4), 875—881
(Ed.:P, H, F, K)
† Supported by the National Natural Science Foundation of China(Nos.21375103, 31370804).
Analysis of Antigenic Determinant Glycans of Peanut Allergy Glycoprotein Ara h1 by Mass Spectrometry†
PENG Yifang, WANG Chengjian, WANG Jingjing, LI Lingmei, JIN Wanjun, QIANG Shan,SHI Hongdan, ZHANG Ying, HUANG Linjuan, WANG Zhongfu*
(Key Laboratory of Resource Biology and Biotechnology in Western China, Ministry of Education,ProvincialKeyLaboratoryofBiotechnology,CollegeofLifeSciences,NorthwestUniversity,Xi'an710069,China)
Peanut seed total protein and glycoprotein Ara h1, which can cause allergic reactions, were chosen as the target materials in this study. Firstly, the glycans were released and labeled with 1-phenyl-3-methyl-5-pyrazolone(PMP) by recently developed “one-pot” method. Subsequently, the glycans were fractionated and enriched through C18 solid phase extraction column. Finally, the obtained glycans were analysed by electrospray ionization mass spectrometry(ESI-MS), MSnand Hydrophilic interaction liquid chsomatography-mass spectrometry(HILIC-MS). The results indicated that Ara h1 has tenN-glycans, including seven high-mannose type, two ones with xylose modification, and one allergenic coreα1,3-fucosylatedN-glycan, the content of which is 12.45% of total glycans.
Peanut allergy; Allergenic glycoprotein Ara h1; Glycan structure; Electrospray ionization mass spectrometry(ESI-MS); Hydrophilic interaction liquid chsomatography-mass spectrometry(HILIC-MS)
10.7503/cjcu20160147
2016-03-14. 网络出版日期:2016-08-26.
国家自然科学基金(批准号:21375103, 31370804)资助.
O657.6; O629.12
A
联系人简介:王仲孚, 男, 博士, 教授, 博士生导师, 主要从事糖生物学与糖工程研究. E-mail:wangzhf@nwu.edu.cn
