脱细胞神经移植物对骨髓间充质干细胞的诱导分化
2010-09-11何红云佟晓杰邓仪昊张本斯
何红云佟晓杰邓仪昊张本斯
(1云南省大理市大理学院基础医学院人体解剖学教研室,大理,671000;2中国医科大学基础医学院人体解剖与组织胚胎学教研室,沈阳,110001)
脱细胞神经移植物对骨髓间充质干细胞的诱导分化
何红云1*佟晓杰2邓仪昊1张本斯1
(1云南省大理市大理学院基础医学院人体解剖学教研室,大理,671000;2中国医科大学基础医学院人体解剖与组织胚胎学教研室,沈阳,110001)
目的 探讨脱细胞神经移植物诱导大鼠骨髓间充质干细胞分化为施旺细胞样细胞的可行性。方法 将分离纯化的SD大鼠骨髓间充质干细胞进行体外培养扩增,行表型鉴定后,取第5代细胞,诱导组采用脱细胞神经移植物匀浆进行诱导,非诱导组加入等量无血清培养基,倒置相差显微镜观察诱导后细胞形态变化,免疫细胞化学染色检测诱导后细胞S-100,神经胶质纤维酸性蛋白(glial fibrillary acidic protein GFAP)的表达情况。结果 BMSCs表型鉴定为CD44+、CD54+、CD34-,免疫细胞化学染色GFAP、S-100的阳性表达率分别为为(42±4)%和(64±5)%。结论 脱细胞神经移植物可诱导骨髓间充质干细胞分化为施旺细胞样细胞。
脱细胞神经移植物;骨髓间充质干细胞;施旺细胞
种子细胞是周围神经组织工程研究的重点,骨髓间充质干细胞由于具有多向分化潜能,因此成为研究的热点。寻找合适的诱导剂诱导骨髓间充质干细胞分化为施旺细胞可以解决种子细胞来源不足的难题。目前诱导MSCs分化为施旺细胞的诱导剂主要是抗氧化剂、中药及其成份等,但其存在细胞毒性,诱导后细胞活性低等缺点。本研究采用脱细胞神经移植物的匀浆液对骨髓间充质干细胞进行体外诱导分化,观察此诱导剂的诱导作用,以及此诱导剂诱导后细胞的活性及其细胞毒性,评价此诱导剂较其它诱导剂的优越性。
材料和方法
1.主要仪器设备
超净工作台、二氧化碳恒温培养箱、恒温水浴箱、倒置相差显微镜(Olypmus CKX40)。
2.实验动物和试剂
取2月龄SD大鼠(体重200-250 g)6只,雌雄不限,用于制备脱细胞神经基质移植物,另取1月龄SD大鼠1只用于采集骨髓间充质干细胞进行体外培养。Triton X2100、Pepstatin A(Sigma公司)、三羟甲基胺基甲烷(Tris,Gibco公司)、Aprotinin、Leupeptin、牛胰脱氧核糖核酸酶(DNase)、牛胰核糖核酸酶(RNase)均为华美生物工程公司产品、H-DMEM(Gibco公司)、胎牛血清(杭州四季青公司)、胰蛋白酶(Gibco公司)、兔抗胶质原纤维酸性蛋白(GFAP)及兔抗S-100血清均购自武汉博士德公司。
3.脱细胞神经基质移植物诱导剂的制备
参照刘承吉等[1]“低渗脱细胞”方法制备神经基质移植物。SD大鼠5只,用戊巴比妥钠进行腹腔麻醉(40mg/kg体重),无菌条件下取双侧坐骨神经长约10mm,放于脱细胞处理盒内,两端固定。向盒内加入 0.05mol/LTris-HCl缓冲液(p H7.4)适量,再向缓冲液内加入蛋白酶抑制剂(Aprotinin 0.1μg/ml,Leupeptin 0.5μg/ml,PepstatinA 0.6μg/ml),4℃恒温震荡数天。将盒内液体换成含3%TritonX-100的 Tris-HCl缓冲液(p H7.4),并加入上述等量的蛋白酶抑制剂,4℃恒温震荡数天后,用蒸馏水连续冲洗数小时。加入DNase和RNase混合液在室温下消化2 h后,再次向盒内加入含3%TritonX-100的Tris-HCl缓冲液(p H7.6),4℃恒温震荡数天。经蒸馏水充分水洗后,电子天平称量其湿重,匀浆机制成匀浆,培养基配成溶液,作为诱导剂。
4.BMSCs的培养及纯化
无菌条件下取出SD大鼠股骨和胫骨,剪去两端骨骺,露出骨髓腔,注射器吸取 H-DMEM(含青霉素100 IU/ml、链霉素100μg/ml及胎牛血清10%),反复冲洗骨髓腔,离心、弃上清,加入培养基,制成单细胞悬液,调整细胞密度为2×106/ ml接种于50ml培养瓶中,置于5%CO2、饱和湿度37℃培养箱中培养。24 h后第一次更换培养基,换液时轻轻振荡培养瓶,吸除培养液,用PBS洗两遍,以去掉未贴壁细胞及杂细胞;此后每2 d换液 1次。待细胞铺满瓶底面积的 80%-90%, 0.25%胰酶消化,以1∶2比例进行传代培养。鉴于骨髓中各种细胞的贴壁性能不同,通过贴壁培养法结合换液可纯化骨髓间充质细胞。
5.BMSCs表面分子的鉴定
取培养的第5代细胞,调整细胞浓度为1× 105/ml接种于预置有盖片的6孔板进行爬片,待细胞长至单层融合时,PBS洗3次,4%多聚甲醛固定40min,0.5%Triton X-100破膜15min,3% H2O2封闭过氧化物酶10min,行 CD34、CD44、CD54免疫细胞化学检测。
6.骨髓间充质干细胞向Schwann细胞的诱导分化
取第5代细胞接种于6孔板进行爬片,待细胞铺满瓶底面积的80-90%时,吸去培养基,用PBS洗两次,诱导组加入无血清的H-DMEM脱细胞神经基质移植物匀浆(使诱导剂浓度为1.0mg/ml)进行定向诱导;对照组加入等量的培养基。诱导开始后,每6h倒置显微镜下观察细胞形态变化。
7.免疫细胞化学分析
诱导24 h后,同时取出诱导组和未诱导组细胞各两套,用 PBS洗两遍,4%多聚甲醛固定40 min,0.5%Triton X-100破膜15min,3%H2O2甲醇溶液处理10 min,各步骤间均用PBS洗涤两次,山羊血清封闭1h(37℃)后,分别加入兔抗大鼠S-100(1∶100)、兔抗 GFAP(1∶100),阴性对照滴加0.01mol/LPBS。湿盒中4℃过夜。次日PBS洗涤后,滴加生物素化羊抗兔 IgG,湿盒37℃,30 min,PBS冲洗,加入酶联复合物,湿盒37℃1h,PBS洗,DAB溶液显色,镜下观察以终止反应,麦氏苏木素复染,脱水,封片,镜下观察。随机选取 10个非重叠视野(×100)计算GFAP、S-100阳性细胞,并计算其占总细胞数的比例。
结 果
1.BMSCs的分离培养
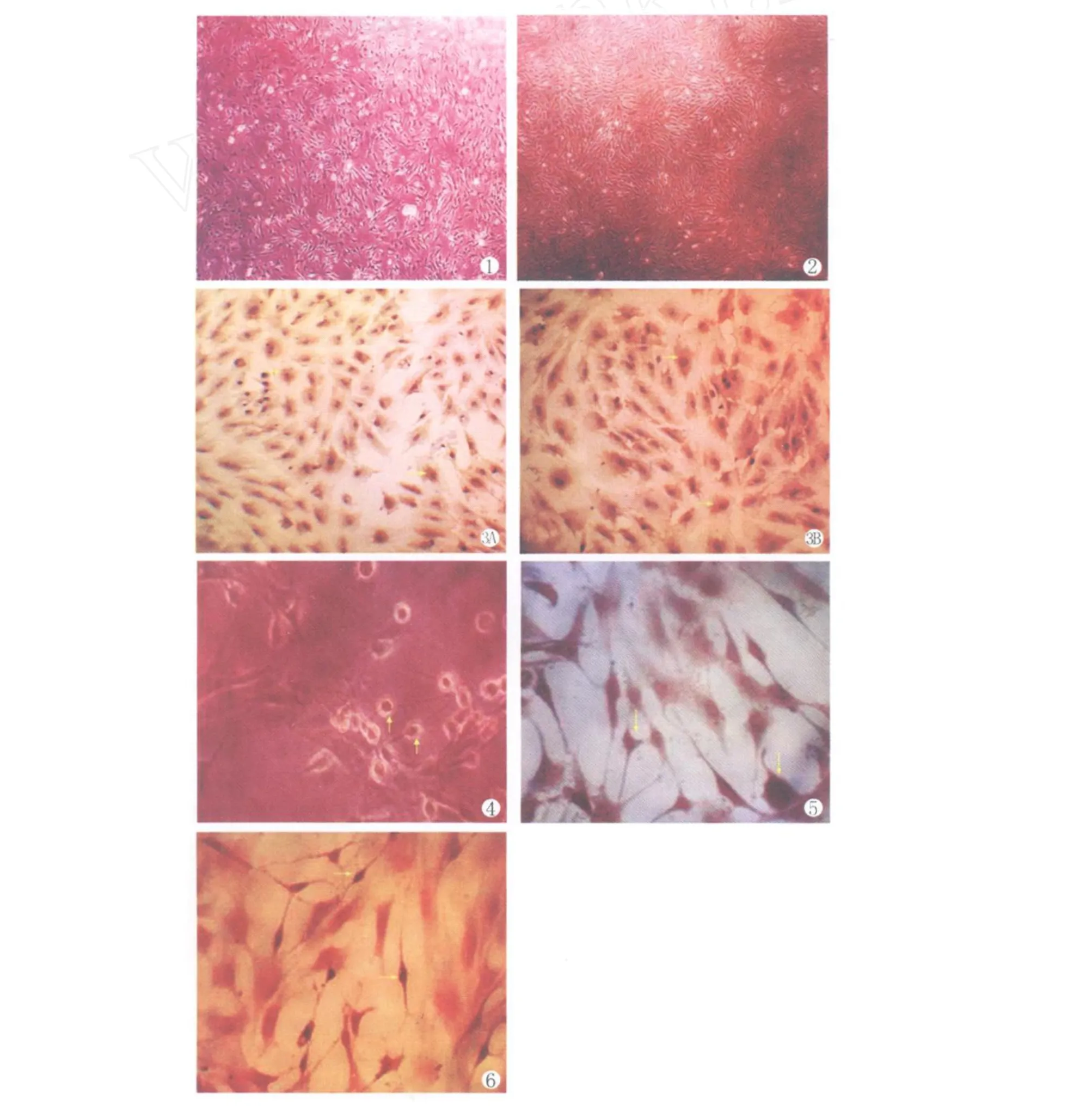
原代培养的细胞,6h开始贴壁,呈圆形,24 h后90%细胞已贴壁,换液去掉未贴壁的细胞,48 h贴壁细胞开始伸展,形态呈椭圆形、短梭形、长梭形、多角形及不规则形,这些细胞即为BMSCs形态。第4 d贴壁的细胞开始形成克隆集落,每个集落有数十个细胞不等(图1)。第4、5天时可见培养瓶底有多量散在的梭型多角型细胞,此时仍有圆型的贴壁细胞存在。至第7天细胞铺至瓶底面积90%以上,细胞形态以梭形为主(图2)。即传代,传代后细胞12 h已完全贴壁,第3天细胞数量明显增多,第5d铺满瓶底,细胞集落呈放射状或旋涡状生长,第3代后的细胞形态已呈均一的长梭型,生长活力明显增强,2-3d即可传代。
2.BMSCs的鉴定
第5代细胞爬片后进行免疫细胞化学表型的鉴定,结果为CD34-,CD44+和 CD54+(图3A、3B)。
3.BMSCs向Schwann细胞定向诱导分化的形态学变化
倒置显微镜下观察,诱导12 h后胞质开始回缩,呈圆形、三角形或不规则形。随着时间的延长,细胞开始伸出突起,诱导24 h细胞形态发生明显变化,80%-90%的细胞伸出两个或多个突起。多个细胞聚集的地方其突起交织形成网状(图4)。
4.免疫细胞化学鉴定结果
诱导组细胞中 S-100、GFAP均呈阳性表达(图5)。二者的阳性细胞比例分别为(42±4)%和(64±5)%(n=10),未诱导组二者均无阳性表达。
讨 论
骨髓间充质干细胞来源丰富并较易获取,体外培养具有较强自我复制能力和多向分化潜能,自体移植克服了伦理和免疫排斥问题[2-8],因此它被广泛应用于组织工程及多向诱导分化的研究中。在周围神经组织工程研究中,常采用分离纯化的骨髓间充质干细胞与移植材料进行体外复合培养,然后移植修复周围神经缺损,可取得较好的效果,移植材料(如本研究中应用的脱细胞神经移植物)是否对骨髓间充质干细胞具体诱导作用及其诱导效率尚不明确。因此本实验模仿骨髓间充质干细胞与移植材料进行体外复合培养后移植修复周围神经缺损的“诱导微环境”,采用脱细胞神经移植物匀浆对骨髓间充质干细胞进行体外诱导,诱导24h后细胞形态发生明显变化,细胞伸出突起,形成单极、双极或多极神经元样结构,成簇细胞相互之间的突起连接呈网状,这说明此诱导剂不但可诱导骨髓间充质干细胞发生施旺细胞样形态改变,并可使诱导后的细胞间建立起某种细胞间的联系。诱导后免疫细胞化学检测结果显示诱导后的细胞可表达施旺细胞标志蛋白 S-100和 GFAP,且二者的阳性细胞比例较高,而未诱导组则不表达上述2种蛋白。说明经脱细胞神经移植物诱导后的细胞具备一定的施旺细胞功能。值得注意的是,以此脱细胞神经移植物诱导后的细胞,伸出一个或多个突起,具有较强的伸张性,具备较强的细胞活力,说明此诱导剂不会对细胞活性产生明显影响,且诱导后的细胞未见明显的细胞凋亡、诱导组中未发生形态改变的细胞与非诱导组细胞相似,显示此诱导剂无明显细胞毒性。因此它是周围神经组织工程研究中可应用体内的较理想诱导剂。
脱细胞神经移植物作为周围神经组织工程研究中的一种支架材料具有仿生性强及很好的组织相容性等优点,已被较多研究所证实,但将脱细胞神经移植物作为一种细胞诱导剂的研究尚未见报道。脱细胞神经移植物与目前诱导骨髓间充质干细胞分化为Schwann细胞的常用诱导剂如抗氧化剂和生长因子等相比具有来源方便、Schwann细胞转化率高、价廉、安全等优点,它将在组织工程中发挥重要的作用。其诱导MSCs分化为Schwann细胞样细胞的具体机制如诱导剂作用位点、细胞间的分子信息传递以及经脱细胞神经移植物诱导的Schwann细胞样细胞在活体内能否发挥Schwann细胞的生理功能是下一步的研究目标。
[1]刘承吉,孙景致,佟晓杰,等.组织工程化天然神经支架的制备.解剖科学进展,2002,9(3):197-201
[2]Trzaska KA,King CC,Li KY,et al.Brain-derived neurotrophic factor facilitates maturation of mesenchymal stem cell-derived dopamine progenitors to functional neurons.Neurochem,2009,110(3):1058-1069
[3]Yang J,Lou Q,Huang R,et al.Dorsal root ganglion neurons induce transdifferentiation of mesenchymal stem cells along a Schwann cell lineage.Neurosci Lett,2008, 445(3):246-251
[4]Choong PF,Mok PL,Cheong SK,et al.Generating neuron-like cells from BM-derived mesenchymal stromal cells in vitro.Cytotherapy,2007,9(2):170-183
[5]Musolino PL,Coronel MF,Hokfelt T,et al.Bone marrow stromal cells induce changes in pain behavior after sciatic nerve constriction.Neurosci Lett,2007,418(1):97-101
[6]Shimizu S,KitadaM,Ishikawa H,et al.Peripheral nerve regenera tion by the in vitro differentiated human bone marrow stromal cells with Schwann cell property.Biochem Biophys Res Commun,2007,359:915-920
[7]Caddick J,Kingham PJ,GardinerNJ,et al.Phenotypic and functional characteristicsofmesenchymal stem cells differentiated along a Schwann cell lineage.Glia,2006, 54:840-849
[8]Allan EH,Ho PW,Umezawa A,et al.Differentiation potential of a mouse bone marrow stromal cell line.Cell Biochem,2003,90:158-169
[9]Karaoz E,Ayhan S,Gacar G,et al.Isolation and characterization of stem cells from pancreatic islet:pluripotency,differentiation potential and ultrastructural characteristics.Cytotherapy,2010,12(3):288-302
[10]Führmann T,Montzka K,Hillen LM,et al.Axon growth-promoting properties of human bone marrow mesenchymal stromal cells.Neurosci Lett,2010,Apr,474(1):37-41
图 版 说 明
图1 原代细胞第4天形成集落样生长
图2 原代细胞第7天
图3A MSCs表型鉴定CD44+
图3B MSCs表型鉴定CD54+
图4 诱导24h后细胞伸出突起并交织形成网状
图5 诱导后的细胞S-100表达阳性
图6 诱导后的细胞GFAP表达阳性
EXPLANATION OF FIGURES
Fig.1 The primary cells form colony-like growth on the day4.
Fig.2 The primary cells on the day 7.
Fig.3A MSCs phenotypic identification of CD44+
Fig.3B MSCs phenotypic identification of CD54+
Fig.4 24h after induction,cells showing processes and forming network.
Fig.5 The induced cells showing S-100 positive expression.
Fig.5 The induced cells showing GFAP positive expression.
ACELLULAR NEVER ALLOGRAFTS DIFFERENTIATE BONE MARROWSTROMALCELLS OF RATS INTO SCHWANN CELLS
He Hongyun1*,Tong Xiaojie2,Deng Yihao1,Zhang Bensi1
(1Department ofHuman A natomy,School of B asic Medicine,Dali College,Dali671000;2Department ofHuman Anatomy,College of Basic Medicine China Medical University,Shenyang110001,China)
Objective To investigate the differentiation of adult rat bone marrow stromal cells(MSCs)into Schwann cells.induced by acellular nerve allografts in vitro.Methods After phenotype characterization,the fifth generation of the rats’MSCs were extracted,cultured and amplified in vitro,and then induced by ANA homogenate.The change of cellular morphology was observed,and the expressions of S-100,glial fibrillary acidic protein(GFAP)were detected in the induced cells with immunocytochemical staining.Results The phenotypes of MSCs were CD44+ ,CD54+and CD34-.The positive rate for GFAP and S-100 was 42±4%and 64±5%.Conclusion The above results indicate that ANA can induce adult rat MSCs differentiating into Schwann-like cells.
Acellular nerve allograft(ANA);Bone marrow stromal cell;Schwann cell
R329
A
10.3870/zgzzhx.2010.04.006
2009-09-22
2010-04-20
2009年云南省教育厅科学研究基金(09C0157)
何红云,女(1980年),汉族,讲师。
*通讯作者(To whom correspondence should be addressed)
