大鼠脂肪基质细胞成脂分化及慢病毒感染的实验研究
2010-09-11莉马爽顾海伦任亚浩杨
刘 莉马 爽顾海伦任亚浩杨 军
(1中国医科大学公共卫生学院营养与食品卫生学教研室沈阳110001;2中国医科大学附属盛京医院骨外科沈阳110004)
大鼠脂肪基质细胞成脂分化及慢病毒感染的实验研究
刘 莉*1马 爽1顾海伦2任亚浩1杨 军1
(1中国医科大学公共卫生学院营养与食品卫生学教研室沈阳110001;2中国医科大学附属盛京医院骨外科沈阳110004)
目的 诱导大鼠脂肪基质细胞成脂分化,观察慢病毒感染效果。方法 大鼠脂肪基质细胞培养至第3代后,间接免疫荧光法鉴定细胞表面抗原CD44,并采用MTT法绘制生长曲线;第3代基质细胞成脂诱导分化为脂肪细胞,油红O染色法鉴定,并行慢病毒感染。结果 第3代脂肪基质细胞表面抗原CD44表达呈阳性;细胞生长曲线呈“S”形。细胞经成脂诱导分化剂诱导10d后,胞内有大量脂滴形成,脂滴大小不等。油红O染色显示脂滴被染成红色;携带GFP报告基因的慢病毒可感染成熟脂肪细胞,感染率约为80%,且细胞被感染后状态良好。结论 慢病毒可高效感染由大鼠脂肪基质细胞成脂诱导分化成的脂肪细胞,为研究脂肪细胞的基因功能、相关疾病的基因治疗提供了一个有效工具。
脂肪基质细胞;成脂分化;慢病毒;感染
肥胖的发病率正逐年上升,与2型糖尿病、高血压、高血脂等疾病密切相关。肥胖可表现为脂肪细胞体积增大和/或脂肪细胞数目增多。因此,关于脂肪细胞分化、发育及代谢调节的研究对于揭示肥胖的发病机制具有重要作用。目前,利用基因工程技术将外源基因导入细胞或敲减细胞中的某个特定基因来研究基因功能越来越被广泛应用,但成熟脂肪细胞悬浮于培养基中,生命周期短,很难进行转染。而脂肪组织来源的基质细胞(adipose-derived stromal cells,ADSCs)增殖能力强,可在特定条件下诱导分化为脂肪细胞,是研究脂肪细胞基因功能的有效工具。因此,本研究从大鼠附睾脂肪组织中分离培养出ADSCs,鉴定其表型并诱导分化为成熟脂肪细胞后,采用慢病毒感染,观察其感染效率及生长状况,为在脂肪细胞中研究基因功能提供有效工具。
材料和方法
1.实验动物
Wistar雄性大鼠,体重120-140g,购于中国医科大学实验动物部。
2.主要试剂与仪器
2.1 主要试剂
DMEM/F12培养基(Gibco美国),慢病毒三质粒系统p Helper 1.0,p Helper 2.0和p GCSILGFP(上海吉凯生物技术有限公司),兔抗CD44抗体(北京博奥森生物技术有限公司),FITC标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。
2.2 仪器
超净工作台(苏州安泰空气技术有限公司), CO2培养箱(Kendro德国),倒置相差显微镜(O1ympus日本),酶标仪(Tecan瑞士)
3.实验方法
3.1 大鼠脂肪基质细胞分离培养
无菌条件下取大鼠附睾周围脂肪组织,II型胶原酶37℃水浴消化约1h。过250μm筛网后离心,沉淀加DMEM/F12基础培养基混悬,计数并调整细胞数 2-3×105个/ml,接种于 25cm2培养瓶(5ml/瓶)。37℃、5%CO2条件下培养24h后首次换液。细胞约80%融合时,胰酶消化传代。
3.2 间接免疫荧光法鉴定细胞表面抗原
第3代细胞爬片,4%多聚甲醛固定10min, 0.01mol/LPBST(含0.1%TritonX-100 p H 7.4)漂洗5min 3次;加入2%BSA,37℃湿盒内封闭30min,加兔抗CD44抗体(1:50稀释)4℃孵育过夜;加 FITC标记的二抗,37℃湿盒避光作用30min,荧光镜检,拍照。
3.3 MTT法绘制生长曲线
取第3代对数生长期细胞,消化后制成单细胞悬液,调整细胞浓度为5 103/ml,接种于96孔板,每孔100μl(6个复孔),对照孔(2个复孔)仅加入培养基,置37℃、5%CO2温箱培养,每3d换液一次。接种后第1天到第10天,每天取96孔板进行检测。具体方法为每孔加入 10μl 0.5% MTT,4h后吸出孔内液体,加入100μl三联液, 12h后酶标仪570nm波长处测定各孔光密度值。取均值后以时间为横坐标,光密度为纵坐标,绘制生长曲线。
3.4 大鼠脂肪基质细胞成脂诱导分化
当第3代大鼠脂肪基质细胞长成单层后,用PBS洗2次,更换诱导分化培养基(基础培养基内添加胰岛素70nmol/L、地塞米松100nmol/L、右旋泛酸17μmol/L、生物素33μmol/L、异丁基-甲基黄嘌呤5mmol/L和罗格列酮0.5μmol/L)培养3d后,隔日更换诱导分化后培养基(去除异丁基-甲基黄嘌呤及罗格列酮)。诱导分化后第10d进行油红O染色鉴定及慢病毒感染。
3.5 油红O脂肪染色法鉴定脂肪细胞
固定:即取诱导分化10d后细胞,弃除培养基,10%甲醛漂洗5min,更换等体积10%甲醛,至少固定1h。分色:弃掉甲醛,60%异丙醇清洗细胞,让细胞完全干燥。染色:油红O工作液染色10min,弃掉液体,立即用去离子水清洗4次。光学显微镜下观察,被染成红色的细胞即为脂肪细胞,拍照记录。
3.6 慢病毒感染脂肪细胞
构建携带报告基因的慢病毒载体及进行病毒包装,见本实验室Liu等已发表文献[1]。感染前为细胞换新鲜基础培养基,以复感染指数(multiplicity of infection,MOI)值50,每孔加入感染培养基(基础培养基 +5μg/ml polybrene)和病毒共500μl。37℃、5%CO2条件下培养24h,更换新鲜基础培养基。96h后荧光镜检观察感染效果。
结 果
1.大鼠脂肪基质细胞分离培养及免疫荧光结果
原代细胞培养24h后,贴壁的细胞呈短梭形、三角形或小多角形,大小不等,7d左右达80%融合。传代后细胞生长较快,为成纤维细胞形。间接免疫荧光法显示第3代ADSCs的CD44表达呈阳性(图1)。
2.大鼠脂肪基质细胞生长曲线
生长曲线呈“S”形,前3d为潜伏期,第4天开始进入对数生长期持续至第6d,第7天达到高峰,然后进入平台期。
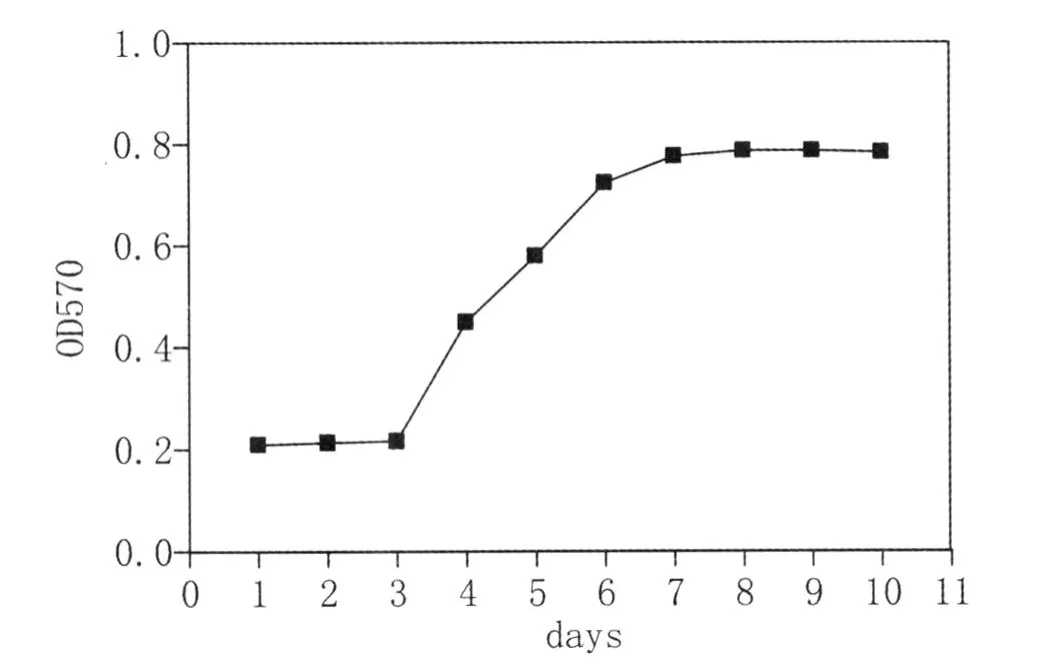
图2 第3代大鼠脂肪基质细胞生长曲线(MTT法)Fig.2 The growth curve of rat adipose-derived stromal cells in generation 3(MTT assay)
3.大鼠脂肪基质细胞诱导分化
第3代细胞长成单层后,经成脂诱导分化剂诱导10d,可见细胞变圆,体积增大,胞内有大量脂滴形成,随诱导时间的延长,小脂滴逐渐融合成大脂滴(图3),油红O染色显示脂滴被染成红色,未分化基质细胞不着色(图4)。
4.慢病毒感染成熟脂肪细胞
携带GFP报告基因的慢病毒可高效感染成熟脂肪细胞,感染率约为80%。细胞被感染后状态良好(图5A,5B)。
讨 论
脂肪组织来源的基质细胞(ADSCs)是一类存在于脂肪组织中,具有多种分化潜能的细胞。在不同诱导分化培养基的作用下,ADSCs可分化为脂肪细胞、成骨细胞、软骨细胞、肌细胞和神经细胞等[2-4]。但其特异性标记目前还不十分清楚,一般认为,ADSCs表面抗原CD29、CD44、CDl05、CDl06、CDl66等为阳性。本试验采用间接免疫荧光法检测分离培养的第 3代 ADSCs表面抗原CD44表达呈阳性,与以往的研究结果一致[5]。MTT结果显示,第3代大鼠脂肪基质细胞接种后,经过3天的潜伏期,进入到对数生长期,4天后进入到平台期。Qu[6]等报道,传代培养的猪ADSC潜伏期约为24-48h,对数增殖期为6天,接种后第9天进入平台期。结果的差异可能与细胞种属、接种密度和传代数有关[7]。
大量研究显示,人体内的脂肪组织不但可以合成并储存甘油三酯,而且还具有内分泌功能,由其分泌的因子,如瘦素、肿瘤坏死因子α等参与机体的代谢、免疫等生理过程。因此,作为脂肪组织主要组成成分的脂肪细胞的研究已成为众多学者关注的热点。由于成熟脂肪细胞为终末分化细胞,内含大量脂滴,非常脆弱、易碎,在培养时漂浮在液面上,培养几天后,大部分细胞会破裂死亡,无法长时间培养、传代,这对于进行基因过表达或敲减的实验造成很大困难,而采用脂肪基质细胞成脂诱导分化为脂肪细胞后,再进行相应实验,则使这一难题获得解决。常见的基因转染的方法是将需要转入的外源基因克隆到质粒载体上,通过转染试剂导入,对于成熟的脂肪细胞而言,质粒的转染效率很低(<10%)。而慢病毒(Lentivirus)载体是一种HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体,与其他病毒载体系统相比,慢病毒具有感染分裂和非分裂的细胞并稳定表达基因,无明显免疫原性等特点,特别适合于在难以转染的细胞中进行基因功能研究,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达[8]。慢病毒感染效果与感染MOI值有密切关系,一般来说,在一定MOI值范围内,MOI值越大,感染效率越高,但超过一定MOI值时感染效率反而会出现下降,这是由于在过高的MOI值下,病毒的细胞毒性致使细胞死亡,引起感染效率的降低。本研究用携带 GFP报告基因的慢病毒感染人成熟脂肪细胞后显示,当MOI值为50时,慢病毒可高效感染成熟脂肪细胞,且细胞被感染后状态良好。
综上所述,本研究采用大鼠脂肪基质细胞成脂诱导分化后,用慢病毒可高效感染成熟的脂肪细胞,为研究脂肪细胞的基因功能、相关疾病的基因治疗提供了一个有效工具。
[1]Liu L,Gu H,Yang J,et al.Adipogenic differentiation is not influenced by lentivirus-mediated shRNA targeting the SOCS3 gene in adipose-derived stromal cells.Mol Biol Rep,2010,37:2455-2462 in press
[2]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells.Mol Biol Cell,2002,13(12):4279-4295
[3]Mizuno H,Hyakusoku H.Mesengenic potential and future clinical perspective of human processed lipoaspirate cells.J Nippon Med Sch,2003,70(4):300-306
[4]王巧稚,韩艺,赵宏贤,等.当归诱导人脂肪间充质干细胞向神经细胞分化和毒性检测的研究.中国组织化学与细胞化学杂志,2009,18(4):477-478
[5]张丽华,汤银娟,刘杰明,等.大鼠附睾脂肪垫脂肪源性干细胞的分离培养及分化潜能.中国组织工程研究与临床康复,2009,13(14):2685-2690
[6]Qu CQ,Zhang GH,Zhang LJ,et al.Osteogenic and adipogenic potential of porcine adipose mesenchymal stem cells.In Vitro Cell dev Biol Anim,2007,43(2): 95-100
[7]Izadpanah R,Trygg C,Patel B,et al.Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue.J Cell Biochem,2006,99(5): 1285-1297
[8]Mori H,Hanada R,Hanada T,et al.Socs3 deficiency in the brain elevates leptin sensitivity and confers resistance to diet-induced obesity.Nat Med,2004,10(7):739-743
图 版 说 明
图1 第3代脂肪基质细胞表面抗原CD44表达阳性,细胞在荧光视野下呈现绿色。FITC标记。×200
图3 脂肪基质细胞成脂诱导分化后10d。细胞体积增大,胞内有大量大小不等脂滴形成。×400
图4 分化后的脂肪细胞中的脂滴可被油红O染成红色。油红O染色。×400
图5A 慢病毒感染分化后的脂肪细胞。感染96h后细胞状态良好。×200
图5B 慢病毒感染分化后的脂肪细胞。感染96h后,80%细胞在荧光视野下呈现绿色。×200
EXPLANATION OF FIGURES
Fig.1 Expression of cell surface antigen CD44 of adiposederived stromal cells(ADSCs)in generation 3 is positive.Green cells are observed in fluorescence field.FITC labeling.×200
Fig.3 10-d adipogenic differentiation from ADSCs.The cells become larger and there a lots of lipid droplets with inequality of size in cytoplasm.×400
Fig.4 The lipid droplets of differentiated adipocytes showing red color after oil red O staining.×400
Fig.5A Differentiated adipocytes a infected with lentivirus.Phase contrast is examined after 96h,which showing the infected cells were in good condition.×200
Fig.5B Differentiated adipocytes a infected with lentivirus.GFP expression is examined after 96h,and eighty percent of cells showing green color in fluorescence field.×200
EXPERIMENTALSTUDY ON ADIPOGENIC DIFFERENTIATION OF ADIPOSE-DERIVED STROMALCELLS AND LENTIVIRUS INFECTION IN RATS
Liu Li1*,Ma Shuang1,Gu Hailun2,Ren Yahao1,Yang Jun1
(1Department of Nutrition and Food Hygiene,School of Public Health,China Medical University,Shenyang 110001;2Division of Orthopedics,Shengjing Hospital,China Medical University,Shenyang110004,China)
Objective To induce adipogenic differentiation of rat adipose-derived stromal cells and to observe differentiated adipocytes infected by lentivirus.Methods Cell surface antigen CD44 was identified in rat adipose-derived stromal cells of generation 3 by indirect immunofluorescence miethod,and MTT assay showed the cell growth curve.Then we induced adipogenic differentiation.Oil red O staining were identified Adipocytes differentiated from adipose-dirived stromal cells were identified by oil red O staining, and then were infected by lentivirus.Results Positive expression of cell surface antigen CD44 was found in generation 3.The cell growth curve showed an“S”shape.After 10 adipogenic differentiation of stromal cells,there were many lipid droplets of various sizes in the cytoplas-m.Lipid droplets showed red color after oil red O staining.Lentivirus with GFP reporter can infect differentiated adipocytes.The infection efficiency was about 80%,and infected cells were in good conditions.Conclusion Lentivirus can infect differentiated adipocytes from adipose-derived stromal cells with high efficiency,which perhaps provides a useful tool to study gene function of adipoytes and gene therapy.
Adipose-derived stromal cell;Adipogenic differentiation;Lentivirus;Infection

Q813.11
A
10.3870/zgzzhx.2010.04.002
2010-01-09
2010-03-12
国家自然科学基金(30500409)
刘莉,女(1976年),汉族,副教授。
*通讯作者(To whom correspondence should be addressed)
