日本血吸虫新基因Sjnanos的克隆、表达及免疫保护效果评估*
2010-08-21郭凡吉彭金彪傅志强石耀军林矫矫
王 艳,郭凡吉,彭金彪,李 晔 ,洪 炀,陈 实,傅志强,石耀军,林矫矫
日本血吸虫新基因Sjnanos的克隆、表达及免疫保护效果评估*
王 艳,郭凡吉,彭金彪,李 晔 ,洪 炀,陈 实,傅志强,石耀军,林矫矫
目的扩增、表达日本血吸虫Sjnanos编码基因并评估其重组蛋白诱导的免疫保护效果。方法从42d龄的日本血吸虫成虫中扩增了一个日本血吸虫性别差异表达的基因,GenBank登录号为AY814948,并对其进行生物信息学分析。将该基因亚克隆入原核表达载体pET28a,转化至大肠埃希菌(E.coli)BL21,用异丙基-β-D硫代半乳糖苷(IPTG)进行诱导表达,用纯化的重组蛋白免疫小鼠,ELISA检测其血清特异性抗体效价,蛋白印迹分析检测其抗原性,以看家基因NADH为内参,应用荧光定量PCR技术分析该基因在血吸虫各个阶段的表达状况。结果同源性分析表明,该基因为日本血吸虫的一个新基因,其编码序列的开放阅读框(ORF)为525bp,编码174个氨基酸,理论相对分子量为19.9,PI为8.2。荧光定量PCR技术分析显示该基因在7d、13d、18d、23d、32d、42d虫体均有表达,但在18d和13d虫体的表达量明显高于其他天数的虫体,在雄虫的表达量高于雌虫。成功构建了该基因的重组表达质粒pET28a(+)-Sjnanos,并在大肠埃希菌中获得表达,Western-blot分析表明重组蛋白具有较好的免疫原性,动物免疫保护试验获得了31.4%的减虫率和53.8%的肝脏减卵率。结论获得日本血吸虫新的抗原基因Sjnanos,该基因的重组蛋白在小鼠中诱导了部分免疫保护作用。
日本血吸虫;nanos基因;抗原性;免疫保护
血吸虫病(schistosomiasis)呈全球性分布,严重危害人畜健康,是一种重要的人畜共患病。至2007年底,全国12个血吸虫病流行省(市、区)的448个流行县(市、区)中仍有105个未达到疫情控制标准,主要集中在长江流域以及洞庭湖和鄱阳湖等湖沼地区。2007年全国日本血吸虫病病人数为51.6万,晚期病人约2.9176万,钉螺面积约 38亿m2。
血吸虫生活史复杂,历经几个发育阶段,每个阶段均表现出各自不同的生物学特征。尤其是血吸虫成虫在吸虫中独特的雌雄异体表现形式,使得其在生殖生理方面表现出复杂的功能差异,这已越来越引起人们的关注〔1〕。血吸虫致病的主要原因是性成熟雌虫大量产卵且沉积于肝脏及结肠等组织,形成虫卵肉芽肿,造成组织免疫病理损害〔2〕。雌雄虫合抱是雌虫成熟和产卵的前提和关键,没有合抱的雌虫发育不全,生长迟缓,生殖系统不成熟,不能产卵,已经发育成熟的雌虫一旦与雄虫分离也会退化至不成熟状态。因此,深入研究血吸虫性别差异表达分子及其作用机制,有助于探索控制血吸虫雌虫产卵的有效方法〔3〕。近几年,对血吸虫性别差异性基因及表达产物的功能研究,已引起人们极大关注。这一领域的研究不仅对阐明血吸虫发育及生殖机制具有重要理论意义,而且对研制抗血吸虫生殖免疫疫苗及有效防治新药也具有重要的实践意义。
本文所克隆的日本血吸虫nanos基因(Sjnanos)属于nanos基因家族的成员之一。Nanos基因广泛存在于果蝇、线虫、两栖动物类等生物中,nanos基因家族产物与其他相关基因产物是调节细胞发育和生长的一个关键分子,对动物的发育特别是生殖系统的发育起着重要的调节作用,但国外对血吸虫nanos基因的研究尚未有报道。日本血吸虫nanos基因的成功克隆,不仅使我们对nanos这类锌指蛋白基因家族有了初步的了解,更为以后研究日本血吸虫发育、生殖机制奠定了基础,具有重要的生物学意义。
1 材料与方法
1.1 菌种、质粒及实验动物 日本血吸虫成虫cDNA文库由本课题组构建并保存。质粒pET28a、大肠杆菌DH5α、BL21(DE3)也由本课题组提供。新西兰白兔(雄性,2.5~3.0kg)购自上海罗泾飞达实验动物养殖场。BALB/c小鼠购自中国科学院上海实验动物中心,日本血吸虫中国大陆株尾蚴由本所钉螺室提供。
1.2 主要试剂和酶 Trizol、GeneRacerTM Kit购自Invitrogen公司;Ex T aq DNA聚合酶、限制性内切酶EcoRI、SalI、T4 DNA 连接酶、RNA inhibitor、荧光实时定量PCR检测试剂盒购自TaKaRa生物工程(大连)有限公司;DNA Marker DL2000、DL5000,小量质粒抽提试剂盒购自上海天根生物技术有限公司,琼脂糖凝胶电泳DNA纯化回收试剂盒均购自Qiagen公司,带His标签的蛋白纯化试剂盒购自美国 Novenge公司,Agrose、DEPC购自上海生工生物工程公司;羊抗兔 IgG-H RP、羊抗鼠IgG一HRP购自西格玛奥里奇(上海)贸易有限公司;硝酸纤维素膜(Whatman)购自北京经科宏大生物技术有限公司;其余试剂均为国产分析纯。
1.3Sjnanos基因的克隆及生物信息学分析 从本课题组构建的7d龄童虫抑制性消减cDNA文库获得一段童虫期差异表达基因EST,将该EST片段在NCBI中进行同源性比对,(http://www.ncbi.nlm.nih.gov/blast);利用DNA Star软件对该cDNA编码的氨基酸组成、蛋白质相对分子质量以及该蛋白的抗原性进行预测,利用ClustalW软件对不同物种nanos蛋白氨基酸序列进行多重比对。用GeneDoc软件对比对结果进行编辑。以该EST序列设计上游引物P1:CGCAGGACT TTCAGACTC TAG;下游引物 P2:GTAGTGAAGTAGGCGTAATGAC,利用PCR技术扩增含ORF的cDNA片段和基因组序列片段。
1.4 实时定量PCR 分别提取日本血吸虫7、13、18、23、32d虫体及42d雄虫与雌虫的虫体总RNA,消化基因组DNA,定量,反转录,纯化回收。以纯化的不同期别的日本血吸虫cDNA为模板,设计引物:Sense primer:5'-ATGGCAACAAGGACCTGATG-3',Antisense primer:5'-TCACTAAGGCTGT TCCAATCG-3',用荧光染料法进行实时定量PCR检测Sjnanos基因在不同时期虫体的表达量,以日本血吸虫NADH基因为内参,NADH引物Sense primer:CGAGG ACC TAA CAG CAG AGG,Antisense primer:TCCGA ACG AAC TT T GAA T TC,引物均由上海英俊生物技术有限公司合成,反应条件为:95℃10s,然后 95℃5s,55℃10s,72℃15s,40个循环,其中72℃15s结束时间为荧光信号检测点,每个反应均做3孔重复。用cobert公司rotogene6.0软件进行分析,得出相对每百万持家基因的目的基因含量。
1.5 重组表达质粒的构建与表达
1.5.1 pET28a(+)-Sjnanos重组质粒的构建及鉴定 根据Sjnanos基因的cDNA序列设计引物,Sense Primer:5'-GC GAAT TC ATG ACT TCA ATC GAC-3';Antisense Primer:5'-GTCGAC CTA AAA T TG CCT GGG-3',分别引入限制性酶切位点EcoR I、SalI(划底线部分),引物由上海英俊生物技术有限公司合成,通过PCR扩增得到含完整ORF的Sjnanos基因序列,该序列与经过同样双酶切的载体pET28a(+)连接,将该序列定向克隆于原核表达载体pET28a(+)的多克隆位点区,构建重组质粒 pET28a(+)-Sjnanos,并转化表达菌BL21(DH5α)。将阳性重组菌接种 LB中扩大培养,提取重组质粒,进行PCR双酶切和DNA序列鉴定。
1.5.2 在大肠杆菌中的表达 将测序正确的表达重组质粒接种于含100μ g/mL的卡那霉素LB液体培养基,37℃震荡培养,当OD600=1.0时加入终浓度为 1mmol/L 的异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导表达,分别收集诱导前及诱导后1、2、3、4、5、6 、7h 的菌液以分析确定最佳表达时相。同时以载体pET28a(+)诱导前后及未诱导重组质粒作为对照,SDS-PAGE电泳,凝胶经过考马斯亮蓝染色、脱色后分析表达结果。
1.6 重组Sjnanos蛋白的纯化及复性 pET28a(+)-Sjnanos按上述方法进行大量诱导表达,然后对诱导菌作如下处理:10 000 g离心10 min,每100 mL菌液用4 mL 1×PBS重悬。-80℃反复冻融3次后,冰浴超声30min,其间每超 5s停 10s。10 000 g离心 15 min,弃上清,沉淀用20mL 8mol/L尿素溶解。10 000 g离心15 min,收集上清即为包涵体蛋白。上清用0.45μ m 的滤膜过滤,按照Ni-NTA agarose包涵体纯化试剂盒说明纯化重组蛋白,SDS-PAGE电泳结果显示,重组蛋白纯度可达90%以上,过柱纯化后的蛋白经透析复性后,紫外分光光度计测定蛋白浓度,-80℃保存备用。
1.7 纯化重组蛋白Sjnanos的抗原性鉴定 将纯化的重组蛋白经SDS-PAGE电泳,然后电转移(280mA不超过3h)至硝酸纤维素膜(NC膜),电转结束后,取出NC膜放入封闭液(5%脱脂奶粉/PBST),室温 2h或 4℃过夜,用经 pET28a(+)/BL21大肠杆菌蛋白吸附的日本血吸虫成虫抗原免疫兔血清做一抗,辣根过氧化物酶标记的羊抗兔IgG做二抗,最后加入沉淀型TMB显色液进行显色,拍照保存。
1.8 小鼠免疫保护实验及血清采集 购置6-8w龄(SPF级)BALB/c小鼠 30只,随机分成 3组,每组10只,分别为免疫组、佐剂对照组和空白对照组。免疫组每次每只注射含206佐剂和27μ g纯化的Sjnanos重组蛋白的乳化液;佐剂对照组每次每只注射相同体积的206佐剂和PBS的乳化液;空白对照组每次每只注射相同体积的PBS。免疫间隔时间为2w,每次免疫后1w尾静脉采血,收集血清,共免疫3次。第3次免疫后2w,每只小鼠经腹部皮肤贴片攻击感染40±1条日本血吸虫尾蚴。攻虫42d后,剖杀小鼠,收集血清,以肝门静脉灌注法收集虫体,计数虫体,计算减虫率,肝脏减卵率和粪便减卵率。
1.9 ELISA试验检测特异性IgG抗体 将免疫前、每次免疫后1w及剖杀的实验血清作1∶100稀释后做常规 ELISA实验〔4-5〕,检测Sjnanos特异性抗体。
2 结 果
2.1Sjnanos基因的克隆及生物信息学分析 从本课题组构建的7d童虫消减cDNA文库中,获得一EST序列,利用NCBI的Blast软件对该基因进行同源性搜索,结果显示该基因与血吸虫其他已知基因无显著同源性,为日本血吸虫的新基因,氨基酸序列相似性比较表明该基因编码蛋白的结构域与多个物种的ZF-nanos蛋白结构功能域相似,命名为Sjnanos。DNA Star分析表明该序列长721bp,其中含ORF为525bp,编码175个氨基酸,理论相对分子量为 19 905.71,理论等电点 PI为 8.2,Sjnanos蛋白的N端不具有信号肽,无跨膜区,但疏水性分布较均匀,有较强的抗原性,见图3。选择分别来自曼氏血吸虫(GenBank登录号 ref|XP_002576493)、涡虫(GenBank登录号:AB052809)、家蚕(GenBank登录号:ref|NP_0010987021)、水螅属(GenBank登录号:ref|XP_002159764.1)、耳鲍(GenBank登录号:ACT35656.1)、小家鼠(Gen-Bank登录号:AAH56473.2)和人(GenBank登录号:ref|NP_955631.1)7个物种的nanos蛋白进行氨基酸序列的多重比对,结果显示其编码的氨基酸序列与曼氏血吸虫Nanos的相似性为67%,与人的相似性为 56%,与家蚕、水螅、小鼠、涡虫等的相似性分别为 58.0%、40.0%、53%、45.0%等,见图 1。
2.2 重组原核表达质粒 pET28a(+)-Sjnanos的构建经 PCR、双酶切鉴定(图 4)和测序,证明pET28a(+)-Sjnanos重组表达质粒构建成功。
2.3Sjnanos基因的期别、性别差异表达分析 Real-time PCR分析表明,Sjnanos基因在童虫及成虫阶段均有表达,其中在18d虫体的表达量最高,随后依次为13d、23d、42d虫体,7d和32d虫体表达量较少。
以 42d雌、雄虫cDNA为模板进行real-time PCR,结果表明,Sjnanos在雌、雄虫中均有表达,但在雄虫中的表达量较高,说明Sjnanos为雄虫高表达基因。

图1不同物种nanos蛋白氨基酸序列的多重比对(clustal W)100%同源的用 *表示,80%同源的用 :表示Fig.1 Aminoacid sequence alignment of nanos orthologues(clustalW)100%identical residues are marked with*,80%identical with:

图2 不同物种nanos的氨基酸序列构建的系统进化树Fig.2 The Phylogenetic tree analysis of Sjnanos with the homologues(the accession numbers of the other members are cited in the legend of fig.1).
2.4Sjnanos在大肠杆菌中的表达和重组蛋白的纯化 SDS-PAGE结果显示,Sjnanos在BL21中获得表达,融合蛋白的相对分子量为21kD,诱导时间4h表达量达到最大(图8),该重组蛋白以包涵体形式存在,溶解于8mol/L尿素,经NTA-Ni树脂纯化,获得纯化后的重组蛋白(图9)。
2.5 表达产物的抗原性分析 重组蛋白SDSPAGE电泳后,经电转移至NC膜上,用日本血吸虫成虫抗原免疫兔血清作为一抗,辣根过氧化物酶标记的抗兔IgG做二抗,Western blot检测,结果有一明显的识别条带(图10),表明重组蛋白具有良好的抗原性。

图3 Sjnanos蛋白的疏水性分析Fig.3 Analysis the hydrophobicity of Sjnanos protein

2.6 动物保护实验 与空白对照组相比,重组蛋白在BALB/c小鼠中诱导了31.4%减虫率,t检验分析表明免疫组和空白对照组差异显著(P=0.00761)。肝脏经消化处理后,在显微镜下进行虫卵计数,与空白对照组相比,肝脏减卵率为53.8%,t检验分析表明,免疫组与空白对照组差异极显著(P=0.00227),与空白对照组相比,佐剂组虽也一定的减虫及减卵效果,但其P值分别为0.071484、0074063,都大于0.05,与空白组差异不显著。
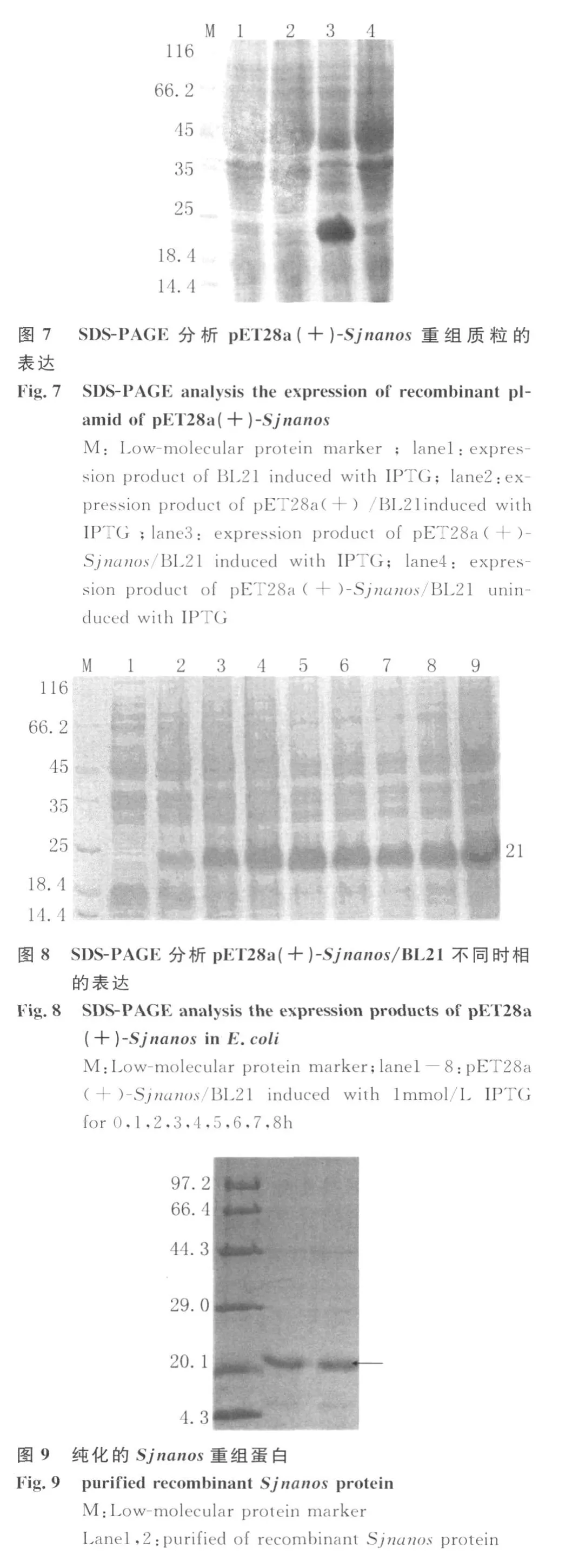

图10 pET28a(+)-Sjnanos重组蛋白western bloting分析Fig.10 Western blotinganalysis of pET28a(+)-Sjnanos recombinant protein
2.7 特异性IgG抗体检测 各组小鼠免疫血清中抗Sjnanos特异性IgG抗体的动态变化如图11,第二次免疫后7d,特异性抗Sjnanos IgG抗体明显上升,第三次免疫后7d,抗体滴度达到最高,而空白对照组及佐剂对照组特异性IgG抗体在整个免疫过程中一直维持在较低水平,无显著变化。

图11 Balb/c小鼠血清抗Sjnanos抗原特异性IgG抗体水平检测结果Fig.11 Specific IgG level against Sjnanos by ELISA

表1 BALB/c小鼠免疫保护试验结果Tab.1 Worm and egg counting reduction rate induced by Sjnanos in Balb/c mice
3 讨 论
血吸虫病是一种分布广泛,危害严重的人畜共患病。血吸虫为吸虫中罕见的雌雄异体,性别的分化对血吸虫的发育及致病起着至关重要的作用。雌雄虫合抱是血吸虫雌虫发育和成熟、产卵的关键〔6〕。虽然虫体在动物体内不能够增殖,但雌虫成熟后产生大量虫卵寄生在人体及动物肝脏和肠组织形成的肉芽肿是导致发病的主要原因〔7〕。因此,加强对血吸虫性别相关基因的研究具有重要的理论意义和实际应用价值,可为血吸疫苗的研究提供线索和理论依据。
Nanos是最先在果蝇的生殖颗粒中被鉴定的一个母源效应组分,其编码一种锌指结构蛋白,锌指蛋白是指一类含有Zn2+的“手指”结构的一类蛋白质,最初于1983年在非洲爪蟾卵母细胞的转录因子TFⅢA 中被发现〔8-9〕,广泛分布在动物、植物和微生物中,人类基因组中可能有将近1%的序列编码的是含有锌指结构的蛋白质。由于锌指蛋白自身的结构特点,使其在基因表达调控、细胞分化、胚胎发育、增强植物抗逆性等方面具有重要作用〔10〕。该蛋白的C端含有两个高度保守的由CCHC组成的锌指结构,在这个结构域外几乎不含保守区〔11〕,此蛋白可以特异性地结合RNA,nanos家族蛋白的主要功能是抑制和调节生殖细胞的分化、发育和成熟〔10-11〕,在昆虫胚胎后部分区域的特殊分化中起重要作用。经研究证实,nanos蛋白是生殖细胞发育和再生所必须的。同时,有学者推断,在果蝇中,从早期的卵裂期到成虫的整个发育过程中,nanos蛋白与vasa蛋白都在生殖细胞中表达,共同调节个体的发育与生殖细胞的成熟。nanos蛋白在早期胚胎中有两个功能:第一,nanos蛋白与 RNA结合蛋白pumilio一起抑制母源 mRNA hunchback的翻译〔13-14〕。第二,nanos蛋白对原始生殖细胞的发育是必不可少的,母源nanos蛋白的缺失导致原始生殖细胞不能正常移动到性腺,从而产生无功能的生殖细胞〔15〕。
研究结果表明,Sjnanos在 13d、18d、23d的表达量显著高于7d、32d、42d,这与日本血吸虫生长发育过程是相吻合的。日本血吸虫从14d开始合抱,合抱以后睾丸和卵巢逐渐发育和成熟,nanos基因可以调节个体发育及生殖细胞的形成,该基因在13d、18d、23d等高表达可能在日本血吸虫的生长发育,特别是生殖器官的发育成熟中起到重要的作用。先前的研究表明,应用RNAi的技术敲除nanos基因,进行有性生殖的涡虫不能产生和形成性腺〔16〕。同样,在进行无性生殖(分裂生殖)的涡虫体内通过RNAi手段敲除nanos基因后,分裂生殖的涡虫不能正常生殖,涡虫可能不能形成正常的生殖细胞,进而影响了生殖。
本研究大量表达纯化Sjnanos融合蛋白,并进行了小鼠日本血吸虫病免疫保护实验,初步的实验结果表明,融合蛋白Sjnanos在BALB/c小鼠中诱导了31.4%减虫率和53.8%的肝脏减卵率,且与空白对照组相比差异极显著,说明Sjnanos蛋白作为候选疫苗分子可诱导产生部分的保护效果,但这只是初步试验结果,有待于进一步重复验证。实际上影响动物保护效果的因素除了抗原本身的性质,还与免疫剂量、注射途径以及佐剂量、佐剂种类等因素相关〔17-18〕,如本次试验的佐剂组的结果稍稍偏高,所以在佐剂种类的选择及佐剂的量方面还需进一步摸索。同时由于该蛋白是日本血吸虫童虫期特异表达产物,产生的抗体可能对成虫期的影响不大,成虫可在宿主体内生长发育。
本研究首次克隆获得了日本血吸虫nanos基因,为探索nanos基因家族在血吸虫生长发育特别是生殖器官发育中过程中的作用及开发高效的抗血吸虫病的疫苗和筛选新型的抗血吸虫药物奠定基础。
〔1〕Schussler P,Grevelding CG,Kunz W.Identification of Ras,and aGAP protein inSchistosoma mansoniby immunoblotting and their putative involvement in male2female interaction〔J〕 .Parasitology,1997,115:629-634.
〔2〕Basch PF.Cultivation ofSchistosoma mansoni in vitroⅡproduction of infertile eggs by worm pairs from cercariae〔J〕 .Parasitol,1981,67:186-193.
〔3〕Hirai,H.M.T anaka,T.L.Philip,Schistosoma mansoni:chromosomal location of female-specific gene and a female-specific DNA element〔J〕 .Ex perimental Parasitol,1993,76:175-181.
〔4〕萨姆布鲁克,弗里奇,曼尼阿蒂斯,分子克隆实验指南〔M〕.2版.北京:科学出版社,2002.
〔5〕ZhuY,RenJ,Ham DA,et al.Protective immunity induced with 23 kDa membrane Protein DNA vaccine ofSchistosoma japonicumChinese strain in infected C57BL/6 mice〔J〕.Southeast Asian Trop M ed Pub Hehh,2003,34(4):697-701
〔6〕Popiel I,Basch PF.Reproductive development of femaleSchistosoma mansoni(Digenea:Schisto-somatidae)following bisexual pairing of worms and worm segments〔J〕.T he Journal of Experimental Zoology,1984,232(1):141-150.
〔7〕Muschamp JW,Fong PP.Effects of the serotonin receptor ligand methiothepin on reproductive behavior of the freshwater snail Biomphalaria glabrata:reduction of egg laying and induction of penile erection〔J〕.The Journal of Experimental Zoology,2001,289(3):202-207.
〔8〕Miller J,McLaehlan A D,Klug A.Repetitiv zinc-binding domains in the protein transcription factorⅢA from Xenopus oocytes〔J〕.EMBO J,1985,4:1609-1614.
〔9〕Lee M S,Gippert G P,Soman K V,et al.T hree-dimensional solution structure of a single zinc finger DNA-binding domain〔J〕.Science,1989,245:635-637.
〔10〕Calvo E,Walter M,Adelman ZN,et al.Nanos(nos)genes of the vector mosquitoes,Ancphelesgambiae,AnophelesstephensiandAedes aegy pti〔J〕.Insect Biochem,2005.
〔11〕Curtis D,T reiber DK,T ao F,et al.A CCHC metal-binding domain in Nanos is essential fortranslational regulation〔J〕.EMBO J,1997,16:834-843.
〔12〕Extavour CG,PangK,Matus DQ,MartindaleM Q.vasa and nanos expression patterns in a sea anemone and the evolution of bilaterian germ cell specification mechanisms〔J〕.Evol Dev,2005,7:201-215.
〔13〕Hulskamp M,Schroder C,Pfeifle C,et al.Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene〔J〕 .Nature,1989,338(6217):629-632.
〔14〕Irish V,Lehmann R,Akam M.The Droscphila posterior-g roup gene nanos function by rep-ressing hunckback activity〔J〕.Nature,1989,338(6217):646-648.
〔15〕Kobay ashi S,Yamada M,Asaoka M,et al.Essential role of the posteriormo rphogen nanos for germline development in Droscphila Nature,1996,380(6576):708-711.
〔16〕Wang Y Y,Zay as R M,Guo TX,et al.Newmark nanos function is essential fo r development and regeneration of planarian germ cells〔J〕 .PN AS,2007,104(14):5901-5906.
〔17〕郑武飞.医学免疫学〔M〕.北京:人民卫生出版社,1989:18-33.
〔18〕沈关心,周汝麟.现代免疫学实验技术〔M〕.湖北科学技术出版社,1998:16-39.
Cloning,expression and characterization of a novel gene ofSchistosoma japonicum
WANG Yan,GUO Fan-ji,PENG Jin-biao,LI Ye,HONG Yang,CHEN Shi,FU Zhi-qiang,SHI Yao-jun,LIN Jiao-jiao
(Shanghai Veterinary Research Institute,Chinese Academy of Agricultural Science,Key Laboratory for Animal Parasitology,Ministry of Agriculture,Shanghai200241,China)
To clone and express the gene(nanos)ofSchistosoma japonicum,and study the antigenicity and immunogenicity of the protein,the nanos gene amplified by PCR from worms'cDNA was cloned into pronucleus expression vector pET28a(+)to construct pET28a(+)-Sjnanosrecombinant plasmid and transformed intoE.coliBL21(DE3).In the presence of IPTG,the 21KD protein was expressed and purified under denaturing conditions to immune the BALB/c mice.The gene sequencing data showed that length of the whole ORF was 525bp and encoded 174 amino acids with a prediction of 21KD.Results of Western blot and ELISA revealed that the fusion protein had good immunogenicity.Real-time PCR analysis showed the mRNA transcription level of nanos was much higher in 13d,18d and 23d within Schistosomula than in other stages.After immunizing BALB/c mice with fusion protein,the percentage of worm and liver egg reduction was 31.4%and 53.8%,respectively.The gene ofSjnanoswas cloned for the first time,and the successful expression and purification of pET28a(+)-Sjnanoswould be helpful for the further protection in animals.
Schistosoma japonicum;nanos;clone;fusion protein
R383.2
A
1002-2694(2010)07-0631-07
*国家自然科学基金(30671581),973课题(2007CB513108)和863计划(2006AA10A207)联合资助
林矫矫,Email:wangyan0516@163.com
中国农业科学院上海兽医研究所,农业部动物寄生虫学重点开放实验室,国家防治动物血吸虫病专业实验室,上海 200241;
2009-11-25;
2010-03-22
