志贺氏菌属环介导恒温扩增快速检测方法的建立及初步应用
2010-08-06徐义刚崔丽春张昕哲李苏龙于恒纯张子群李丹丹
徐义刚,崔丽春,张昕哲,李苏龙,于恒纯,张子群,李丹丹
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江哈尔滨150001;2.东北林业大学,黑龙江哈尔滨150040;3.东北农业大学,黑龙江哈尔滨150030;4.海南出入境检验检疫局,海南海口570125)
志贺氏菌(Shigella)俗称痢疾杆菌,是一类引起人急性感染性痢疾的最常见病原菌。人主要通过食用被志贺氏菌污染的食品而感染发病,以全身中毒症状和大肠化脓性炎症为主要临床特征,具有公共卫生学意义[1]。建立志贺氏菌快速、准确、灵敏、特异的检测方法,不仅为及时有效控制食源性传染病提供依据,同时也是保障人类健康的必要手段。
目前,我国志贺氏菌属的检测方法主要采用国标法(GB/T4789.5-2003),该方法主要为细菌分离和培养鉴定,操作繁琐,检测周期长,并且灵敏度低。其他检测方法,如ELISA、PCR、实时荧光PCR(real-time PCR)等,则存在检测灵敏度低(ELISA法)和检测仪器昂贵(real-time PCR仪)等问题[2-5]。Notomi等研发的环介导恒温扩增技术(Loop-mediated isothermal amplification,LAMP),针对靶基因的6个区域设计4条特异引物,利用链置换DNA聚合酶在恒温条件作用40 min~60 min,即可完成核酸扩增反应,直接通过扩增副产物焦磷酸镁沉淀的浊度判断是否发生反应[6]。LAMP方法具有操作简便、检测快速、灵敏度高并且成本低廉等优点,在疾病诊断、病原检测等领域得到广泛应用[7]。本研究利用该项技术建立了志贺氏菌LAMP快速检测方法。
1 材料和方法
1.1 细菌株和主要试剂 实验菌株购自美国典型菌种保藏中心(ATCC)和中国医学微生物菌种保藏管理中心(CMCC);分离株由本实验室分离并保存(表2);TaqDNA Polymerase和甜菜碱购自Sigma公司;BstDNA Polymerase购自NEB公司;细菌基因组DNA提取试剂盒购自TaKaRa公司;复合增菌培养基、3%NaCl蛋白胨水和缓冲蛋白胨液(Buffered Peptone Water,BPW)均购自北京兰伯瑞生物技术公司。
1.2 引物设计 根据志贺氏菌属ipaH基因序列(M76445),设计外引物 F3/B3及内引物 FIP/BIP、PCR引物和实时荧光PCR引物(表1),引物及探针由TaKaRa公司合成。
1.3 基因组DNA的提取 将表2中细菌分别接种于复合增菌培养基(弧菌用3%NaCl蛋白胨水培养,其他菌株用BPW培养)中,按各细菌最适生长温度培养,分别采用煮沸法(LAMP特异性试验)和试剂盒法(LAMP灵敏度试验)提取基因组DNA。
1.4 LAMP反应条件 50 μL反应体系:10×ThermoPol Buffer 5 μL、 2.5 mmol/L dNTP 8 μL、100 mmol/L MgSO44 μL、 FIP/BIP(40 mmol/L)和F3/B3(20 mmol/L)各 1 μL、10 mmol/L 甜菜碱 4 μL、5 u/μLTaqDNA Polymerase 和 8 u/μLBstDNA Polymerase 2 μL、DNA 模板 1 μL。65 ℃水浴作用40 min~60 min,目测反应管中液体浑浊度变化,判断是否发生反应,同时进行琼脂糖凝胶电泳验证。

表1 LAMP、PCR和real-time PCR引物及探针序列Table 1 Primers and probe sequence for LAMP,PCR and real-time PCR
1.5 LAMP灵敏度试验 将浓度约为2.8×107cfu/mL的志贺氏菌进行10倍倍比稀释,提取DNA进行LAMP扩增,经琼脂糖凝胶电泳检测扩增效果,确定试验灵敏度。同时进行PCR及real-time PCR检测志贺氏菌灵敏度试验,PCR反应条件:95℃4 min;95℃ 30 s、58.5℃ 30 s、72℃ 40 s,30个循环;72℃5 min。Real-time PCR反应条件:37℃5 min;95℃ 3 min、94℃ 10 s、60℃ 40 s,40个循环。比较3种方法的检测灵敏度。
1.6 LAMP特异性试验 利用建立的LAMP方法检测表2中细菌基因组DNA,验证本方法的特异性。
1.7 污染食品LAMP方法检测灵敏度试验 取10 g无志贺氏菌的猪肉样品,加入90 mL碱性蛋白胨水,制成匀浆,加入1 mL菌体浓度约为3.5×107cfu/mL的志贺氏菌,取匀浆进行10倍倍比稀释,提取基因组DNA,进行LAMP扩增,经琼脂糖凝胶电泳检测扩增结果,以确定检测灵敏度。
1.8 临床样品检测及符合率试验 将志贺氏菌LAMP方法应用于检疫实践中,并与国标法进行比较,验证两者的符合率。
2 结果
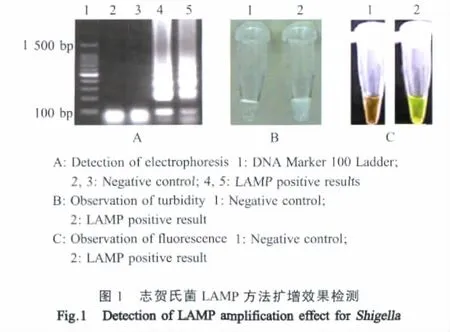
2.1 志贺氏菌LAMP方法的建立 目测观察阳性反应管内部溶液变浑浊,表明产生了LAMP扩增副产物焦磷酸镁,即发生LAMP反应(图1:B-2),而对照管溶液未变浑浊(图1:B-1)。经琼脂糖凝胶电泳验证,阳性反应管呈现典型的LAMP扩增电泳条带(图1:A-4、A-5)。采用荧光显色法检测,阳性反应管呈现典型的绿色荧光(图1:C-2)。
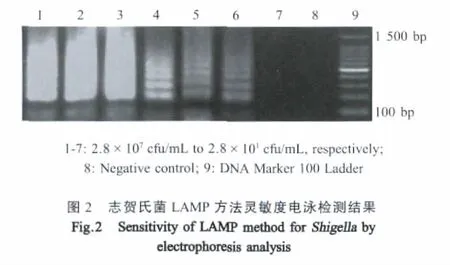
2.2 LAMP灵敏度试验 将已知浓度的志贺氏菌进行10倍倍比稀释,提取基因组DNA进行LAMP扩增,经凝胶电泳检测验证,该LAMP方法对纯培养菌的检测灵敏度为28 cfu/mL(图2)。
2.3 特异性试验 利用建立的LAMP方法对表2中32种共50株细菌进行检测,结果如表2所示,其中7株志贺氏菌为阳性,而其他菌为阴性,表明该方法具有高度特异性。
2.4 LAMP、普通PCR及real-time PCR法检测灵敏度比较 普通PCR和real-time PCR法检测志贺氏菌灵敏度如图3和图4所示。PCR法检测灵敏度为280 cfu/mL,real-time PCR方法检测灵敏度为28 cfu/mL。LAMP方法的检测灵敏度比普通PCR法高10倍,与real-time PCR方法的灵敏度基本相同。
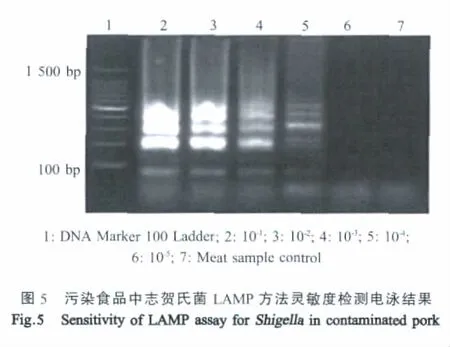
2.5 污染食品志贺氏菌灵敏度检测结果 将含有志贺氏菌浓度3.5×105cfu/g的猪肉匀浆液进行10倍倍比稀释,以每个稀释度作为污染食品模型样本进行LAMP检测,经琼脂糖凝胶电泳分析,结果显示该LAMP方法对污染食品中志贺氏菌的检测灵敏度为 35 cfu/mL(图 5)。
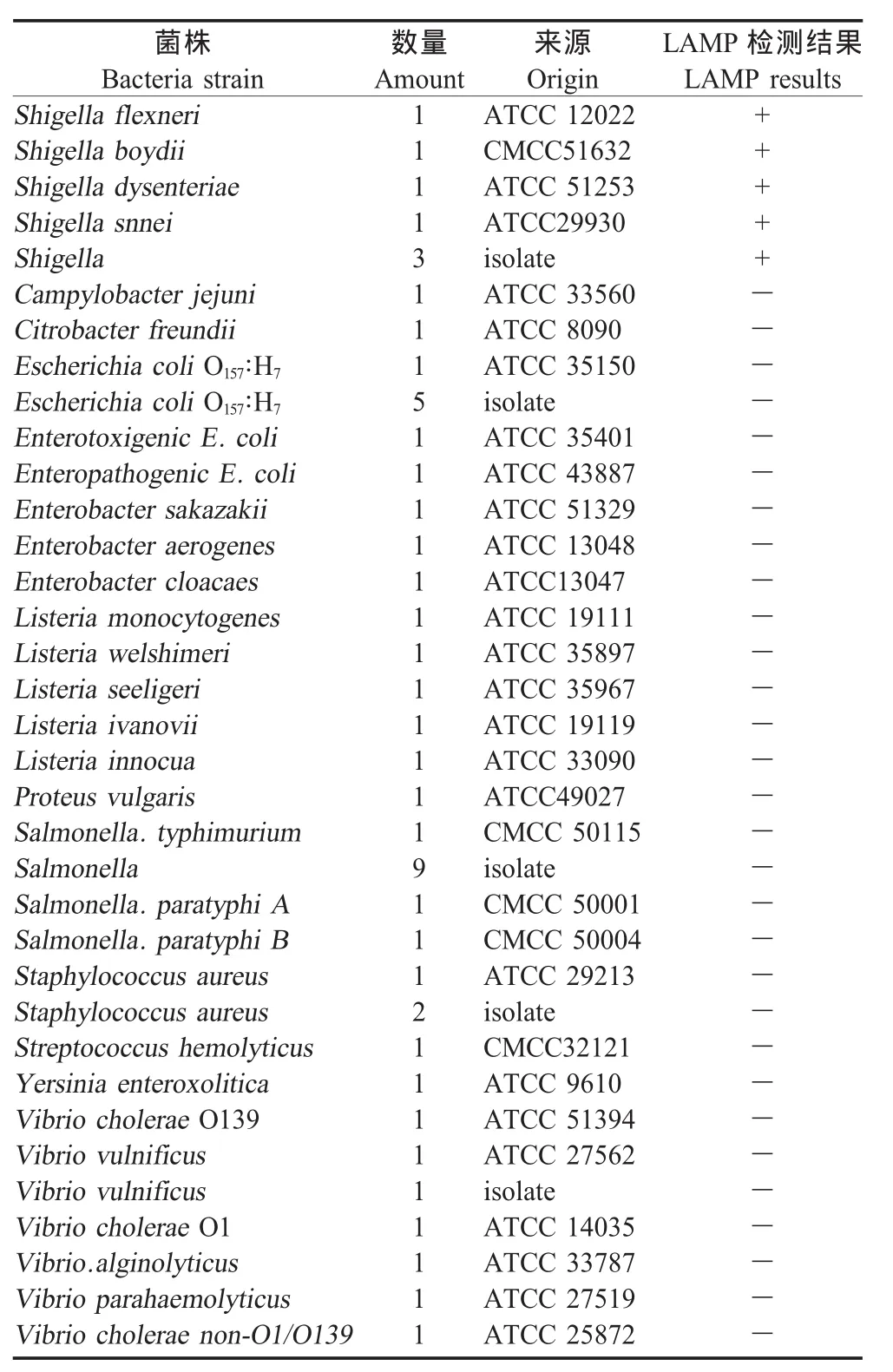
表2 志贺氏菌LAMP方法特异性试验菌株及检测结果Table 2 Bacteria strains and detection results for specificity of LAMP assay ofShigella

2.6 临床样品检测及符合率试验 2009年4月至2009年11月期间,利用LAMP方法对195份涉及肉类、奶类、豆制品及人工污染样品进行检测,共检出29份阳性,与国标法检测结果符合率为100%(表3),表明该LAMP方法具有良好的可靠性。
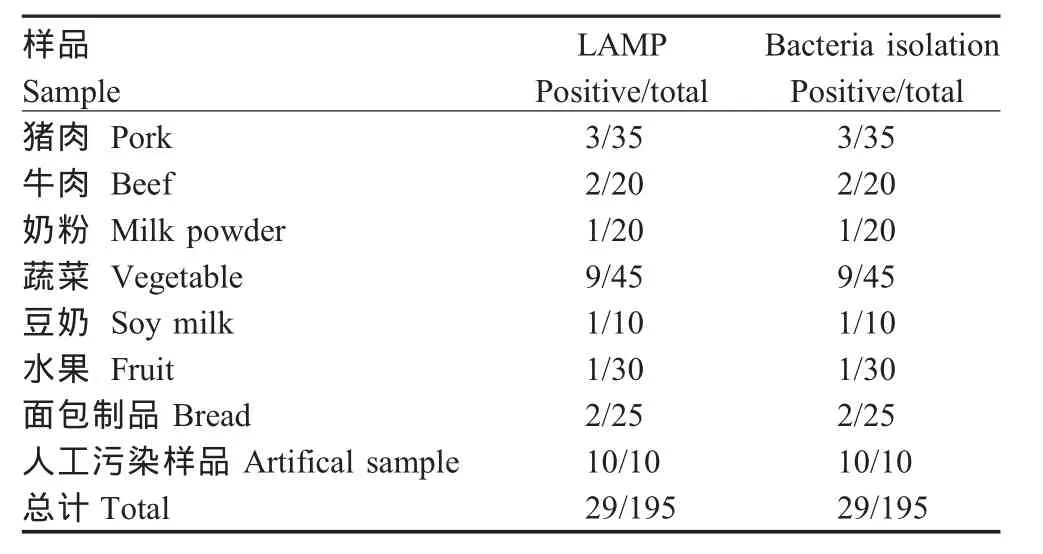
表3 LAMP方法与国标法对比结果Table 3 Comparison between LAMP method and bacteria isolation and identification
3 讨论
本研究利用环介导等温扩增技术建立的志贺氏菌属LAMP检测方法,操作方便,40 min~60 min内即可完成致病菌检测,可以满足食源性致病菌快速检测的要求,实验装置简单,结果判断直观,具有广泛应用价值。
利用该LAMP方法对包括志贺氏菌在内的32种共50株细菌进行检测,结果显示其中7株志贺氏菌为LAMP阳性,而其他细菌为阴性,表明该LAMP方法具有高度特异性。为确定该方法的检测灵敏度,对已知浓度的致病菌进行10倍倍比稀释,提取每个稀释度细菌基因组DNA作为模板进行LAMP扩增,琼脂糖凝胶电泳检测显示,该LAMP方法对纯培养的志贺氏菌检测灵敏度可达28 cfu/mL,对污染食品中志贺氏菌的检测灵敏度为35 cfu/mL,能够满足食源性致病菌检测限量要求。此外,本研究比较了该LAMP方法与普通PCR法及real-time PCR法检测志贺氏菌的灵敏度,结果显示该方法检测灵敏度较PCR法高10倍,而与real-time PCR方法检测灵敏度基本相同。检验检疫实践证实,该LAMP方法与国标法检测结果的符合率为100%,表明了该方法的可靠性。从实验易操作性、结果判定直观、低成本的角度出发,该LAMP方法具有较好的应用前景。
[1]严睿,朱凤才.志贺菌分子生物学检测技术研究进展[J].中国病原生物学杂志,2008,3(6):464-467.
[2]钟青萍,葛萃萃,张世伟,等.检测食品中志贺氏菌的双抗夹心ELISA方法的研究[J].食品科技,2007,10:199-202.
[3]Islam M S,Hossain M S,Hasan M K,et al.Detection ofShigellafrom stools of dysentery patients by culture and polymerase chain reaction techniques[J].J Diarrhoeal Dis Res,1998,16(4):248-251.
[4]Thong K L,Hoe S L L,Puthucheary S D,et al.Detection of virulence genes inMalaysian Shigellaspecies by multiplex PCR assay[J].BMC Infect Dis,2005,5(1):8.
[5]Fukushima H.Duplex real-time SYBR green PCR assays for detection of 17 species of food or waterborne pathogens in stools[J].J Clin Microbiol,2003,41(11):5134-5146.
[6]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63-E63.
[7]Amazaki W,Taguchi M,Ishibashi M,et al.Development and evaluation of a loop-mediated isothermal amplification assay for rapid and simple detection ofCampylobacter jejuniandCampylobacter coli[J].J Clin Microbiol,2008,57:444-451.
[8]Yavzori M,Cohen D,Wasserlauf R,et al.Identification ofShigellaspecies in stool specimens by DNA amplification of different loci of theShigellavirulence plasmid[J].Eur J Clin Microbiol Infect Dis,1994,13(3):232-237.
[9]靳连群,李君文,晁福寰,等.基因芯片检测肠道致病菌技术的建立和应用[J].中华传染病杂志,2004,22(1):24-27.
