应用荧光定量RT-PCR方法检测PRRSV变异株在仔猪体内动态分布
2010-05-21荣福龙刘永刚孙广力王淑杰王洪峰石文达李丽琴徐明明田志军蔡雪辉
荣福龙,刘永刚,孙广力,王淑杰,王洪峰,石文达,李丽琴,徐明明,孙 刚,田志军,蔡雪辉*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江 哈尔滨 150001;2.东北农业大学,黑龙江 哈尔滨 150001;3.黑龙江省动物卫生监督所,黑龙江 哈尔滨 150090)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的,以妊娠母猪繁殖障碍、仔猪及育肥猪呼吸道病症为主要特征的传染病[1]。1987年该病首先发现于美国,此后呈全球性流行,给养猪业造成重大的经济损失。1996年郭宝清等报道我国首例PRRS并分离得到PRRSV CH-1a株[2]。2006年5月我国大部分省市先后暴发了以高热为主要特征的“猪高热病”,研究结果表明该病的主要病原为高致病性PRRSV变异株[3]。
荧光定量PCR(FQ-PCR)技术具有灵敏度高、快速、简捷、结果直观、重复性好、可定量分析等优点[4]。PRRSV在机体内的分布和含量的高低对研究该病的致病机理起着至关重要的作用。常规方法检测PRRSV在动物体内动态分布时,仅能做到定性和半定量分析,不能确定PRRSV在动物组织内的精确拷贝数,而FQ-PCR可以解决这一问题。因此,本实验应用建立的PRRSV荧光定量RT-PCR方法对不同代次PRRSV变异株在仔猪体内的分布进行定量分析,检测PRRSV在仔猪体内各器官的分布和载量,明确PRRSV的分布特点和动态规律,确定不同代次PRRSV变异株的主要嗜性器官,为研究PRRSV的致病机制提供参考依据。
1 材料和方法
1.1 病毒株、质粒及实验动物 高致病性PRRSV变异株(HuN4株)及其经Marc-145细胞传65代致弱的HuN4-F65均由本实验室保存;荧光定量RT-PCR所需的标准阳性质粒由韦天超博士提供[5];40日龄健康仔猪购自哈尔滨周边某猪场。
1.2 主要试剂和仪器 LSIVET SUIS PRRS抗体检测试剂盒购自LSI公司;RNeasy Plus Mini RNA提取试剂盒购自Qiagen公司;RNA酶抑制剂、禽源反转录酶(AMV)、ExTaqDNA聚合酶(Hot Start Version)购自TaKaRa公司;RotorGene3000荧光定量PCR仪为Corbett公司产品。
1.3 实验动物分组及感染试验 40日龄健康仔猪40头,经RT-PCR和ELLSA检测PRRSV阴性。随机分为3组,感染组各16头,对照组8头,分别接种感染 HuN4株(2×105TCID50/mL)、HuN4-F65株(2×105TCID50/mL)和PBS,感染剂量均为肌注1 mL,滴鼻2 mL。观察临床症状并测定直肠温度,分别于感染后1 d~28 d迫杀对照组1头、HuN4组2头、HuN4-F65组2头。采血、分离血清并采集肺、颌下淋巴结、扁桃体、肝、十二指肠和脑组织备用。
1.4 病毒RNA的提取及反转录 取感染后不同时间采集的各器官,按照RNeasy Plus Mini RNA试剂盒说明书提取总RNA。利用随机引物进行反转录,程序为:25℃ 10 min,42℃1 h,0℃2 min。
1.5 FQ-PCR检测 分别以cDNA为模板按照文献[5]方法进行FQ-PCR检测。对各时间点采集的器官及血清的病毒载量取对数,比较对照组、HuN4组和HuN4-F65组在不同时间点各器官及血清中的增殖情况,分析PRRSV的动态分布规律。
2 结果
2.1 临床症状 在感染后的5 d~9 d,HuN4组仔猪体温达峰值,之后逐渐下降,试验后期体温接近于对照组;HuN4-F65组体温与对照组相近(图1)。HuN4组在试验初期出现精神沉郁、食欲下降,并伴有咳嗽和打喷嚏等症状;中期耳部发绀,后躯麻痹,呈犬卧姿势;后期出现不同程度的腹泻,并伴有神经症状;部分仔猪的耳部、腹部及尾部发绀,体温降低。在整个试验期内仔猪死亡9头,病死率为56%,个别仔猪在后期恢复。HuN4-F65组主要表现为轻度的咳嗽,精神状态正常,未出现典型的临床症状。对照组仔猪无明显症状。
2.2 剖检变化 HuN4组病理变化显著,特别是在感染后7 d和10 d,肺脏表面大面积出血、淤血,个别处有坏死灶,肺水肿。颌下淋巴结和肠系膜淋巴结肿大、出血。除脑、心脏外,其他各器官表面均有不同程度的出血。但是,在感染后21 d和28 d只有肺脏、颌下淋巴结和扁桃体小面积出血,其他器官无明显变化。HuN4-F65组个别仔猪的肺组织、肾脏轻度淤血,淋巴结轻度肿大,其他各器官均无明显可视病变。对照组各脏器均未见异常变化。

图1 攻毒后各组实验猪体温变化曲线Fig.1 Temperature curve of the inoculated pigs
2.3 PRRSV在感染仔猪各器官及血清中的动态分布规律
2.3.1 脑 在感染后1 d~21 d,HuN4组在脑部的病毒载量高于HuN4-F65组。HuN4组在感染后1 d在脑部检测到PRRSV载量为2.8×106copies/g,而HuN4-F65组在感染后的1 d、3 d和5 d未检测到PRRSV,表明HuN4株对脑的嗜性强于HuN4-F65株。HuN4组的病毒载量与感染时间呈正相关,在感染后7 d病毒载量达到峰值,为1.8×1010copies/g,随后病毒载量呈下降趋势,在感染后28 d病毒载量达到最低;HuN4-F65组在感染后7 d可以检测到PRRSV,感染后14 d达到峰值,随后呈下降趋势;对照组未检测到PRRSV(图2)。

图2 PRRSV在脑中病毒载量变化曲线Fig.2 PRRSV viral load in the pig brain
2.3.2 十二指肠 在感染后1 d~28 d十二指肠HuN4组的病毒载量高于HuN4-F65组。前者在感染后1 d可在十二指肠检测到PRRSV,病毒载量在感染后3 d开始上升,7 d达到峰值,随后呈下降趋势。HuN4-F65组在感染后5 d可以检测到PRRSV,14 d达到峰值,随后呈下降趋势,在感染后28 d未检测到PRRSV。对照组呈阴性(图3)。

图3 PRRSV在十二指肠中病毒载量变化曲线Fig.3 PRRSV viral load in the pig duodenum
2.3.3 扁桃体 在感染后3 d~28 d HuN4组扁桃体的病毒载量高于HuN4-F65组。前者病毒载量在感染后呈直线上升趋势,感染后7 d达到峰值,随后呈下降趋势;后者在感染后1 d于扁桃体可以检测到PRRSV,病毒载量高于HuN4组,在感染后3 d仍可检测到较高的病毒载量(5.0×107copies/g),在感染后14 d达到峰值(1.0×108copies/g),后期仍保持较高的病毒载量,表明扁桃体是HuN4-F65株的主要嗜性器官;对照组呈阴性(图4)。
2.3.4 颌下淋巴结 除感染后3 d,在其他各时期HuN4组颌下淋巴结的病毒载量均高于HuN4-F65组,HuN4组感染后1 d颌下淋巴结可以检测到PRRSV,而HuN4-F65组未检测到PRRSV。HuN4组在感染后3 d病毒载量迅速上升,在感染后7 d达到峰值,随后呈下降趋势,但后期仍具有较高的病毒载量。HuN4-F65组在感染后3 d可以检测到较高的病毒载量,达1.8×108copies/g,高于HuN4-F65组其他各器官,其中病毒载量的峰值期出现在感染后7 d,早于HuN4-F65组其他各器官,并且病毒载量高达 3.0×108copies/g,表明颌下淋巴结也是HuN4-F65株的主要嗜性器官。对照组呈阴性(图5)。

图4 PRRSV在扁桃体中病毒载量变化曲线Fig.4 PRRSV viral load in the pig tonsil

图5 PRRSV在颌下淋巴结中病毒载量变化曲线Fig.5 PRRSV viral load in the pig submandibular lymph nodes
2.3.5 肺脏 在感染后1 d~28 d HuN4组肺脏的病毒载量明显高于HuN4-F65组,在感染后7 d达到峰值,为1.0×1011copies/g,明显高于HuN4组其他各器官,而且各个时间点均具有较高的病毒载量,表明肺脏为HuN4株的主要嗜性器官。HuN4-F65组在感染后1 d和3 d未检测到PRRSV,并且,在感染后5 d~28 d病毒载量的波动不明显,各时间点的病毒载量较低,只是在感染后10 d病毒载量略高于其他各时间点(图6),提示HuN4-F65株在肺脏的复制能力明显低于HuN4株。对照组呈阴性。
2.3.6 肝脏 在试验期间HuN4组肝脏的病毒载量高于HuN4-F65组,在感染后1 d~7 d肝脏的病毒载量呈上升趋势,但上升速度比扁桃体、淋巴结和肺脏慢。在感染后7 d病毒载量达峰值,随后呈下降趋势(图7)。HuN4-F65组在感染后1 d、3 d和5 d未检测到PRRSV,病毒载量的峰值期出现于感染后14 d,随后也呈下降趋势。对照组呈阴性。
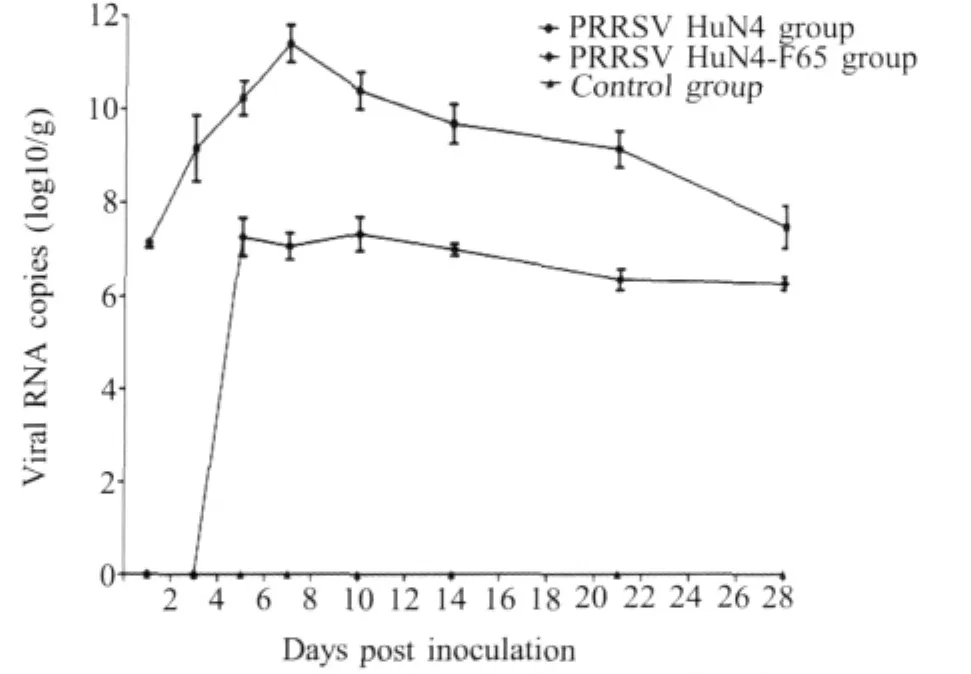
图6 PRRSV在肺脏中病毒载量变化曲线Fig.6 PRRSV viral load in the pig lung

图7 PRRSV在肝脏中病毒载量变化曲线Fig.7 PRRSV viral load in the pig liver
2.3.7 血清 HuN4组血清病毒载量在感染后1 d~14 d高于HuN4-F65组,21 d~28 d接近HuN4-F65组,感染后5 d病毒载量达到峰值,后期有所下降;HuN4-F65组在试验期间病毒载量波动不明显,后期出现轻度下降趋势;对照组呈阴性(图8)。
3 讨论

图8 PRRSV在血清中病毒载量变化曲线Fig.8 PRRSV viral load in the pig serum
本研究采用滴鼻、肌注的方式感染仔猪。结果表明:HuN4组各器官在感染后5 d~21 d的病毒载量明显高于HuN4-F65组,其中,部分器官在感染后1 d~7 d差异较大,并且HuN4组各器官病毒载量峰值期出现在感染后7 d,比HuN4-F65组提前3 d~7 d。汪铭书等报道PRRSV在体内可诱导肺脏、淋巴结、扁桃体、肝脏和脑等组织的细胞发生凋亡,凋亡细胞数目随感染时间的延长在感染后7 d达到峰值,之后减少[12]。宿主细胞凋亡动态变化规律与本实验HuN4组各器官病毒载量的变化规律相一致,表明病毒的复制与靶细胞凋亡密切相关。
HuN4株在全身各组织器官广泛分布,感染后该株病毒增殖速度快,表明HuN4株在感染后对靶细胞的嗜性明显强于HuN4-F65株。HuN4组各器官病毒载量变化和体温变化存在相关性,均在感染后7 d左右达到峰值,而HuN4-F65组无此规律,这种致病性差异可能与PRRSV的毒力有关。本研究在HuN4组的脑组织中检测到PRRSV核酸,其中某些病例还发生典型的神经症状,表明PRRSV变异株可以突破血脑屏障,与Tian等报道一致[6]。刘永宏等报道PRRSV对消化系统产生损伤[7],因此,本实验结果显示,仅HuN4-F65组在感染后1 d和28 d未检测到病毒外,其他各时期HuN4组和HuN4-F65组仔猪的十二指肠内均检出PRRSV,表明PRRSV主要侵入的消化道器官为十二指肠。Beyer等通过免疫荧光方法对感染PRRSV欧洲株的仔猪各器官的病毒进行定量检测,结果显示,淋巴结在感染后2 d~4 d病毒含量最高,肺脏在感染后7 d病毒含量最高[8],而本实验HuN4组的结果是淋巴结和肺脏均在感染后7 d病毒含量达到峰值,推测可能是由于感染的毒株不同所致。PRRSV对肺脏的亲嗜性最高,主要侵害巨噬细胞和上皮细胞[9-10,13],与本实验HuN4组检测的结果相一致,但与HuN4-F65组检测的结果不同。HuN4-F65株对颌下淋巴结和扁桃体有较高的嗜性,而对肺脏不敏感,这与任慧英等报道的结果相吻合[11],表明PRRSV在致弱的过程中对猪体的适应性减弱,主要局限于单核巨噬细胞相对集中的淋巴结和扁桃体。胡守萍报道HuN4致弱株在攻毒28 d仍可在多数淋巴器官被检出,而且在肺脏持续时间短,病毒含量低,提示HuN4致弱株的嗜性器官主要集中在淋巴结[14],这与本实验的结果相符。导致嗜性器官改变的具体原因,还需要进一步的验证。
本实验表明HuN4组和HuN4-F65组病毒血症持续存在,其中HuN4组感染后1 d~14 d血清的病毒载量明显高于HuN4-F65组,并且HuN4组和HuN4-F65组在感染后1 d即可检测到病毒。推测其原因主要与感染方式有关,本实验采用滴鼻加肌注的感染方式使病毒直接进入猪血液中,缩短了病毒通过血液循环到达其他器官的时间,这可能是部分器官在实验前期检测到病毒的主要原因。HuN4组血清的病毒载量明显低于各组织的病毒载量,这与韦天超等报道不一致[5],推测其原因可能与未采集到各组织的病毒载量均较高的病死猪的血液有关。本实验HuN4-F65组临床症状和剖检变化显示,感染HuN4-F65株的仔猪未发病,但从各组织的病毒载量分析,仔猪各组织在试验后期始终带毒,表明较低的病毒载量不会引起仔猪的临床症状,但是机体是否能彻底清除病毒,尚需进一步研究。
[1]Dea S,Bilodeau R,Athanassious R,et al.Swine reproductive and respiratory syndrome virus in Quebec isolation of an enveloped virus serologically-related to Lelystad virus[J].Can Vet J,1992,(33):801-808.
[2]郭宝清,陈章水,刘文兴,等.从疑似PRRSV流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996,18(2):1-4.
[3]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,(29):323-326.
[4]葛忠源,熊东艳,张启勇,等.实时荧光定量PCR技术及应用[J].中国牧业通讯,2008,(13):12-14.
[5]韦天超,田志军,安同庆,等.猪繁殖与呼吸综合征病毒TaqMan-MGB荧光定量RT-PCR方法的建立和应用[J].中国预防兽医学报,2008,30(12):944-948.
[6]Tian K G,Yu X L,Zhao T Z,et al.Emergence of fatal PRRSV variants:Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,6:526.
[7]刘永宏,赵丽,韩春华,等.高致病性猪繁殖与呼吸综合征病毒在自然病例组织中的定位[J].中国兽医杂志,2009,2(6):24-25.
[8]Beyer J,Fichtner D,Schirrmeier H,et al.Porcine reproductive and respiratory syndrome virus(PRRSV):kinetics of infection in lymphatic organs and lung[J].J Vet,2000,47:10-24.
[9]Zimmermanet J.PRRS compendium[M].National Pork Producers Council,1998,45-51.
[10]Larochelle R,Magar R.Differentiation of north American and European porcine reproductive and respiratory syndrome virus genotypes by in situ hybridization[J].J Virol Met,1997,68(2):161-168.
[11]任慧英,杨汉春,高云,等.猪繁殖与呼吸综合征病毒核酸在仔猪呼吸及繁殖系统动态分布的研究[J].中国兽医杂志,2002,38(2):3-4.
[12]汪铭书,程安春,刘芳,等.仔猪人工感染猪繁殖与呼吸综合征病毒后宿主细胞凋亡动态变化规律的研究[J].病毒学报,2006,22(5):385-390.
[13]Duan X,Nauwynck H J.Virus quantification and identification of cellular targets in the lungs and lymphoid tissues of pigs at different time intervals after inoculation with porcine reproductive and respiratory syndrome virus(PRRSV)[J].Vet Microbiol,1997,56:9-19.
[14]胡守萍.高致病性猪繁殖与呼吸综合征病毒致弱效果的免疫病理学和分子病理学评价[D].哈尔滨,东北农业大学博士论文,2009.
