乳酸甲醇酯化床催化研究
2010-03-23姜绍通李超孟吴学凤潘丽军唐晓明
刘 模,姜绍通,李超孟,吴学凤,潘丽军,唐晓明
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
乳酸甲醇酯化床催化研究
刘 模,姜绍通,李超孟,吴学凤,潘丽军,唐晓明
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
为研究乳酸甲醇酯化反应过程,采用强酸性阳离子交换树脂床催化乳酸甲醇酯化反应,研究反应物进料流速、反应温度、醇酸物质的量比对酯化率的影响。结果表明:随进料速度的降低,酯化率先上升后趋于稳定;随反应温度升高,反应速率变大,平衡酯化率基本不变;随醇酸比增加,平衡转化率升高,但增加幅度变小。建立乳酸甲醇床催化拟均相模型,反应活化能为33805.56J/mol,指前因子为4856.63mol-1·L·min-1。实验测得平衡常数为1.1151,且在所考察的温度范围内基本不变。实验值与模型估计值平均相对偏差为2.74%。
乳酸;酯化;固定床;拟均相模型
乳酸,又称α-羟基丙酸,是一种多用途的精细化学品。乳酸、乳酸盐及其衍生物,广泛应用于食品、医药、化工、电镀等领域[1-2]。生物相容性塑料制品聚乳酸的出现,更使乳酸的发展显示出巨大的市场潜力[3]。
乳酸的生产基本采用微生物发酵法,主要有根霉法和细菌法[4-6]。乳酸发酵液成分复杂,除乳酸外还包括菌体、残糖、蛋白质、色素、胶体、有机杂酸、无机盐等多种杂质。乳酸的分离精制方法主要有钙盐法[7]、膜过滤法[8]、吸附法[9]、离子交换法[10]、萃取法[11]、电渗析法[12]、分子蒸馏法[13-14]等。由于乳酸的强亲水性、难挥发性、易自聚合性,难以得到高纯度、药用级别、可应用于电镀行业的乳酸制品[7]。
酯化-水解法是精制乳酸的有效技术,粗乳酸与低级醇酯化生成易挥发的乳酸酯,水解乳酸酯即可得到高纯乳酸[7,15-16]。Choi[17]、Ma[18]、Kumar[19]等研究了分批反应精馏精制L-乳酸;Kumar等[20]研究了反应精馏连续提取L-乳酸的工艺,该工艺由一个两相连续搅拌酯化釜和反应精馏水解塔构成,成功地从乳酸水溶液中得到高
纯度L-乳酸。酯化采用稀乳酸(质量分数≤20%)在搅拌反应釜中进行,由于乳酸浓度低,酯化率只能达到40%[21-22],乳酸甲酯、水、甲醇、乳酸以蒸汽形式进入反应精馏塔,能耗较大。为克服酯化过程中能耗高,酯化率低等欠缺,采用强酸性阳离子交换树脂床催化高浓度乳酸与甲醇的酯化反应,减压蒸馏得到乳酸甲酯、甲醇、水等的混合物。
本实验研究进料速度、反应温度、醇酸比对床催化乳酸甲醇酯化过程的影响,并采用拟均相模型关联实验数据。
1 材料与方法
1.1 材料与试剂
乳酸(AR,质量分数≥85%) 国药集团化学试剂有限公司;甲醇(AR,体积分数99.5%) 上海化学试剂有限公司;D001树脂 安徽三星树脂科技有限公司;浓硫酸;甲醇(色谱纯);乳酸甲酯(质量分数为99%) 德国Sigma公司。
1.2 仪器与设备
离子交换柱(Φ1.6cm×10cm、Φ1.6cm×15cm、Φ1.6cm×20cm、Φ1.6cm×25cm、Φ1.6cm×30cm)上海琪特分析仪器有限公司;BT600恒流泵 上海精科实验有限公司,W201B数控恒温浴锅 上海申胜生物技术有限公司;FA1004型电子分析天平 上海精密仪器仪表有限公司;515-2996型高效液相色谱仪、2996型二极管阵列检测器、Empower处理软件 美国Waters公司;Purospher STAR C18反相柱(250mm×4.65μm) 美国Merck公司。
1.3 方法
1.3.1 离子交换树脂的预处理
将树脂置于长500mm、内径30mm的交换柱内,2~3倍树脂体积的质量分数2%~4% NaOH溶液以5~8m/h速度清洗,用去离子水洗至中性,再次用5~6倍树脂体积的质量分数3%~5%盐酸溶液5~8m/h速度清洗,去离子水洗至中性,在60℃烘干备用。
1.3.2 离子交换树脂的装载
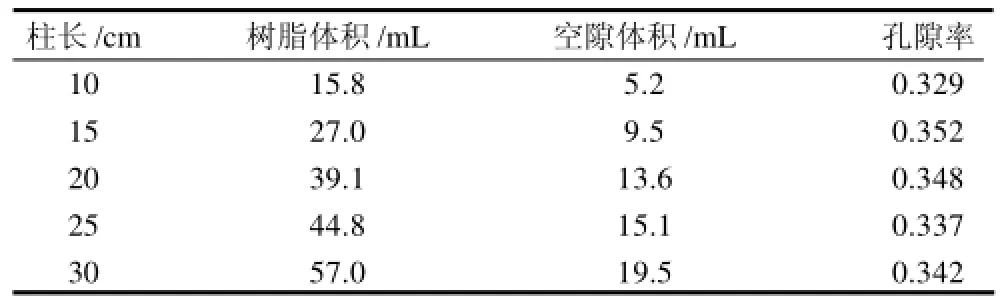
表1 固定床参数Table1 Fixed bed parameters
将经预处理的D001强酸型阳离子交换树脂,湿法装入离子交换柱中,测定不同柱子的床层体积与树脂的空隙体积,如表1所示,得催化床层的平均孔隙率为0.341。每次实验前催化床均重新装填。
1.3.3 乳酸甲醇床催化反应
把离子交换柱浸入恒温浴锅,当达到反应温度时,通过恒流泵加甲醇和乳酸混合物到离子交换柱中,控制流速,用三口烧瓶收集反应产物10mL,检测乳酸及乳酸甲酯的浓度。每个实验点重复3次,取平均值,控制相对误差5%之内。

1.3.4 乳酸及乳酸甲酯的检测
HPLC同时检测乳酸及乳酸甲酯的浓度,体积比为9:1的0.005mol/L H2SO4溶液与色谱纯甲醇作为流动相,流速1.000mL/min,检测波长210nm[23],进样量20μL,柱温为室温。流动相使用前通过0.45μm孔径的合成纤维素酯膜在真空度为0.09MPa条件下进行减压过滤,并超声波脱气15min。
2 结果与分析
2.1 进料流速对酯化率的影响
在反应醇酸物质的量比4:1、反应温度333K条件下,考察1.6~8.3mL/min范围内流速对反应的酯化率的影响,结果见图1。随着反应物流速降低,在催化床内停留时间延长,酯化率不断增大,趋于稳定。

图1 进料流速对酯化率的影响Fig.1 Effect of feed flow rate on esterification rate
进料流速影响反应物在催化床内的停留时间和扩散过程。乳酸甲醇酯化反应为可逆反应,随着反应时间延长,酯化率上升,产物乳酸甲酯及水的含量增加,逆反应速率增大,直至与正反应速率相等,酯化率维持恒定值。在固体催化反应中,反应物扩散至催化剂表面是反应过程中重要一步,进料速度直接影响反应物在催化床内的流动状态及反应物的扩散效果。图2为酯化率与时间的关系,其数据为5根固定床中不同进料流
速时测得,可以看出只要停留时间相同,酯化率相同,没有观测到扩散对酯化率的影响。

图2 酯化率与时间的关系Fig.2 Time course of esterification rate
2.2 温度对酯化率的影响
反应醇酸物质的量比4:1、进料速度5.42mL/min,考察313~353K范围内反应温度对酯化率的影响,结果见图3、4。温度升高,分子运动加剧,反应速率增加,反应的转化率也增加。与Zhang[21]、Seo[22]等研究结果相符。

图3 反应温度对酯化率的影响Fig.3 Effect of reaction temperature on esterification rate

图4 反应温度对反应速率常数的影响Fig.4 Effect of reaction temperature on reaction rate constant
从图4看出,ln(k)与1000/T呈直线关系,ln(k)=R2=0.993,k为反应速率常数。可得反应的活化能为Ea= 33805.56J/mol,较高的活化能说明此催化过程基本不受传质过程控制而是动力学控制[24]。
在所考察的温度范围内,温度变化对平衡转化率影响不大,Zhang等[21]、Seo等[22]、Sanz等[25]、Delgado等[26]得出相应结论。实际上,对于酯化或水解反应,由于反应热的存在,温度对平衡常数有微弱的影响[27-28]。
2.3 醇酸物质的量比对酯化率的影响
在温度333K、进料速度5.42mL/min条件下,以2:1~5:1之间考察初始醇酸物质的量比对酯化率的影响,结果见图5。可以看出,随着甲醇量的升高酯化转化率不断提高。在酯化反应中采用过量的甲醇有利于乳酸较彻底的转化为乳酸甲酯,提高转化率。但从图5可以看出,当物质的量比从4:1增大到5:1时转化率的增幅不大。继续增加甲醇的用量,由于树脂被甲醇饱和,乳酸甲酯的产率并没有显著增加的趋势[22,26],且增加后续甲醇分离的负担。综合考虑,醇酸物质的量比为4:1比较适合。

图5 醇酸物质的量比对酯化率的影响Fig.5 Effect of acid/alcohol molar ratio on esterification rate
2.4 树脂的重复使用
采用强酸性阳离子交换树脂代替浓硫酸催化乳酸酯化反应,可以减少副反应,催化剂能重复使用。为考察D001强酸性阳离子交换树脂重复使用效果,在醇酸物质的量比4:1、反应温度333K、进料速度5.42mL/min,采用同一催化床连续进行酯化反应1个月,每天使用1h。酯化率维持恒定值,催化效率没有明显变化,表明D001树脂重复使用效果良好。在实际使用过程中,由于发酵液中蛋白、残糖、色素等杂质吸附于催化剂表面影响催化活性,一旦发现催化性能明显下降,可以对树脂依次进行碱洗、水洗、酸洗、水洗进行再生,恢复催化性能。
3 模型及检验
3.1 模型的建立及求解
对于固相催化反应,可以分为5个基本步骤:①反应物扩散到催化剂孔道内;②反应物吸附到催化活性位点;③在催化剂表面进行催化反应;④产物解吸;⑤产物从催化剂孔道扩散至液相主体。当反应处在稳定
状态时,所有步骤均以相同速度进行,表观反应速率由最慢的步骤控制,多数情况为化学反应步骤。文献[24]报道,强酸性阳离子交换树脂做催化剂,在强极性介质中可以认为—SO3H完全解离,反应过程与均相催化反应类似。此实验过程中,反应体系为乳酸、甲醇、水、乳酸甲酯,均为极性物质,可作类均相催化反应处理。
根据以上分析过程,采用拟均相模型处理乳酸甲醇床催化反应

采用最小二乘法估计模型中各参数,使残差平方和SRS值为最小:

式中:c为反应物浓度/(mol/L),其下标HL为乳酸、MEOH为甲醇、W为水、ML为乳酸甲酯;Ea为反应活化能/(J/mol);k为反应速率常数/(mol-1·L·min-1);k0为指前因子/(mol-1·L·min-1);keq为平衡常数;r为酯化反应速率/(mol/min);R为理想气体常数(8.314J· mol-1·K-1);T为开尔文温度/K;v为进料速度/(mL/ min);V0为空隙体积/mL;xexp为实验值;xcal为模型估计值。
由图3可知:
3.2 模型的检验
模型与实验结果的比较如图1~5所示,可以看出模型与实验结果吻合良好。采用平均相对偏差MRD评价模拟效果。

式中:nsamples为样品数目;xexp为实验值;xcal为模型估计值。
计算得到MRD=2.74,进一步证明此模型可以很好的模拟乳酸甲醇床催化酯化反应过程。
4 结 论
乳酸甲醇床催化酯化反应随进料速度的降低,酯化率上升趋于平衡;随反应温度升高,反应速率变大,平衡酯化率在所研究的温度范围内基本不变;随醇酸物质的量比增加,平衡转化率升高,但增加幅度变小。采用拟均相模型模拟乳酸甲醇床催化酯化反应过程,反应活化能为33805.56J/mol,指前因子为4856.63mol-1·L·min-1,实验测得平衡常数为1.1151,在所考察的温度范围内基本不变。建立拟均相模型,模型估计值与实验值平均相对偏差为2.74%。所建立模型对乳酸甲醇床催化酯化反应工业化放大有一定的指导价值。
[1]WEE Y J, KIM J N, RYU H W. Biotechnological production of lactic acid and its recent applications[J]. Food Technology and Biotechnology, 2006, 44(2): 163-172.
[2]王立梅, 齐斌. L-乳酸应用及生产技术研究进展[J]. 食品科学, 2007, 28(10): 608-612.
[3]DUDA A, PENCZEK S. Polylactide [poly(lactic acid)]: Synthesis, properties and applications[J]. Polimery, 2003, 48(1): 16-27.
[4]JOHN R P, NAMPOOTHIRI K M, PANDEY A. Fermentative production of lactic acid from biomass: an overview on process developments and future perspectives[J]. Applied Microbiology and Biotechnology, 2007, 74(3): 524-534.
[5]潘丽军, 李兴江, 潘利华, 等. 米根霉发酵甘薯淀粉制备L-乳酸研究[J]. 食品科学, 2005, 26(2): 105-108.
[6]罗水忠, 郑志, 潘利华, 等. 雪莲果乳酸菌发酵饮料的研制[J]. 食品科学, 2009, 30(22): 387-390.
[7]JOGLEKAR H G, RAHMAN I, BABU S, et al. Comparative assessment of downstream processing options for lactic acid[J]. Separation and Purification Technology, 2006, 52(1): 1-17.
[8]LI Yebo, SHAHBAZI A. Lactic acid recovery from cheese whey fermentation broth using combined ultrafiltration and nanofiltration membranes [J]. Applied Biochemistry and Biotechnology, 2006, 132(1/3): 985-996.
[9]JOHN R P, NAMPOOTHIRI K M, PANDEY A. L(+)-lactic acid recovery from cassava bagasse fermented medium using anion exchange resins [J]. Brazilian Archives of Biology and Technology, 2008, 51(6): 1241-1248.
[10]GONZALEZ M I, ALVAREZ S, RIERA F A, et al. Purification of lactic acid from fermentation broths by ion-exchange resins[J]. Industrial and Engineering Chemistry Research, 2006, 45(9): 3243-3247.
[11]GAO Mintian, SHIMAMURA T, ISHIDA N, et al. Extractive lactic acid fermentation with tri-n-decylamine as the extractant[J]. Enzyme and Microbial Technology, 2009, 44(5): 350-354.
[12]YI S S, LU Y C, LUO G S. Separation and concentration of lactic acid by electro-electrodialysis[J]. Separation and Purification Technology, 2008, 60(3): 308-314.
[13]WEI Q, HAN Z W, BAI D M, et al. Study on recovery and purification of L-lactic acid[J]. Frontiers on Separation Science and Technology, 2004: 717-722; 1035.
[14]史高峰, 王国英. L(+)-乳酸发酵与分离技术研究进展[J]. 食品科学, 2007, 28(12): 547-551.
[15]许彬, 潘丽军, 姜绍通, 等. 乳酸酯化最适工艺研究[J]. 食品科学, 2008, 29(1): 165-168.
[16]潘丽军, 许彬, 姜绍通, 等. 乳酸乙酯水解动力学研究[J]. 食品科学, 2006, 27(6): 52-54.
[17]CHOI J, HONG W H. Recovery of lactic acid by batch distillation with
chemical reactions using ion exchange resin[J]. Journal of Chemical Engineering of Japan, 1999, 32(2): 184-189.
[18]MA li, ZHANG Yang, YANG Jichu. Purification of lactic acid by heterogeneous catalytic distillation using ion-exchange resins[J]. Chinese Journal of Chemical Engineering, 2005, 13(1): 24-31.
[19]KUMAR R, MAHAJANI S M, NANAVATI H, et al. Recovery of lactic acid by batch reactive distillation[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(7): 1141-1150.
[20]KUMAR R, NANAVATI H, NORONHA S B, et al. A continuous process for the recovery of lactic acid by reactive distillation[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(11): 1767-1777.
[21]ZHANG Yang, MA Li, YANG Jichu. Kinetics of esterification of lactic acid with ethanol catalyzed by cation-exchange resins[J]. Reactive and Functional Polymers, 2004, 61(1): 101-114.
[22]SEO Y, HONG W H. Kinetics of esterification of lactic acid with methanol in the presence of cation exchange resin using a pseudohomogeneous model[J]. Journal of Chemical Engineering of Japan, 2000, 33(1): 128-133.
[23]VU D T, KOLAH A K, ASTHANA N S, et al. Oligomer distribution in concentrated lactic acid solutions[J]. Fluid Phase Equilibria, 2005, 236 (1/2): 125-135.
[24]HELFFERICH F G. Ion exchange[M]. New York: McGraw-Hill, 1962.
[25]SANZ M T, MURGA R, BELTRAN S, et al. Kinetic study for the reactive system of lactic acid esterification with methanol: Methyl lactate hydrolysis reaction[J]. Industrial and Engineering Chemistry Research, 2004, 43(9): 2049-2053.
[26]DELGADO P, SANZ M T, BELTRAN S. Kinetic study for esterification of lactic acid with ethanol and hydrolysis of ethyl lactate using an ion-exchange resin catalyst[J]. Chemical Engineering Journal, 2007, 126(2/3): 111-118.
[27]JIANG Shaotong, LIU Mo, PAN Lijun. Kinetic study for hydrolysis of methyl lactate catalyzed by cation-exchange resin[J]. Journal of the Taiwan Institute of Chemical Engineers, 2010, 41(2): 190-194.
[28]MAI T P. Experimental investigation of heterogeneously catalyzed hydrolysis of esters[D]. Magdeburg: Otto-von-Guericke-Universitat Magdeburg, 2006.
Fixed Bed Esterificaiton of Lactic Acid with Methanol
LIU Mo,JIANG Shao-tong,LI Chao-meng,WU Xue-feng,PAN Li-jun,TANG Xiao-ming
(Key Laboratory for Agricultural Products Processing of Anhui Province, School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
The esterification-hydrolysis method has been reported to be an effective technique for the refining of crude lactic acid product, which based on the principle that lactic acid is easy to react with lower alcohols to form volatile esters, which donate high-purity lactic acid after being hydrolyzed. Under the catalysis of strong acid cation exchange resin bed, the esterification between lactic acid and methanol was performed in the present study. The effects of feed flow rate, reaction temperature and acid/alcohol molar ratio on esterification rate were examined. As the feed flow rate descended, the esterification rate showed a change trend to initially ascend and then keep stable. Increasing reaction temperature led to a higher reaction rate, but the equilibrium esterification rate was kept basically unchanged. With increasing acid/alcohol molar ratio, the equilibrium esterification rate revealed a smaller incremental increase. The reaction rate data were correlated with a kinetic model based on the pseudohomogeneous catalysis. The activation energy, pre-exponential constant and equilibrium constant of the reaction were found to be 33805.56 J/mol, 4856.63 mol-1·L·min-1, and 1.1151, respectively. The mean relative deviation between the experimental and predicted values was 2.74%.
lactic acid;esterification;fixed bed;pseudo-homogeneous model
TQ032.4
A
1002-6630(2010)22-0031-05
2010-03-11
国家“863”计划项目(2007AA10Z361);安徽省农产品精深加工重点实验室项目(2009AKSY0102)
刘模(1985—),男,博士研究生,研究方向为农产品加工及贮藏。E-mail:liumo1985@gmail.com
*通信作者:姜绍通(1954—),男,教授,硕士,研究方向为农产品生物化工。E-mail:jiangshaotong@yahoo.com.cn
