提取条件对蓝靛果花色苷抗氧化活性的影响
2010-03-23包怡红李文星齐君君王振宇
包怡红,李文星,齐君君,王振宇*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
提取条件对蓝靛果花色苷抗氧化活性的影响
包怡红,李文星,齐君君,王振宇*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
为研究提取条件对蓝靛果花色苷抗氧化活性的影响,用溶剂浸提法提取蓝靛果花色苷,通过正交试验确定其最佳提取工艺条件,分别采用紫外分光光度法、H2O2/Fe体系和DPPH法测定花色苷的提取量及其抗氧化活性。结果表明,提取溶剂为体积分数70%的乙醇溶液、料液比1:15(g:mL)、提取温度60℃、提取时间90min、pH2、提取3次为最佳提取工艺参数,在此提取工艺条件下,花色苷含量吸光度为0.789,羟自由基清除率为18.92%,DPPH自由基清除率为41.57%。
蓝靛果;花色苷;提取工艺条件;抗氧化
蓝靛果(Lonicera edulis)别称蓝靛果忍冬,属忍冬科(Caprifoliaceae)忍冬属(Lonicera L.)。蓝靛果果实为浆果,富含糖类、有机酸、矿物质、多种维生素和微量元素,是理想的天然保健营养食品,被世界粮农组织定为世界稀有珍贵野生浆果。在我国蓝靛果主要分布于北纬40°~53°之间小兴安岭和长白山等地,抗晚霜能力强,属耐寒植物[1-3]。
蓝靛果因其潜在的营养价值、药用价值和商用价值,具有极为广阔的国内外市场。前苏联学者从20世纪60年代起,深入研究蓝靛果,并发现了该果中含有丰富的VP活性物质,俄罗斯把蓝靛果加工成宇航员专用的饮料。我国有关专家从20世纪80年代开始对蓝靛果营养保健功能进行专项研究,相继开发出的饮料、果汁、果酒等保健饮品、功能食品、营养滋补品和药品等系列产品[4-5]。
蓝靛果果实中富含大量的花青素,花青素与糖以糖苷键结合而形成糖苷,称为花色苷(anthocyanin)。现代研究表明,花色苷具有消除自由基、抗衰老、抗异变、抗炎症[6-7]、改善视力、预防和治疗心血管疾病[8]、抗癌[9]、提高免疫力等多种生理活性功能,花色苷发挥这些生理活性大多因为其可以与很多氧化剂发生反应,减少氧化剂对人机体的危害[10]。近年来,对花色苷的研究主要集中于对各类植物及其产品中的花色素苷的种类数量的定性、定量研究和对花色素苷药理学的研究两个方
面[11]。对蓝靛果花色苷提取条件的研究已有较多的报道,但提取条件对蓝靛果花色苷抗氧化活性的研究较少。本实验以速冻蓝靛果为原料,采用溶剂法,考察不同提取条件对花色苷提取量及花色苷抗氧化活性的影响,确定最佳提取条件,旨在为天然抗氧化剂的开发应用提供依据。
1 材料与方法
1.1 材料与试剂市售蓝靛果,清洗沥干后包装置于冰箱冻藏备用。DPPH Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
FW100高速万能粉碎机 天津市泰斯特仪器有限公司;756PC紫外-可见光分光光度计 上海光谱仪器有限公司;恒温水浴锅 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 蓝靛果花色苷的提取工艺流程
蓝靛果→除杂→冲洗、沥干→冻藏→冻样研磨→加浸提液提取→抽滤→滤液
1.3.2 蓝靛果花色苷的提取
精确称取10g蓝靛果冻果,用高速万能粉碎机粉碎后置于锥形瓶中,加入一定体积的提取液并密封,放入恒温水浴锅中。以花色苷提取量和抗氧化能力为考核指标,分别研究不同提取溶剂、提取剂体积分数、料液比、提取温度、提取时间、提取pH值、提取次数等因素对蓝靛果花色苷提取量及其抗氧化活性的影响,在此基础上选取料液比、提取剂体积分数、温度和时间为影响因素进行L9(34)正交试验确定最佳提取工艺。
1.3.3 花色苷含量的测定方法
滤液用柠檬酸-Na2HPO4缓冲液定容后,以缓冲液作空白对照,进行光谱扫描,确定最大吸收波长为520nm。在此波长处进行提取液吸光度测定,通过色价法计算,正交试验中将提取液定容至500mL,用吸光度表示花色苷的含量[12],根据吸光度大小确定优化工艺条件。
1.3.4 羟自由基清除率的测定[13]
在试管中分别加入1mL 10mmol/L水杨酸乙醇溶液、样液、1mL 10mmol/L FeSO4溶液、最后加入2mL 10mmol/L H2O2启动Fenton反应,摇匀后于510nm处测定吸光度AX;用蒸馏水代替样液,测得的吸光度值为A0;取2mL蒸馏水代替H2O2,测得的吸光度为AX0。实验进行3次平行实验。羟自由基清除率I表示为:

1.3.5 DPPH自由基清除率的测定[14]
精确移取样液与3mL 60μmol/L的DPPH溶液均匀混合,反应30min后在517nm处测定其吸光度Ai,同时用相同的方法测定等体积无水乙醇与3mL 60 μ mol/L的DPPH溶液混合后的吸光度A0,以及样品溶液与3mL无水乙醇混合液的吸光度Aj。实验进行3次平行实验。通过下列公式计算DPPH自由基清除率R:

1.3.6 确定最佳工艺条件的正交试验
采用正交试验设计,确定最佳提取条件。以料液比、提取剂体积分数、温度和时间为影响因素,分别以花色苷含量、羟自由基(·OH)清除率和DPPH自由基清除率为指标,采用正交表L9(34)进行试验,正交试验结果采用多指标综合评价方法进行分析[15],各因素和水平的选取结果如表1所示。

表1 工艺优化L9(34)正交试验因素水平表Table1 Factors and levels in orthogonal array design
2 结果与分析
2.1 提取溶剂对蓝靛果花色苷提取量的影响
按料液比1:10加入提取溶剂,提取温度50℃、提取时间90min。提取溶剂分别为无水乙醇、70%乙醇溶液、水、乙酸乙酯、丙酮、正丁醇、乙醚,考察提取溶剂对提取物中花色苷含量及其抗氧化活性的影响,结果如图1所示。
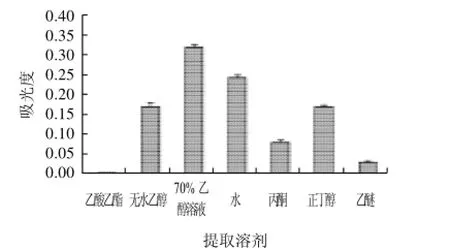
图1 不同提取溶剂对蓝靛果花色苷提取量的影响Fig.1 Effect of solvents on anthocyanins extraction
由图1可知,花色苷的吸光度值差异显著,蓝靛果花色苷溶于水和乙醇等极性溶剂,70%乙醇溶液提取效果最好,其次为水,接下来是无水乙醇和正丁醇,乙醚和乙酸乙酯提取效果较差。
2.2 乙醇溶液体积分数对蓝靛果花色苷提取量及其抗氧化活性的影响
在料液比1:10、提取温度50℃、提取时间90min、
pH2的条件下,考察不同乙醇溶液体积分数对花色苷提取量及其抗氧化活性的影响,结果如图2所示。

图2 不同乙醇溶液体积分数对蓝靛果花色苷提取量和抗氧化活性的影响Fig.2 Effect of ethanol concentration on anthocyanins extraction and hydroxyl and DPPH radical scavenging capacities of anthocyanins from the fruits of Lonicera edulis
由图2可知,随着乙醇溶液体积分数的增加,花色苷提取量呈增加趋势,当乙醇溶液体积分数达到70%时,花色苷提取量增至最大,吸光度可达0.800,然后随乙醇溶液体积分数进一步升高,花色苷提取量反而减少。乙醇的加入使提取液的极性降低,说明花色苷的提取与提取液的极性有关。随着乙醇溶液体积分数的增加,蓝靛果花色苷对·OH和DPPH自由基的清除能力越来越强,当乙醇溶液体积分数为70%时,花色苷清除能力最强,·OH清除率和DPPH自由基清除率分别比乙醇溶液体积分数为60%时清除率提高了20.21%和7.14%。因此初步选择70%乙醇溶液作为提取溶剂。
2.3 提取温度对蓝靛果花色苷提取量及其抗氧化活性的影响
按照料液比1:10加入70%乙醇溶液提取,提取pH2、提取时间90min,研究不同提取温度对花色苷提取量及其抗氧化活性的影响,结果如图3所示。

图3 不同提取温度对蓝靛果花色苷提取量和抗氧化活性的影响Fig.3 Effect of extraction temperature on anthocyanins extraction and hydroxyl and DPPH scavenging capacity of anthocyanins from the fruits of Lonicera edulis
由图3可知,随着温度的升高,花色苷提取量呈增加趋势,但是温度增至50~60℃之后,花色苷提取量呈下降趋势。可能是由于花色苷是一种活性物质,温度过高,会影响花色苷的稳定性,导致花色苷部分分解,从而造成了吸光度下降。30℃时提取物对·OH清除率远小于80℃时提取物,但对DPPH自由基的清除率却略高于80℃时提取物。可能由于温度不同,使花色苷芳香环上的化学基团的位置和种类发生改变,从自由基分子接受未配对电子的能力也随之发生变化,再加上两种自由基反应机制不同造成的。提取温度为50℃时,蓝靛果提取物的·OH清除率最高,但是对DPPH自由基清除率与60℃时清除率相差无几,因此初步选择提取温度为50℃。
2.4 提取时间对蓝靛果花色苷提取量及其抗氧化活性的影响
按照料液比1:10加入70%乙醇溶液提取,提取pH2、提取温度50℃,研究不同提取时间对花色苷提取量及其抗氧化活性的影响,结果如图4所示。
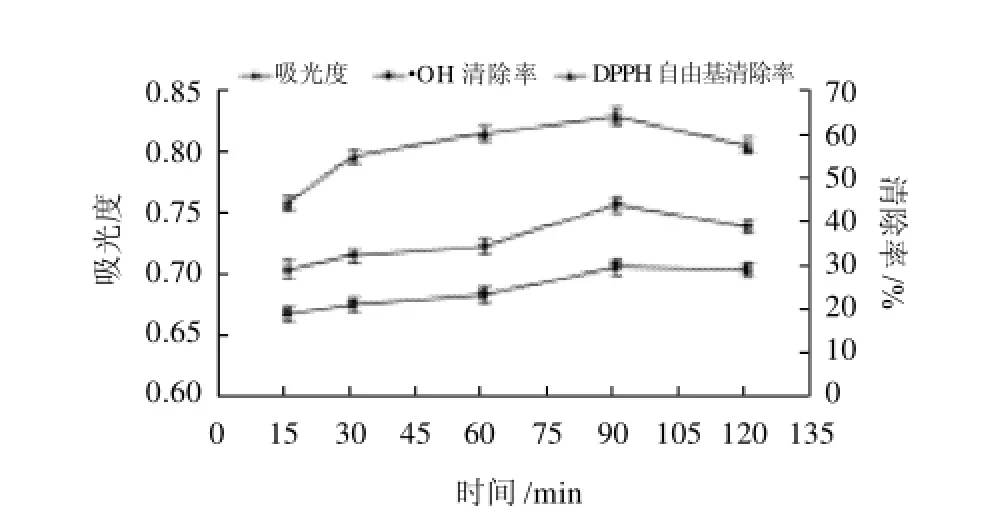
图4 不同提取时间对蓝靛果花色苷提取量和抗氧化活性的影响Fig.4 Effect of extraction time on anthocyanins extraction and hydroxyl and DPPH scavenging capacity of anthocyanins from the fruits of Lonicera edulis
由图4可知,随着提取时间的延长,花色苷溶出增加,但是色素不稳定,时间过长,花色苷会因发生氧化反应而有所分解,导致吸光度下降。随着提取时间的增加,清除率呈上升趋势,当提取时间为90min时,提取物对·OH和DPPH自由基的清除率都高于其他提取温度条件。当提取时间为120min时,·OH清除率和DPPH自由基清除率分别比90min时下降了2.10%和11.63%,因此初步选择提取时间为90min。
2.5 pH值对蓝靛果花色苷提取量及其抗氧化活性的影响
按料液比1:10加入70%乙醇溶液、提取温度50℃、浸提90min,研究不同pH值对花色苷提取量及其抗氧化活性的影响,结果如图5所示。

图5 提取pH值对蓝靛果花色苷提取量和抗氧化活性的影响Fig.5 Effect of pH on anthocyanins extraction and hydroxyl and DPPH scavenging capacity of anthocyanins from the fruits of Lonicera edulis
由图5可知,pH1时花色苷吸光度最高,随着pH值增加,溶液的吸光度呈显著降低趋势。花青素在酸性溶液中,以蓝色的醌式(脱水)碱(A)、红色的黄烊阳正离子(AH+)、无色的甲醇假碱(B)和查尔酮(C)4种形式存在,其中AH+和A为有色物质,存在着如下平衡:A AH+B C,pH值的增加导致这两种有色物质浓度减少,故吸光度降低。过高或过低的pH值都会影响花色苷的稳定性。因此,提取pH2时最佳。pH1时,对·OH清除率远远高于其他,而pH2时,对DPPH自由基的清除率最高。此变化规律与蓝靛果提取物吸光度的变化规律不一致。pH值对花色苷的结构有影响,导致其对·OH和DPPH自由基清除率规律变化不一致,原因可能是两种反应机理不同,不同的花色苷形式的电子数不一致造成的。因此初步选择提取pH2。
2.6 液料比对蓝靛果花色苷提取量的影响
按不同液料比加入pH2、70%乙醇溶液、水浴50℃、浸提90min,抽滤,定容,测吸光度,研究不同料液比对花色苷提取量的影响,结果如图6所示。
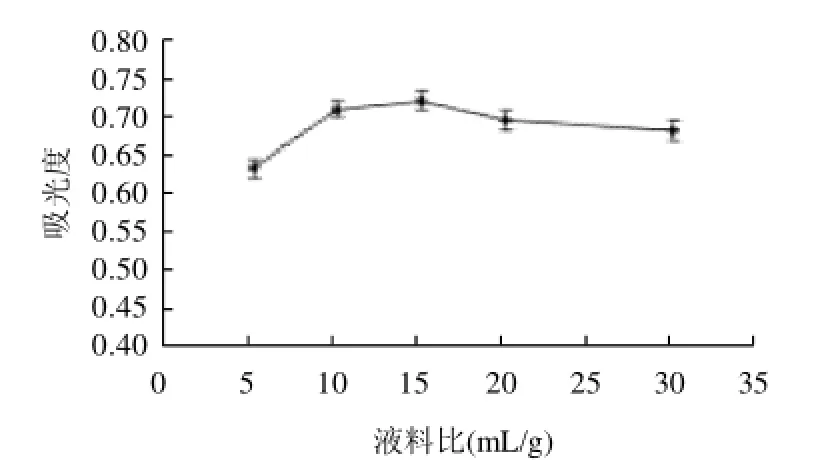
图6 料液比对蓝靛果花色苷提取量的影响Fig.6 Effect of solid/liquid ratio on anthocyanins extraction and hydroxyl and DPPH scavenging capacity of anthocyanins from the fruits of Lonicera edulis
由图6可知,随着液体用量的增大,花色苷溶出越多,但是若采取较大的液料比,会使提取成本增加,而且还会增加接下来的浓缩工作量,因此实验中采用液料比为10:1。
2.7 提取次数对蓝靛果花色苷提取量的影响
按料液比1:10加入70%乙醇溶液提取,提取pH2、提取温度50℃、浸提90min,累计提取5次,研究提取次数对花色苷提取量的影响,结果如图7所示。
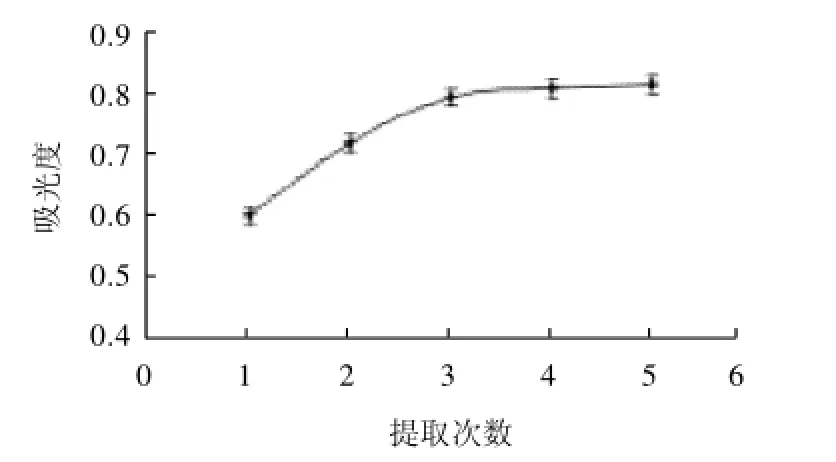
图7 提取次数对蓝靛果花色苷提取量的影响Fig.7 Effect of extraction tnumber on anthocyanins extraction and
由图7可知,提取次数越多,累计提取量越高,但是提高幅度不同,第3次提取之后花色苷提取量增加率已经非常低了,因此提取3次即可。
2.8 正交试验分析
正交试验结果采用多指标综合评价方法,选用Z分综合评价法(Z-score)进行指标的无量纲化。其中花色苷含量、·OH清除率和DPPH自由基清除率这三个指标均为“高优”指标,结果见表2、3。
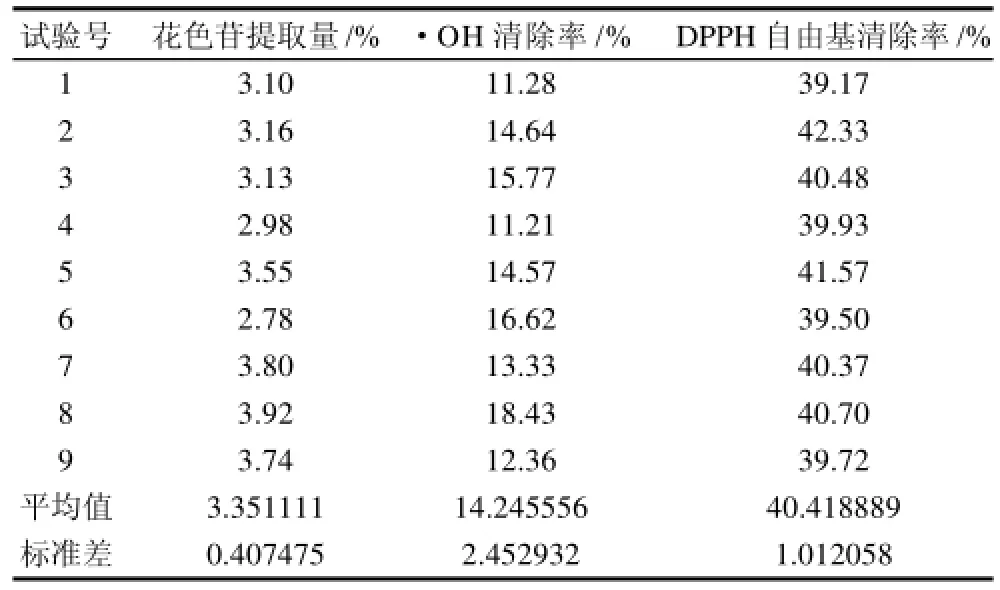
表2 工艺优化L9(34)正交试验设计及结果Table2 Orthogonal array design arrangement and experimental results
由表3极差分析结果可知,各因素影响程度的大小关系为B>A>C>D,即提取剂体积分数对提取效果的影响最大,料液比次之,温度的影响较小,时间的影响最小。试验得到的蓝靛果花色苷提取的最优组合为A3B2C3D2,即料液比1:15、乙醇溶液体积分数70%、提取温度60℃、提取时间90min。在此条件下,蓝靛果花色苷含量可达0.789,·OH清除率为18.92%,DPPH自由基清除率为41.57%。

表3 Z分综合评价法分析结果Table3 Results of Z-score comprehensive evaluation of orthogonal array experimental result
3 结 论
由于天然抗氧化剂发挥抗氧化活性往往是通过多种途径,所以本实验采用多指标综合评价方法,以对·OH和DPPH自由基的清除率为指标,得到提取具有较高抗氧化活性蓝靛果花色苷的提取条件。本实验通过单因素试验和正交试验确定了溶剂浸提法提取蓝靛果花色苷的最佳工艺条件为乙醇溶液体积分数70%、料液比1:15、提取温度60℃、提取90min、提取pH2、提取次数3次。各因素影响程度的大小关系为提取剂体积分数>料液比>温度>时间。蓝靛果是一种具有较强抗氧化活性的浆果,可以有效地防止羟自由基等氧化剂对人体造成伤害,从而提高免疫力、防治疾病,可以作为一种天然抗氧化剂的重要来源。
[1]赵桂红. 蓝靛果天然色素提取、精制条件及稳定性研究[D]. 哈尔滨: 东北农业大学, 2003.
[2]ZHUO Lihuan, WANG Ling, CHEN Quanshe, et al. Wild fruit resources and exploitation in Xiaoxing an mountains[J]. Journal of Forestry Research, 1999, 10(1): 31-33.
[3]向延菊, 郑先哲, 王大伟. 野生浆果资源: 蓝靛果忍冬利用价值的研究现状及应用前景[J]. 东北农业大学学报, 2005, 36(5): 669-671.
[4]王振宇, 杨玲. 蓝靛果的研究利用现状及其发展前景[J]. 安徽科技学院学报, 2009, 23(3): 18-20.
[5]赵玉红, 苗雨, 张立钢. 双酶法提取蓝靛果果渣中花色苷酶解条件的研究[J]. 中国食品学报, 2008, 8(4): 76-79.
[6]任玉林, 李华, 邴贵德, 等. 天然食用色素: 花色苷[J]. 食品科学, 1995, 16(7): 22-27.
[7]唐传核, 彭志英. 天然花色苷类色素的生理功能及应用前景[J]. 饮食与速冻食品工业, 2000(1): 26-28.
[8]KONGA J M, CHIAA L S, GOHA N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64: 923-933.
[9]WANG Lishu, STONER G D. Anthocyanins and their role in cancer prevention[J]. Cancer letters, 2008, 269: 281-290.
[10]DU Q, ZHENG J, XU Y. Composition of anthocyanins in mulberry and their antioxidant activity[J]. Journal of Food Composition and Analysis, 2008, 21: 390-395.
[11]曹小勇, 李新生. 黑米花色素苷类色素研究现状及展望[J]. 氨基酸和生物资源, 2002, 24(1): 3-6.
[12]赵慧芳, 王小敏, 闾连飞, 等. 黑莓果实中花色苷的提取和测定方法研究[J]. 食品工业科技, 2008(5): 176-179.
[13]王丽媛, 苗利利, 仇农学. 苹果渣中高纯度多酚物质的制备及体外抗氧化活性评价[J]. 农产品加工: 学刊, 2009(3): 30-33.
[14]杨玲, 王振宇. 蓝靛果乙醇提取物体外抗氧化作用的研究[J]. 食品工业科技, 2009, 30(12): 162-164.
[15]赵应征, 鲁翠涛, 梅兴国. 常用多指标综合评价法在优选实验中的应用[J]. 医学研究生学报, 2004, 17(7): 624-626.
[16]徐渊金, 杜琪珍. 花色苷分离鉴定方法及其生物活性[J]. 食品与发酵工业, 2006, 32(3): 67-72.
[17]赵桂红, 王世平. 蓝靛果天然红色素的提取及稳定性研究[J]. 食品研究与开发, 2009, 30(6): 166-167.
[18]赵彦杰. 蓝靛果紫红色素的提取及其理化性质研究[J]. 食品科学, 2006, 27(10): 276-278.
[19]LONGO L, VASAPOLLO G. Extraction and identification of anthocyanins from Smilax aspera L. berries[J]. Food Chemistry, 2006, 94: 226-231.
[20]石光, 张春枝, 陈莉, 等. 蓝莓果实中花色苷提取工艺的研究[J]. 食品研究与开发, 2008, 29(4): 7-9.
[21]李颖畅, 孟宪军, 修英涛, 等. 蓝莓果中花色苷的提取工艺研究[J].食品科技, 2007(11): 73-76.
[22]刘定远. 医药数理统计方法[M]. 北京: 人民卫生出版社, 2006: 170-180.
Effect of Extraction Conditions on Antioxidant Properties of Anthocyanins from the Fruits of Lonicera edulis
BAO Yi-hong,LI Wen-xing,QI Jun-jun,WANG Zhen-yu*
(Sohool of Forestry, Northeast Forestry University, Harbin 150040, China)
Anthocyanins in the fruits of Lonicera edulis was extracted using aqueous ethanol, and the effects of six extraction conditions on anthocyanin extraction and the abilities of the extracted anthocyanins to scavenge hydroxyl and DPPH free radicals were evaluated by single factor and orthogonal array design methods. Using the Z-score comprehensive evaluation method, the orthogonal array experimental results were analyzed. UV spectrophotometry and a H2O2/Fe system were used to determine anthocyanin extraction yield and hydroxyl free radical scavenging rate, respectively. Ethanol concentration of 70%, material/liquid ratio of 1:15, extraction temperature of 60 ℃, extraction duration of 90 min, pH of 2 and extraction number of 3 were found optimal. The absorbance at 520 nm of the extract obtained under the optimal extraction conditions was 0.789, and tis hydroxyl free radical and DPPH radical scavenging rates were 18.92%and 41.57% respectively.
Lonicera edulis;anthocyanin;extraction;antioxidant properties
TS201.1
A
1002-6630(2010)22-0020-05
2010-06-07
哈尔滨市科技局重大攻关项目(2008AA6A)
包怡红(1970—),女,教授,博士,研究方向为天然产物活性成分生物转化和食品生物技术。E-mail:baoyihong@163.com
*通信作者:王振宇(1957—),男,教授,博士,研究方向为植物活性物质及功能食品。E-mail:wzy219001@yahoo.com.cn
