1株产漆酶白腐真菌的筛选和鉴定
2010-01-11关艳丽郭玲玲孙立梅
关艳丽,李 莉,陈 飞,郭玲玲,华 霜,孙立梅
(1.辽宁省微生物科学研究院,辽宁朝阳 122000;2.沈阳农业大学土地与环境学院,辽宁沈阳 110161)
白腐真菌(white rot fungi)是一类丝状真菌,因附生在树木或木材上,引起木质白色腐烂而得名。通过菌丝侵入木质细胞腔内并分泌、释放降解木质素和其他木质组分的生物酶,导致木质腐烂成为淡色的海绵状团块白腐。分类学上,白腐真菌属于真菌门,绝大多数为担子菌纲,少数为子囊菌纲[1]。白腐菌有显著的降解木质素的能力,在所有能降解木质素的微生物中,白腐菌是目前研究最系统的、对木质素具有最强降解能力的一类真菌,它通过分泌胞外氧化酶来降解木质素,这种木质素降解酶系的主要成分有漆酶、木质素过氧化物酶和锰过氧化物酶等。近年来,有关漆酶的研究在国际上越来越受到重视。由于它在降解木质素、微生物菌体形态形成以及植物病原等方面的功能,使其在制浆造纸工业、染发、饮料加工等方面得到了广泛的研究和应用。尤其在制浆造纸工业的纸浆生物漂白、废水处理等方面具有很大的研究价值和应用潜力。由于漆酶可与有毒的酚类物质作用,使苯氧基类除草剂、石油工业废物等造成环境污染的物质去毒,因而颇具环保意义[2]。本文主要进行产漆酶白腐菌的筛选,结合形态学及分子生物学方法对筛选得到的白腐菌进行分类鉴定,为对该菌的进一步研究提供试验基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 辽宁省朝阳市腐朽立木、伐木桩;锦州地区杨树、槐树上生长的子实体,菌盖无柄,半圆形,垫状,新鲜时软木栓质,干后较硬,白色至淡黄色,有细毛。
1.1.2 培养基 ①PDA综合培养基:马铃薯200 g,葡萄糖20 g,KH2PO40.3 g,MgSO4·7 H2O 0.15 g,琼脂18 g,水1 L,pH自然,用于菌种初筛;②白腐菌变色反应培养基(按徐晓峰等[3]介绍的方法略加改动):KH2PO41.0 g,NaH2PO40.2 g,MgSO4·7 H2O 0.5 g,VB10.1 mg,CaCl20.1mg,FeSO4·7 H2O 0.1 mg,ZnSO4·7 H2O 0.01 mg,CuSO4·5 H2O 0.2 mg,愈创木酚100 mg,NH4NO38.06 mg,琼脂18 g,水1 L,pH 5.0,用于菌种复筛;③PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,水1 L,pH自然,用于菌种保藏。
1.2 方法
1.2.1 菌种的分离和初筛[3]从采集的样品中切下带菌的部位,通常切成较小的块,将采集的样品用无菌水反复漂洗2次,每次约1 min,然后用无菌滤纸将样品吸干,点接到PDA平板上,每个平板2~3块,28℃培养2~3 d,挑选出长有白色菌丝或白色茸状的菌落平板,将其反复纯化直至获得纯菌株。将初步获得的纯菌株接种在PDA平板上,约培养4 d,用0.1 mol/L愈创木酚的乙醇溶液(0.5 g愈疮木酚溶于30 mL 95%的乙醇中)滴定菌落边缘,当有漆酶存在时,滴定区域变成浅红色。发生变色的菌株需进行复筛试验。
1.2.2 菌种的复筛 采用2种培养基对其进行复筛,将初筛获得的纯菌株接种到变色反应培养基平板中,每一菌株做2个平行,28℃培养9 d,观察分析生长在培养皿中变色圈和菌丝圈尺寸的大小和菌丝颜色变化。
1.2.3 菌株的鉴定 ①菌株形态观察:将菌株纯培养物接种于PDA培养基,28℃下导致培养,待刚长出菌丝时,将无菌的盖玻片斜插入平板内(插片法)[4],观察并记录菌落特征和菌体形态特征;②菌丝培养及基因组DNA的提取:将低温保藏的白腐菌菌种转接到PDA斜面上,28℃培养。7 d后转接到100 mL PDA液体培养基中,28℃100 r/min振荡培养4 d,收集菌丝,FEN缓冲液洗涤后放入-20℃冰箱保藏备用。基因组DNA的提取在CTAB法[5]上略加改动,DNA提取物于-4℃冰箱贮藏备用;③ITS基因PCR扩增:扩增采用真菌通用引物对ITS1/ITS4(由大连宝生物合成)。具体序列为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系(25μL):10×buffer 2.5 μL,dNTP(各2.5 mmol/L)1μL,引物各1μL,Taq酶(83.35 nkat/L)0.25μL,模板DNA 1μL,ddH2O 18.25μL。PCR反应条件:95℃变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,共30个循环,72℃延伸10 min。取5μL PCR产物,1.0%琼脂糖凝胶电泳检测。用DNA凝胶纯化试剂盒回收PCR产物;④PCR产物测序及系统发育分析:纯化的产物由大连宝生物公司进行正反链双向测序。将测得的序列与在Gen-Bank中进行BLAST搜索到的相关序列用CLUSTAL X[6]软件进行对位排列后再进行手工校正。系统发育树分析采用软件MEGA4.1中的邻近相邻法进行,利用bootstrap(1 000次重复)检验各分支的置信度。
2 结果与分析
2.1 菌种的分离筛选
2.1.1 初筛 通过初步分离获得25株具有漆酶活性的白腐菌,活性的大小还需进行复筛。
2.1.2 复筛 漆酶活性的检测可根据Bavendamm的方法进行,由于培养基中加入一定量的愈创木酚,含有漆酶的菌株在这特定培养基上长出的菌丝能产生明显的桔红色。用Bavendamm方法能判断菌株有无漆酶,而且根据变色圈颜色深浅能大致分析出试验菌株含有漆酶活力高低。PualAnder等[7]报道,可以用变色圈和菌丝圈的比值作为判断菌种选择性降解木质素的依据。对培养过程中每天变色圈和菌丝圈尺寸大小和变色圈颜色深浅变化进行分析,筛选出1株产漆酶较高的菌株,编号为4220。此菌株作为进一步研究的试验菌株。
2.2 菌株的鉴定
2.2.1 菌株形态观察 菌丝生长快,平板在1周内覆盖。菌落白色,大而疏松,与培养基结合较紧密,接种点周围菌丝较薄,可见平板反面,有较浓的蘑菇味,愈创木酚反应20 min后滴定区域变为深红褐色,见图1;菌丝透明,节状分隔,纤维菌丝较多,厚壁,菌丝大量分枝,有锁状联合,见图2。

2.2.2 菌株的ITS区PCR扩增及测序 菌株4220的ITS区(含5.8S区)PCR扩增电泳结果显示的条带特异、效果好,见图3。采用低熔点琼脂糖法进行切胶纯化回收并测序。菌株4220 ITS区段总长度为636 bp。
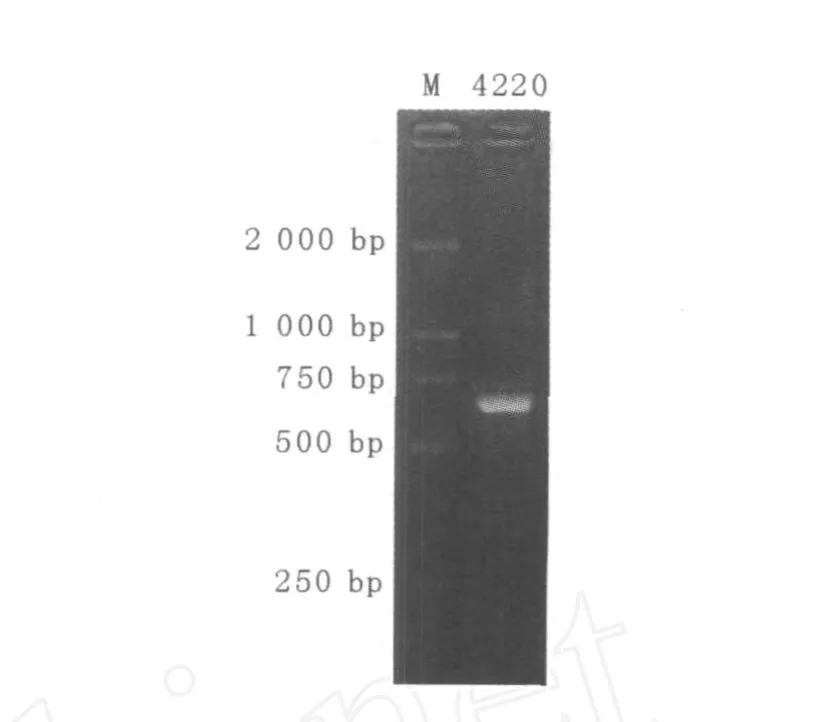
图3 ITS-PCR扩增结果Fig.3 ITS Amplification patterns
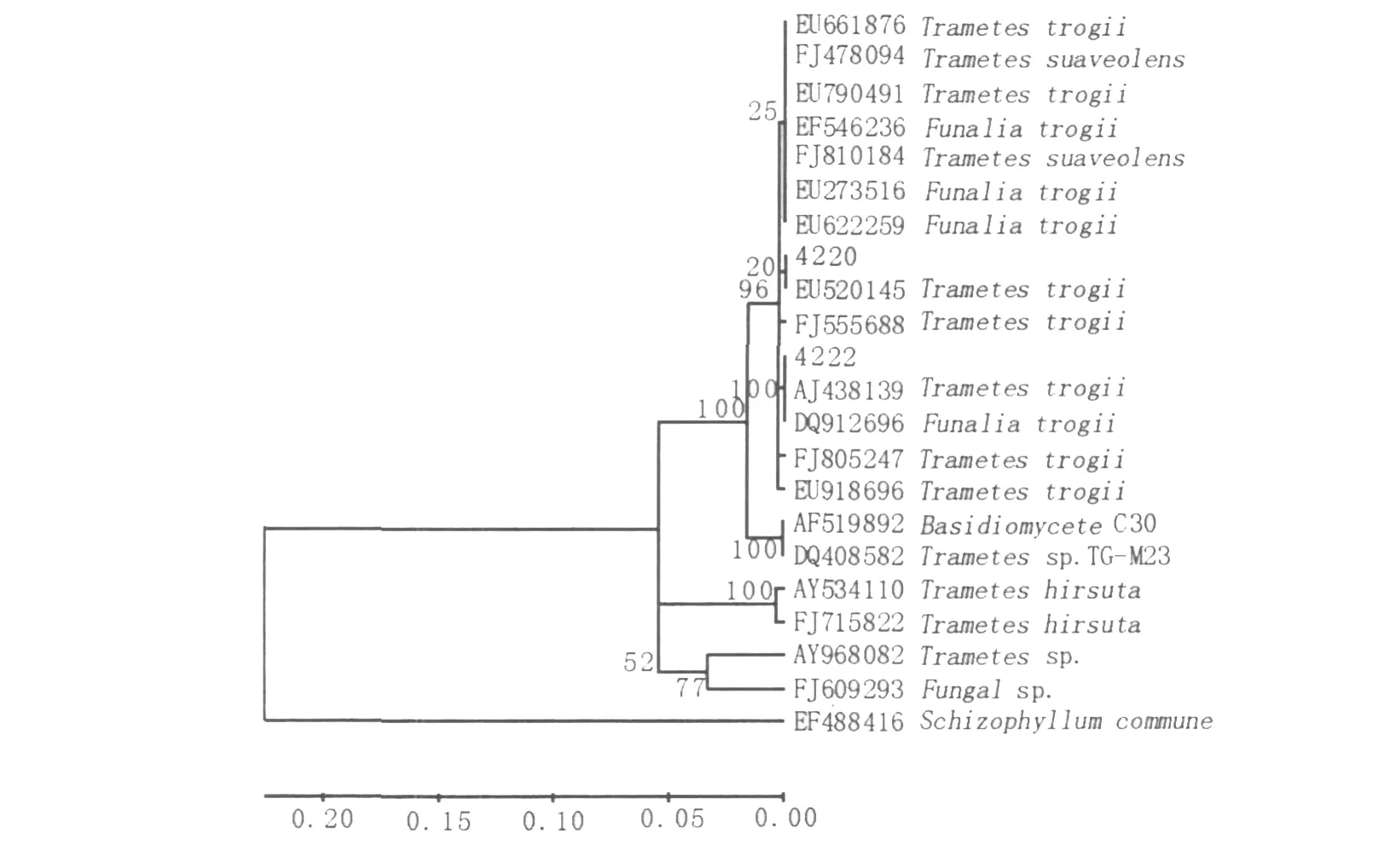
图4 根据18S rRNA序列同源性构建的系统发育树Fig.4 Phylogenetic tree based on 18S rRNA sequences homology
2.2.3 菌株系统发育树的分析 GenBank中同源性较高菌株的ITS序列与本实验所测的菌株ITS序列进行比对,利用CLUSTAL X软件将序列匹配排列后,利用MEGA4.1软件采用邻近相邻法构建系统发育树,结果见图4。EF488416(Schizophyllum comm une)为外类群(outgroup),树枝上数值为bootstrap值。从系统发育树中可以看出菌株4220与EU520145聚在同一分支,但置信度仅为20%,在上一级分支上的置信度为96%,结合菌体的形态学特征及子实体形态可以确定4220为Tram etes suaveolens。目前该菌已被Gen-Bank收录,收录号为GU199349。
3 讨 论
本研究分离得到1株产漆酶活性较高菌株4220,经形态学特性研究和ITS序列分析,鉴定该菌株为Tram etes suaveolens。传统的真菌分类主要是根据子实体外观形态或微观形态结构特征,但表型特征受环境影响较大,这就使在不同环境条件下生长的同一种真菌经常表现出较大的形态差异,给分类和鉴定带来困难,真核生物编码核糖体核酸的基因是一个串联的重复转录单位,即18S rRNA-ITSI-5.8S rRNA-ITSII-28S rRNA,约100~200拷贝,包括编码区和非编码区[8],编码区18S、5.8S、28S rDNA基因序列进化缓慢而相对保守,但这3个基因序列之间的ITS序列的进化则相当迅速,因而rDNA序列广泛用于真菌各级水平的系统学研究。18S rDNA和28S rDNA分别约为1.8 kb和3.4 kb,序列中既有保守区又有可变区,在进化速率上比较保守,其中18S比28S基因更保守,是在系统发育中种级以上阶元的良好标记。5.8S基因分子量小且高度保守,较少用于系统学研究,但它为真菌r DNA PCR扩增的通用引物的设计提供了极大方便。由于ITS区不加入成熟核糖体,所以受到的选择压力较小,进化速率较快,在绝大多数的真核生物中表现出了极为广泛的序列多态性。同时ITS序列长度适中,从人类到酵母的各种真核生物中ITS的序列长度为1 000 bp到小于300 bp大小不等,人们可以从不太长的序列中获得足够的信息,可广泛用于属内种间或种内群体的系统学研究。所以rDNA ITS序列具有菌种分类鉴定的意义。
[1] 董亮,谢冰,黄民生,等.白腐真菌酶学与分子生物学研究进展[J].环境科学与技术,2005,28(5):102-104.
[2] 韩立荣,张双玺,祝传书,等.高效纤维素降解真菌的筛选和鉴定[J].西北农林科技大学学报:自然科学版,2008,36(9):169-174.
[3] 徐晓峰,何北海,徐丽丽,等.白腐菌的筛选及对松木片木质素和树脂的脱除[J].华南理工大学学报:自然科学版,2007,35(4):105-111.
[4] 刘士旺.真菌形态的几种观察方法[J].生物学通报,1998,33(10):45.
[5] 江洁,杜连祥.基因工程菌里氏木霉染色体DNA的提取方法[J].生物技术,2004,14(2):24.
[6] 曹小迎,蒋继宏,孙勇,等.刺革菌科4种药用真菌的ITS区序列分析[J].中草药,2007,38(2):261-264.
[7] PaulAnder,Eriksson K E.physiol plant,1977,41:239-248.
[8] 周国英,李河.竹材木质素选择性降解菌株的分子鉴定[J].浙江林学院学报,2008,25(4):497-501.
