HPLC快速测定发酵液中L–色氨酸
2010-01-10程立坤徐庆阳谢希贤
程立坤,徐庆阳,谢希贤,陈 宁
(工业微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
HPLC快速测定发酵液中L–色氨酸
程立坤,徐庆阳,谢希贤,陈 宁
(工业微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
建立一种测定发酵液中 L–色氨酸的高效液相色谱(HPLC)方法.以Agilent C18(5 µm,150.mm×4.6.mm)为分离柱,V(0.03%的KH2PO4溶液)∶V(甲醇)=90∶10为流动相,流量为1 mL/min,在278.nm处检测L–色氨酸.该方法简便、快速、准确,在 0.000~1.000.g/L范围内线性关系良好(R2=0.999 9),平均回收率为 98.93%,精密度(RSD)为0.247%,可有效应用于发酵液中L–色氨酸含量的测定.
L–色氨酸;HPLC;检测
L–色氨酸(L-tryptophan)对人和动物的生长发育及新陈代谢起重要的作用,被称为第二必需氨基酸,广泛用于医药、食品和饲料等方面[1].目前,微生物发酵法生产 L–色氨酸已经走向实用并且处于主导地位[2],其中微生物发酵法具有产酸高、成本低、质量好等优势,将是未来大规模生产 L–色氨酸的首选技术[3].因此,建立一种快速且准确的测定发酵液中 L–色氨酸的方法非常必要.
L–色氨酸的定性和定量测定方法有纸层析法、薄层分析法、比色法、高效液相色谱法、氨基酸分析仪测定法等[4–6].其中最常用的有对二甲胺基苯甲醛比色法和柱前衍生HPLC法.但这两种方法操作步骤复杂,且分别以50%浓硫酸为显色反应介质和用2,4–二硝基氟苯作为衍生剂,实验危险性均很大.由于 L–色氨酸在紫外区有光吸收,因此本文建立了直接利用光电二极管阵列(DAD)检测器在 278,nm 处测定发酵液中 L–色氨酸含量的 HPLC法,并与对二甲胺基苯甲醛比色测定法和柱前衍生HPLC法进行了比较.
1 材料与方法
1.1 仪器与试剂
Agilent,1200型高效液相色谱仪,包括 DAD检测器、梯度四元泵、柱温箱、在线自动脱气器,数据处理由化学工作站完成.L–色氨酸、L–酪氨酸、L–苯丙氨酸,色谱纯,北京索莱宝科技有限公司;甲醇,色谱纯,天津市元立化工有限公司;其他试剂为分析纯.
1.2 方法
对二甲胺基苯甲醛比色法测定:见参考文献[7].
2,4–二硝基氟苯衍生法测定:见参考文献[8].
HPLC分析条件:色谱分离柱 Agilent C18(5,µm,150,mm×4.6,mm),流动相 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10,流量 1.0,mL/min,柱温 39,℃,进样量 20,µL,检测波长 278,nm.
标准曲线的制作:见参考文献[9].
样品处理:取 1.0,mL发酵液 10,000,r/min离心5,min,取上清液稀释适当倍数使 L–色氨酸浓度介于测定方法的检测线性范围内,然后用 0.22,µm 微孔滤膜过滤,所得滤液直接进样测定.
2 结果与讨论
2.1 检测波长的选择
L–色氨酸是含有吲哚基的中性芳香族氨基酸,在紫外区下具有光吸收.由图 1可知,其在 225,nm 和278 nm处均有吸收峰,则在DAD检测器中设定两个检测波长分别为 225,nm和 278,nm.质量浓度为0.100,g/L的L–色氨酸标样在两种检测波长处的高效液相色谱图如图2所示.
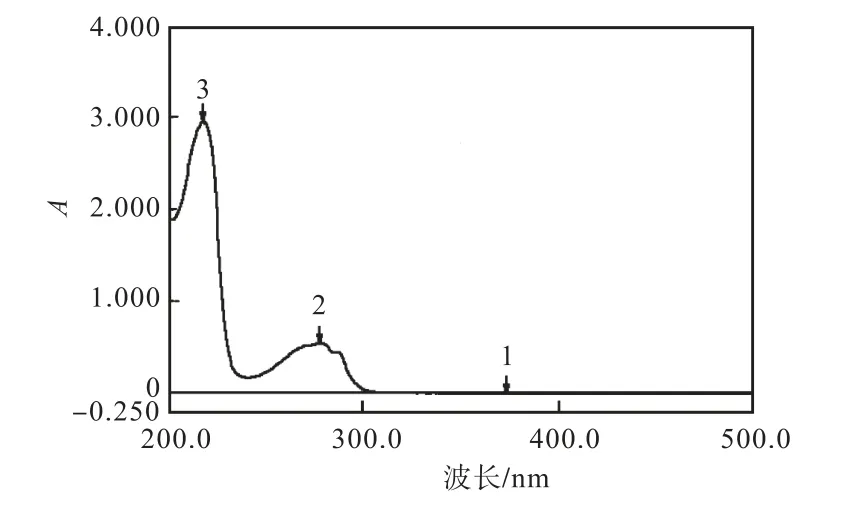
图1 L–色氨酸紫外吸收光谱Fig.1 UV absorption map of L-tryptophan
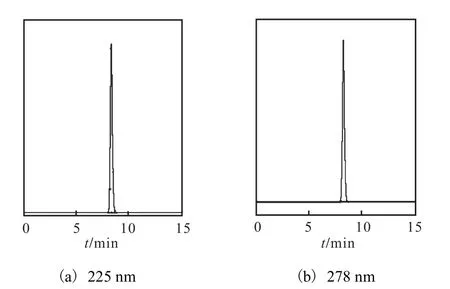
图2 L–色氨酸标准品(0.100 g/L)高效液相色谱图Fig.2 HPLC chromatograms of L-tryptophan(0.100 g/L)
由图2可知,质量浓度为0.100,g/L的L–色氨酸标样在 225,nm和 278,nm处的保留时间一致.但两者的峰面积不同,分别为11,699.9和2,902.3,在 225 nm处检测器的输出信号约为 278,nm处输出信号的4倍.由于检测器所产生的信号在一定范围内可与被测样品的量呈一定的函数关系,若检测器所产生的信号超出一定范围,输出信号不能与样品量呈一定线性关系[10],则可推断在 278,nm 处检测 L–色氨酸比在225,nm 处的线性范围广.图 2(a)和图 2(b)中 L–色氨酸的峰面积分别占相应色谱图中总峰面积的99.80%和 100.00%,说明在 225 nm 处 L–色氨酸标样中的杂质有光吸收,而在278,nm处仅对L–色氨酸标样中的 L–色氨酸有光吸收.因此,选择 278,nm 作为检测波长.
2.2 流动相组成的筛选
采用0.03%,KH2PO4溶液-甲醇体系作为流动相,为确定二者之间配比,设置体积比为 85∶15、88∶12、90∶10和92∶8四个体系,实验结果见图3.
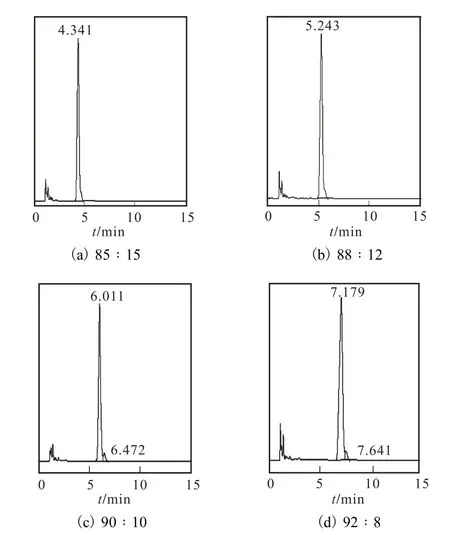
图3 不同流动相组成体系的色谱图Fig.3 HPLC chromatograms of different mobile phases
由图3可知,随着流动相体系中甲醇组分的增加,L–色氨酸的保留时间逐渐缩短.体系a与体系b不能将 L–色氨酸与其他杂质分开,体系 c与体系 d的分离度(Rs)分别为 2.31、1.69,则选择体系 c作为流动相,即 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10.
2.3 流动相流量的确定
分别考察流量为 0.8,、1.0,、1.2,、1.4,mL/min 时发酵液的分离效果,由检测结果可知,流量过小,分析时间延长,柱效降低,而流量过大时,发酵液中物质分离效果差,且由于压力升高而损坏泵头和色谱柱.综合考虑,最终选定流量为1.0,mL/min.
2.4 柱温对检测的影响
柱温对氨基酸的分离有较为明显影响,为确定柱温对发酵液中 L–色氨酸分离的影响.在 33、36、39、42,℃下各进同一种样品3次,结果见表1.由表1可知,随着柱温的升高,L–色氨酸和邻近 L–色氨酸杂质的保留时间均有所减少,同时柱效增强;柱温为 39,℃时,分离度 Rs=2.17,两个峰得到完全分离,因此采用柱温为39,℃.
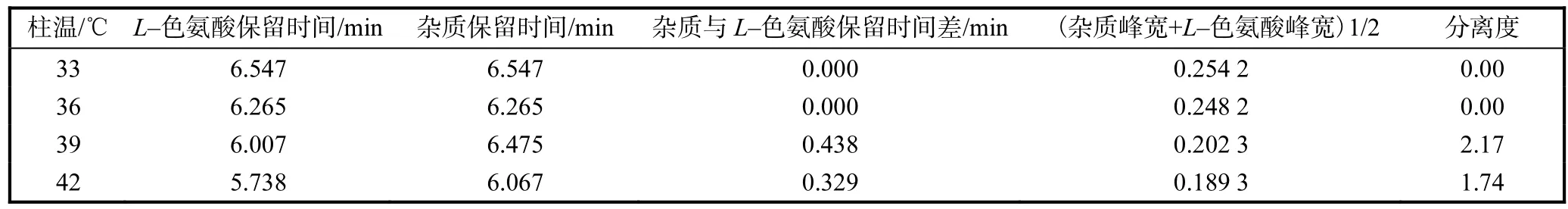
表1 温度对L–色氨酸分离的影响Tab.1 Effect of temperature on chromatographic separationof L-tryptophan
2.5 色谱条件确定及其工作曲线
由以上实验确定HPLC检测L–色氨酸的色谱条件为:流动相 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10,流量 1.0,mL/min,柱温 39,℃,进样量 20,µL,检测波长 278,nm.在此条件下,HPLC 检测 L–色氨酸标样的色谱图如图 4所示.将不同质量浓度的 L–色氨酸标准液在拟定色谱条件下进行测定,3组平行样取其平均值,以 L–色氨酸浓度(x)为横坐标,峰面积(y)为纵坐标作图可得一标准曲线(见图5).
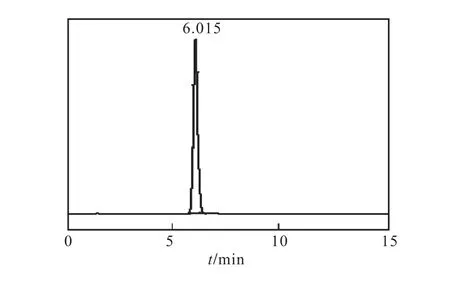
图4 L–色氨酸(0.100.g/L)标样的HPLC图Fig.4 HPLC chromatograms of L-tryptophan(0.100.g/L)
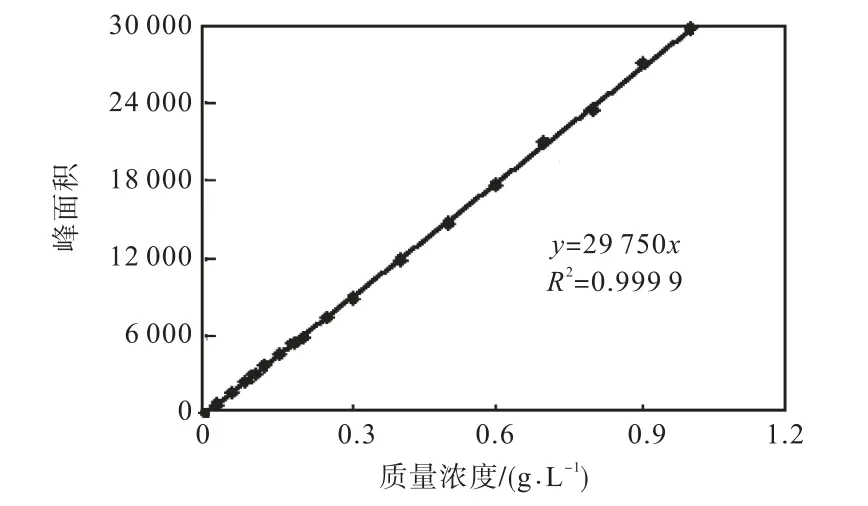
图5 HPLC测定L-色氨酸标准曲线Fig.5 Standard curve of L-tryptophan determination by HPLC
由图4可见,L–色氨酸的响应时间为6.015,min.由图 5结果可知,在该色谱条件下 L–色氨酸质量浓度在0.000~1.000,g/L线性关系良好.
2.6 精密度实验和回收率实验
将 0.100,g/L的 L–色氨酸标准储备液同浓度平行 3份,当日重复进样 6次[11],峰面积 RSD 为0.247%.在已知浓度的发酵液中分别加入一定量的L–色氨酸对照溶液进行回收率实验,每个浓度设3个平行,具体添加量及结果见表 2,计算得出其相对回收率为98.93%.
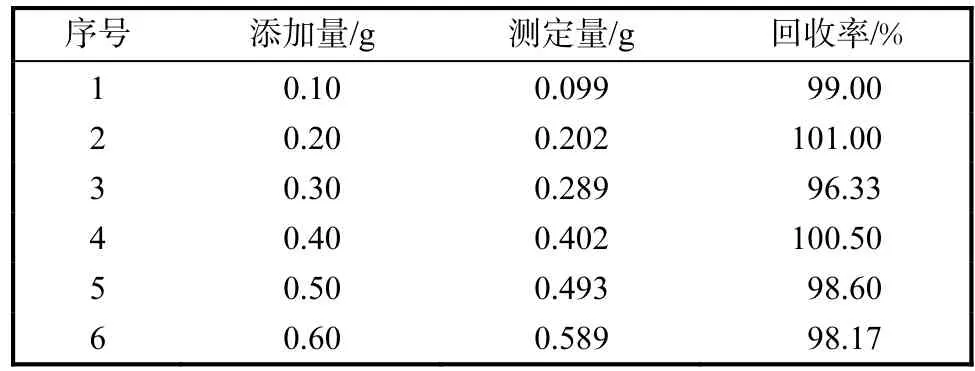
表2 L–色氨酸检测的回收率结果Tab.2 Results obtained in the recovery test of L-tryptophan
2.7 发酵液样品的测定及不同检测方法的比较
图6是L–色氨酸发酵液HPLC测定色谱图.

图6 L–色氨酸发酵液HPLC测定色谱图Fig.6 Chromatograms of L-tryptophan fermentation
由图 6可知,色谱柱柱效较高,发酵液样品中某些其他发酵成分能被检测到且分离效果良好.与标准曲线对照测得的发酵液中 L–色氨酸含量为32.8,g/L,这与对二甲胺基苯甲醛比色法、2,4–二硝基氟苯衍生测定法测得的 L–色氨酸含量相一致,从而证明该方法可以准确地检测发酵液中 L–色氨酸的含量.由表 3可知,该方法与对二甲胺基苯甲醛比色法、2,4–二硝基氟苯衍生测定法相比,线性关系更佳、稳定性好、快速、危险性小、操作步骤简单,且线性范围可达0.000~1.000,g/L.

表3 L–色氨酸测定方法比较Tab.3 Comparison of determination methods for L-tryptophan
2.8 其他芳香族氨基酸的干扰
酪氨酸、苯丙氨酸与色氨酸同属于芳香族氨基酸[12],在 278,nm 处均有光吸收,则在上述拟定色谱条件下对酪氨酸、苯丙氨酸进行检测,结果如图 7所示.
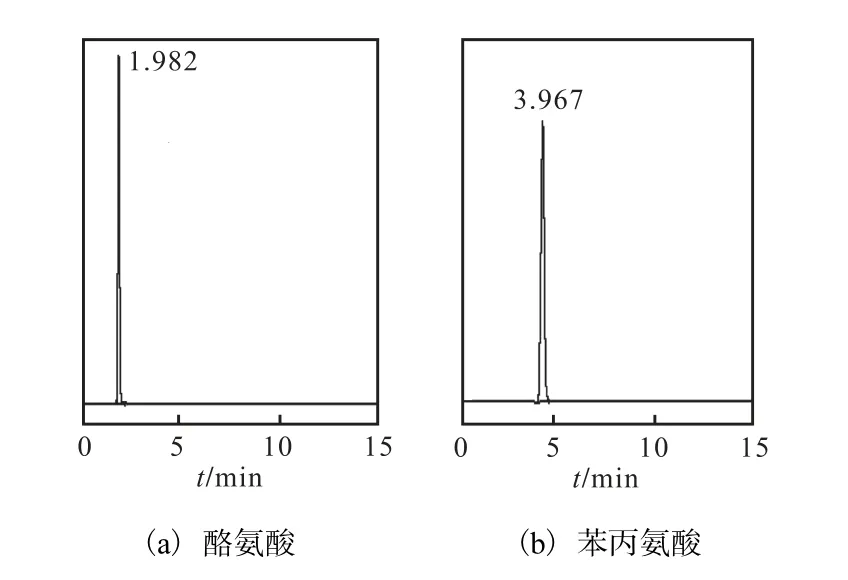
图7 酪氨酸与苯丙氨酸标样色谱图Fig.7 HPLC chromatograms of tyrosine and phenylalanine
由图7可知,酪氨酸与苯丙氨酸的保留时间分别为 1.982,min和 3.967,min,而色氨酸的保留时间为6.015,min,则说明酪氨酸与苯丙氨酸对发酵液中 L–色氨酸含量的测定没有干扰,此检测方法适用性强.
3 结 论
HPLC 色谱条件:以 Agilent,C18(5,µm,150,mm×4.6,mm)为分离柱,V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10为流动相,流量为 1 mL/min,在 278 nm处 L–色氨酸可以很好地被检测出来,保留时间为6.015 min,且酪氨酸、苯丙氨酸均对其测定没有干扰,适用性强.与对二甲胺基苯甲醛比色法和柱前衍生高效液相色谱法相比较,线性更佳、稳定性好、快速、危险性小、操作步骤简单,且线性范围达 0.000~1.000,g/L,可有效应用于发酵液中 L–色氨酸含量的测定.
[1]赵春光,程立坤,徐庆阳,等. 微生物法生产L–色氨酸的研究进展[J]. 发酵科技通讯,2008,37(4):34-36.
[2]Kim H U,Kim T Y,Lee S Y. Metabolic flux analysis and metabolic engineering of microorganisms[J]. Molecular Biosystems,2008,4(2):113-120.
[3]Yanofsky C. Using studies on tryptophan metabolism to answer basic biological questions[J]. The Journal of Biological Chemistry,2003,278(13):10859-10878.
[4]侯冬岩,回瑞华. 色氨酸和酪氨酸的双波长荧光光谱的研究[J]. 分析实验室,2001,20(6):88-89.
[5]杨晓云,徐汉虹,王立世,等. 色氨酸、半胱氨酸和酪氨酸的高效毛细管电泳分析[J]. 分析测试学报,2001,20(3):15-18.
[6]Widner B,Leblhuber F,Walli J,et al. Tryptophan degradation and immune activation in Alzheimer’s disease[J]. Neural Transm,2000,107(3):343-353.
[7]王健,陈宁,徐咏全,等. 发酵液中色氨酸含量的快速测定[J]. 食品与发酵工业,2004,30(2):123-125.
[8]张昌伟,徐庆阳,刘淑云,等. 2,4–二硝基氟苯衍生法测定发酵液中组氨酸方法的优化[J]. 现代化工,2007,27(2):743-745.
[9]陈立仁,蒋生祥. 高效液相色谱基础与实践[M]. 北京:科学出版社,2001:114-120.
[10]王宇成. 最新色谱分析检测方法及应用技术实用手册[M]. 长春:吉林出版集团,2004:205-212.
[11]饶志明,徐美娟,沈微,等. 高效液相色谱测定发酵液中1,2–二羟基丙酮(DHA)方法的建立[J]. 中国生物工程杂志,2008,28(1):61-64.
[12]Sprenger G A. Aromatic amino acids[J]. Microbiology Monographs,2007,5:93-127.
Quick Determination of L-Tryptophan in Fermented Broth by HPLC
CHENG Li-kun,XU Qing-yang,XIE Xi-xian,CHEN Ning
(Key Laboratory of Industrial Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
A method to determine L-tryptophan in fermented broth was developed by high performance liquid chromatography(HPLC). An Agilent C18(5 µm,150 mm×4.6 mm)was used with the mobile phase of 0.03% KH2PO4water solution and methanol(the ratio of volume was 90 to 10). The flow rate was at 1.0 mL/min and the detective wavelength was 278 nm. The method was rapid,accurate and simple with a good linearity(R2=0.999 9)in the range of 0.000 to 1.000 g/L for L-tryptophan. The average recovery was 98.93% with the relative standard deviation of 0.247%. The method was applicable for L-tryptophan determination in the fermented broth.
L-tryptophan;HPLC;determination
TQ922
A
1672-6510(2010)01-0009-04
2009-07-03;
2009-10-13
国家“重大新药创制”科技重大专项课题(2008ZX09401-05);国家“十一五”科技支撑计划重点项目(2008BAI63B01)
程立坤(1984—),男,山东滨州人,硕士研究生;通信作者:陈 宁,教授,ningch@tust.edu.cn.
