人F3Restin基因的克隆与表达
2009-11-29刘洋
刘 洋
(长江大学医学院,湖北 荆州 434023)
曾昭淳
(重庆医科大学生物化学与分子生物学教研室,重庆 400016)
刘 洋
(长江大学医学院,湖北 荆州 434023)
曾昭淳
(重庆医科大学生物化学与分子生物学教研室,重庆 400016)
目的:克隆人F3-Restin基因,表达有生物学活性的新型融合蛋白F3-Restin。方法:采用亚克隆技术构建融合表达载体PET32a(+)-F3-Restin,原核诱导表达,经Ni2+-NTA 琼脂糖树脂亲和层析纯化,透析去盐。结果:在20℃、10h的条件下IPTG原核诱导表达、纯化,得到分子量约为40kD的高纯度的可溶性蛋白F3-Restin。结论:成功地克隆了人F3-Restin基因,构建融合表达载体PET32a(+)-F3-Restin,并表达出新型融合蛋白F3-Restin,为进一步研究F3-Restin蛋白抗肿瘤血管生长的活性及作用机理奠定了良好的基础。
F3-Restin基因;克隆;表达;纯化
肿瘤的生长、浸润及转移扩散依赖血管生成,抑制新血管的生成是抑制肿瘤生长的有效途径。利用高选择性抑制肿瘤血管增生的药物,对于提高抗肿瘤药物的治疗效果,降低药物的用量,尤其显著降低药物毒性和副作用具有重要意义。
F3肽是人类高迁移蛋白2(Human high mobility group protein-2, HMGN-2)N-末端的31个氨基酸的片段[1]。F3肽段几乎能与所有被测试的肿瘤细胞和肿瘤血管内皮细胞高选择性地结合,可以将噬菌体和荧光染料带到肿瘤细胞和肿瘤血管内皮细胞[1]。因此,F3是针对肿瘤组织靶向给药的优良载体,能够携带抗肿瘤血管的肽类、药物实现靶向给药。Restin[2]是1999年新发现的新生血管抑制因子,为XVⅢ胶原的C末断片段,分子量为20kD,它可抑制血管内皮细胞的迁移以及由VEGF刺激的血管内皮细胞的生长,并在动物肾癌模型中抑制肿瘤的形成。人体血液中有天然Restin存在[3],它与XVⅢ胶原的C末断片段内皮抑素氨基酸序列有61%的同源性,也具有抑制血管发生的功能。
本实验采用亚克隆技术从重组克隆载体pEKH-F3获得F3基因,与PET32a(+)-Restin构建融合表达载体PET32a(+)-F3-Restin,原核表达、纯化,为进一步研究F3-Restin的功能及机理奠定基础。
1 材料与方法
1.1质粒、菌株及细胞株重组克隆载体pEKH-F3和大肠杆菌DH5α、BL21(DE3)由本实验室保存,PET32a(+)-Restin由重庆医科大学生物化学与分子生物学教研室惠赠。
1.2引物及主要试剂根据F3肽基因全长序列设计引物,逆向引物加6个甘氨酸作柔性连接于restin的N端。
P1:5’-GAGGATCCAAAGATGAACCGCAACGTCGTAG-3’,
P2:5’-CGAAGCTTACCACCACCACCACCACCCTTCTTAGCCGGTGCTTTT-3’。
分别加有BamHⅠ与HindⅢ的酶切位点,由北京赛百盛生物公司合成。TaqDNA聚合酶、内切酶BamHⅠ与HindⅢ购自Takara公司;T4DNA连接酶购自NEB公司;DNA片段回收采用上海华舜公司胶回收kit;His-Tag融合蛋白纯化试剂盒购自Merk公司。其他主要试剂为Sigma公司产品。
1.3F3基因片段的扩增、PET32a(+)-F3-Restin表达载体的构建及测序以pEKH-F3质粒为模板,PCR扩增F3基因片段,PCR扩增条件为95℃预变性3min后,94℃变性30s,62℃退火30s,71℃延伸30s,30次循环,最后71℃保温7min,琼脂糖凝胶电泳回收目的片段,F3基因片段及重组克隆载体PET32a
(+)-Restin分别BamHⅠ/HindⅢ双酶切,凝胶电泳回收,用T4连接酶4℃连接过夜,构建载体PET32a(+)-F3-Restin,转化大肠杆菌DH5α,LA平板培养过夜,挑取单克隆,培养、提质粒,双酶切鉴定后,送上海生工所测序确认。
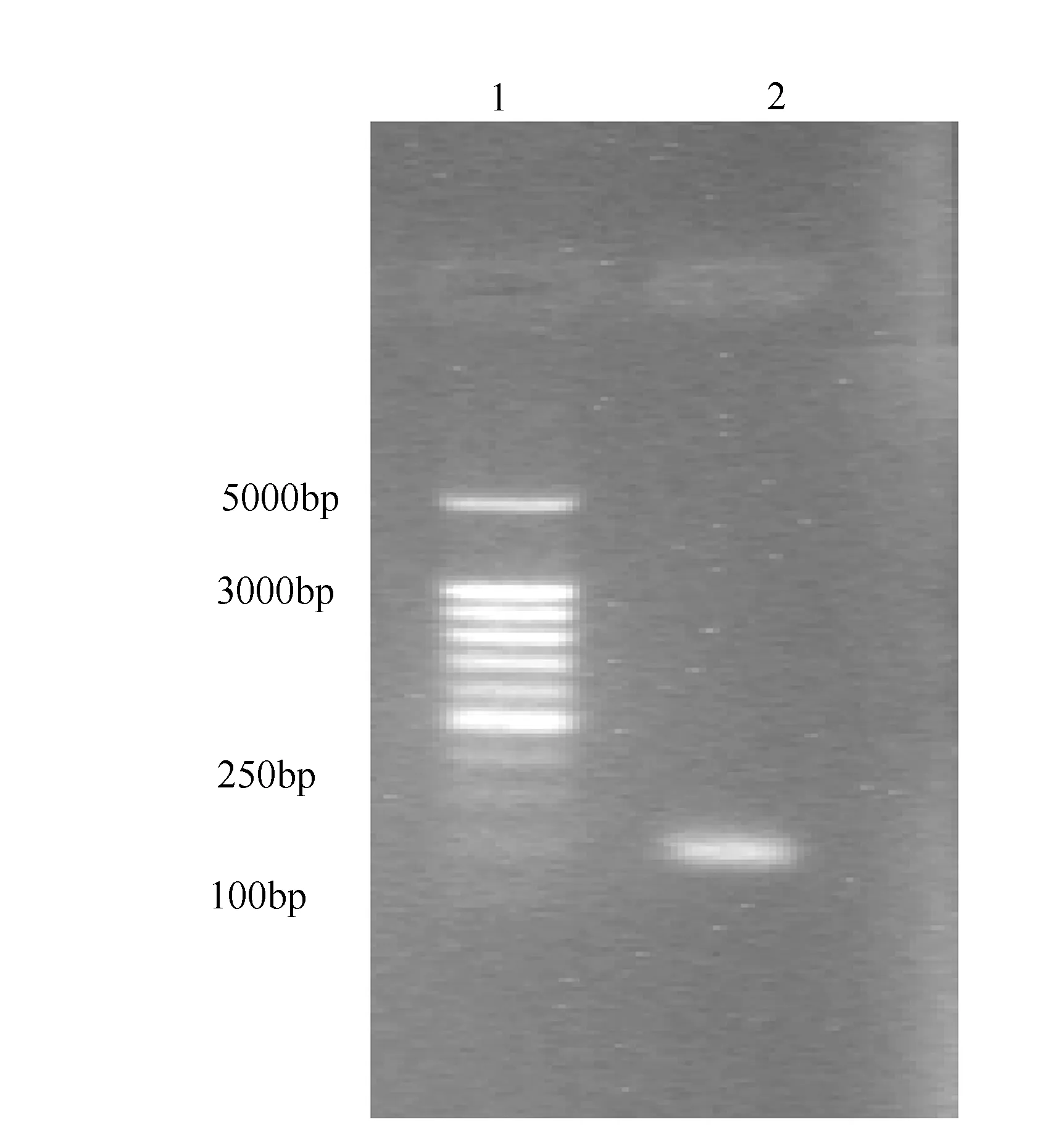
1为DNA分子量标准;2为PCR产物。图1 F3基因PCR产物在1.5%的琼脂糖凝胶电泳结果
1.4F3-Restin表达及表达产物的鉴定将PET32a(+)-F3-Restin转化大肠杆菌BL21(DE3),挑取阳性克隆于LA培养基中,当OD590=0.7~0.9时,加入IPTG至1.0mmol/L,于20℃继续培养12h后收集菌体。菌体经冰浴超声破菌后离心,分别取上清和沉渣,12%的SDS-PAGE分析表达产物,用薄层扫描仪计算F3-Restin在菌体总蛋白中的含量。
1.5F3-Restin表达产物的纯化菌体超声破菌后,取上清,用Ni2+-NTA 琼脂糖树脂进行纯化。参照Novagen公司的His.Bind Kits说明进行纯化,12%的SDS-PAGE分析纯度及酶切产物,透析去盐,Bradford法对纯化的蛋白定量。
2 结果

1,2为BamHⅠ/EcoRⅠ酶切重组质粒PET32a(+)-F3-Restin;3为未酶切的重组质粒PET32a(+)-F3-Restin。图2 重组质粒酶切产物琼脂糖凝胶电泳分析
2.1F3基因片段的扩增、PET32a(+)-F3-Restin表达载体的构建及序列鉴定以pEKH-F3质粒为模板,PCR扩增获得长约140bp的F3基因片段(见图1),回收目的片段,F3基因片段及重组克隆载体PET32a(+)-Restin分别BamHⅠ/HindⅢ双酶切,凝胶电泳回收,用T4连接酶4℃连接过夜,构建表达载体PET32a(+)-F3-Restin,经PCR及BamHⅠ/EcoRⅠ酶切片段大小确认,F3-Restin基因片段长约700bp(见图2),测序表明读码框正确,表达质粒载体构建成功。

1为蛋白质分子标准(14.4、20.0、28.5、35.0、45.0、66.2、94.0kD);2为未加IPTG诱导;3为IPTG、37℃诱导4h;4为IPTG、37℃诱导3h;5为IPTG、37℃诱导2h;6为IPTG、20℃诱导10h图3 F3-Restin在大肠杆菌中的诱导表达
2.2F3-Restin表达及表达产物的纯化用1.0mmol/L的IPTG分别于37℃下2、3、4、5、6h和20℃、10h诱导细菌表达,与未诱导的比较,发现37℃、4h和20℃、10h在12%的SDS-PAGE上约40KD处均有一明显的表达条带,Quantity One软件分析,表达量占菌体总蛋白含量的35%。菌体裂解后的SDS-PAGE分析表明,表达产物绝大部分以可溶性的存在,且在20℃、10h的条件下最优(见图3)。经Ni2+-NTA 琼脂糖树脂亲和层析纯化,透析去盐,得到分子量约为40kD的高纯度的蛋白(见图4)。
3 讨论

1、为蛋白质分子标准(14.4、20.0、28.5、35.0、45.0、 66.2、94.0KD);2、3、4、5为镍柱纯化不同时间的洗脱物。图4 F3-Restin经Ni2+-NTA 琼脂糖树脂纯化结果(20℃、10h)
血管生成抑制肽通过抑制肿瘤新血管的生成,阻断肿瘤细胞的营养供应,抑制肿瘤细胞的生长。目前已经报道的血管生成抑制肽有很多,包括血管抑素angiostatin[4]、内皮抑素endostatin[5]、Tumstatin (IV型胶原α3链非胶原区片段)[6]、Canstatin (IV型胶原α2链片段)[7]、Restin (胶原ⅩⅤ片段)[2]等。如何让这些药物准确的、选择性的作用于肿瘤新生血管,减少药物的用量,降低药物的毒副作用,提高药物的临床抗肿瘤治疗效果是目前开发抗肿瘤药物的难题,也具有非常重要的医学实践意义。基于此,我们采用F3与Restin基因连接构建了新的表达载体PET32a(+)-F3-Restin,拟研究出新的具有导向肿瘤新生血管及抗癌活性的融合蛋白。
本文采用亚克隆的方法,构建了新的表达载体PET32a(+)-F3-Restin,并用LA培养基于20℃、10h,以1.0 mmol/L的IPTG诱导出可溶性的蛋白产物,纯化出具有生物学活性的蛋白,解决了原核系统表达真核基因常常为不溶性包涵体的难题。我们能够得到可溶性的重组融合蛋白主要有以下几个方面的原因:①与硫氧还蛋白(Trx)融合表达,许多蛋白要求形成稳定的二硫键才能形成天然空间结构,没有二硫键,这些蛋白可能被降解或者会形成包涵体,而硫氧还蛋白(Trx)能催化二硫键的形成,且本身溶解性能极高;②37℃生长常常会使一些蛋白累计形成包涵体,而较低温度生长可能产生可溶的和有活性的蛋白。如果打算利用一些PET载体中的信号肽序列输出蛋白的话,在25℃或30℃培养可能是最优化的。在某些情况下,低温(15~20℃)延长诱导时间(过夜)可以使溶解性蛋白的产量达到最大;③裂解缓冲液的性质会大大影响到目的蛋白可溶与不溶形式之间的比例。当采用一般的裂解缓冲液如1×His Binding Buffer(包括500mmol/L氯化钠)时,一些包含疏水或膜相关结构域的蛋白可能会归于不溶,但并不出现在包涵体中。在裂解缓冲液中加入毫摩尔的非离子型或双性去污剂可以将由于与细菌脂或膜结合而不溶的蛋白组分转变成可溶组分。
实验中,我们采用了6个甘氨酸的柔性片段连接F3肽和Restin,保证了重组后的融合肽两个肽片段保持各自的正确空间构象和生物学活性。F3肽对肿瘤细胞和肿瘤血管内皮细胞的高选择性及内化作用[1],为血管生成抑制肽Restin[2]提供了优良的靶向载体,我们期待Restin蛋白在F3肽的引导下,靶向肿瘤新生血管内皮细胞并内化,发挥其良好的抗肿瘤血管发生的作用。所以,新型融合蛋白F3-Restin基因的克隆及可溶性目的蛋白的成功表达,为进一步研究此种新型融合肽的靶向肿瘤新生血管和抗肿瘤血管生长的活性及作用机理作好了物质准备,有望成为更安全、更有效的抗肿瘤生物制剂。
[1]Kimmo P,Pirjo L,Jason A,etal.A fragment of the HMGN2 protein homes to the nuclei of tumor cells and tumor endothelial cells in vivo[J]. PNAS, 2002, 99(11):7444-7449.
[2] Bamchandran R,Dhanabal M,Volt R,etal.Antiangiogenlc activity of restin,NC10 domain of human collagen XV:Copparison to endostatin[J].Biochem Biophys Res Commun,1999,255(3):735-739.
[3] Harald J,Klaus T,Wolf G,etal.Novel glycosylated forms of human plasma endostain and circulating endostatin-related fragment of collagen XV[J].Biochemistry,1999,38(32):10217-10224.
[4] O’Reilly MS,Holmtren L,Shing Y,etal.Angiostatin : A novel angiogenesis inhibitor that mediates the suppression of metastases by a lewis lung carcinoma[J]. Cell,1994,79:315-328.
[5] O’Reilly MS,Boehm T,Shing Y,etal.Endostatin : An endogenous inhibitor of angiogenesis and tumor growth[J] . Cell,1997,88:277-285.
[6] Maeshima Y,Colorado PC, Torre A,etal.Distinct antitumor properties of a type Ⅳ collagen domain derived from basement membrane[J]. J Biol Chem,2000,275:21340-21348.
[7] Kamphaus GD,Colorado PC,Panka DJ,etal. Canstatin: a novel matrix-derived inhibitor of angiogenesis and tumor growth[J]. J Biol Chem,2000,275(2):1209-1215.
[编辑] 一 凡
2009-05-19
刘洋(1979-),男,湖北潜江人,讲师,硕士,从事肿瘤生化与分子生物学教学与研究工作。
10.3969/j.issn.1673-1409(R).2009.03.005
R34
A
1673-1409(2009)03-R011-03
