不同基因编辑类型对FGF5基因编辑羊羊毛性状的影响
2024-04-28岳成广李忠慧刘晨曦贺三刚马海叶刘璇李婧平李文蓉
岳成广 李忠慧 刘晨曦 贺三刚 马海叶 刘璇 李婧平 李文蓉
doi:10.6048/j.issn.1001-4330.2024.03.024
摘 要:【目的】分析不同基因编辑类型对成纤维生长因子5 (FGF5)基因编辑细毛羊羊毛性状的影响,为开展基因编辑细毛羊的羊毛性状遗传参数评估提供理论依据。
【方法】收集181只FGF5周岁基因羊,分析编辑细毛羊羊毛自然长度、伸直长度、羊毛纤维直径和剪毛量等性状的数据。
【结果】FGF5基因编辑细毛羊羊毛自然长度平均值为10.49 cm,变异系数为11.82%。FGF5-InDel和FGF5-HDR基因编辑细毛羊羊毛自然长度和剪毛量均极显著高于野生型(P<0.01)。-28 bp或-26 bp、2 bp和置换(c.61 C>T)的羊毛自然长度和伸直长度均极显著长于wt(P<0.01),-28 bp或-26 bp的剪毛量显著高于wt(P<0.05)。-28 bp基因型的双等位基因编辑和单等位基因编辑突变的羊毛自然长度和伸直长度均极显著长于野生型(P<0.01)。
【结论】不同基因编辑类型的FGF5基因编辑细毛羊均可显著提高羊毛自然长度和剪毛量,可利用表型性状突出的后代组建核心编辑羊群体,促进FGF5基因编辑细毛羊选育扩繁。
关键词:FGF5基因编辑细毛羊;编辑类型;羊毛自然长度;剪毛量;基因型;突变类型
中图分类号:S826;S814.8 文献标志码:A 文章编号:1001-4330(2024)03-0734-08
收稿日期(Received):
2023-07-09
基金项目:
国家转基因生物新品种培育重大专项子课题“长毛型转基因超细毛羊的培育”(2016ZX08008001-002)
作者简介:
岳成廣(1997-),男,河南人,硕士,研究方向为动物遗传育种,(E-mail)945372465@qq.com
通讯作者:
李文蓉(1969-),女,江苏人,研究员,博士,硕士生/博士生导师,研究方向为动物遗传育种,(E-mail)xjlwr@126.com
0 引 言
【研究意义】羊毛是细毛羊主要的高附加值产品,是一种纯天然、可再生、可降解的绿色环保型纤维,具有透气性、吸湿性[1],在纺织业中具有重要作用[2]。羊毛自然长度、剪毛量、羊毛纤维直径是细毛羊重要的经济性状,羊毛自然长度更是评价羊毛品质的重要指标之一。利用CRISPR/Cas9基因编辑技术可为FGF5基因修饰细毛羊的培育提供有效的技术手段,缩短了育种进程。
将基因编辑育种技术与常规育种技术相结合,分析影响基因编辑羊羊毛性状与羊毛品质性状相关的基因编辑类型,选择表型更加突出的基因编辑细毛羊进行定向扩繁,培育具有毛品质性状和生产性能优良的基因编辑细毛羊新群体,对FGF5基因编辑细毛羊的扩繁有重要意义。【前人研究进展】CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR associated nuclease)是有效、便捷的基因组编辑技术[3,4],其不同于常规转基因技术,是通过细胞修复Cas9核酸酶在靶向位点产生双链DNA断裂(Double-strand breaks,DSBs),实现对动物基因组本身进行删除、缺失、插入等突变修饰,达到改变其目标性状的目的[5]。由于不导入任何外源DNA序列成分到动物基因组,基因编辑技术受到关注,突出性状表现的基因编辑家畜[6],为某些与基因型相关的动物疾病提供新的解决思路[7]。成纤维细胞生长因子5(Febroblast Growth factor,FGF5)基因是目前功能较为明确、决定毛发长度的重要候选基因之一[8,9]。其通过阻止毛乳头细胞的激活和增殖,促使毛囊生长由兴盛期向休止期转化,抑制了毛囊生长[10,11]。由于FGF5具有抑制毛囊生长,抑制FGF5的功能或阻断FGF5信号通路将促进毛发生长[12-14]。绵羊FGF5位于绵羊6号染色体,FGF5基因组全长21 743 bp,由3个外显子和2个内含子组成,全长FGF5的转录产物大小为813 bp,三个外显子的长度分别为361、104和348 bp[15]。高原等[16]对内蒙古绒山羊的FGF5基因靶向敲除后毛长有明显增加;Hu等[17]研究表明与野生型绵羊相比,FGF5敲除羊的羊毛长度更长;利用CRISPR/Cas9技术在绵羊体内过表达截短型FGF5,能够阻断FGF5的功能作用,促进羊毛生长、提高羊毛长度和产毛量[12]。【本研究切入点】利用CRISPR/Cas9创制FGF5基因编辑细毛羊以来,7年间通过人工授精或自然交配扩繁,扩大基因型一致的基因编辑羊群数量,完成了分子特征和脱靶检测评价、精液遗传稳定性、表型评价和自身健康状况的安全性评价[18,19],目前已拥有FGF5基因编辑细毛羊群体。需系统评价FGF5基因突变对主要羊毛性状遗传改良效果。
【拟解决的关键问题】比较该群体不同基因编辑类型(包括编辑方式、编辑基因型和突变类型)的FGF5基因编辑细毛羊羊毛性状的影响,分析基因编辑类型对FGF5基因编辑羊羊毛性状的影响作用,为FGF5基因编辑细毛羊主要羊毛性状的遗传评估提供理论依据。
1 材料与方法
1.1 材 料
表型性状数据采用新疆畜牧科学院生物技术研究所绵羊繁育基地2016~2022年FGF5基因编辑周岁羊和正常野生型周岁羊,测定羊毛自然长度、伸直长度、羊毛纤维直径和剪毛量等测量数据。公羊和母羊断乳后单独组群饲养,TMR日粮组成以玉米青贮、苜蓿为主,配以适量天康672精料补充料,采取定量饲喂方式,每日两次采食,自由饮水。
1.2 方 法
1.2.1 FGF5基因编辑细毛羊扩繁和后代编辑基因型的鉴定
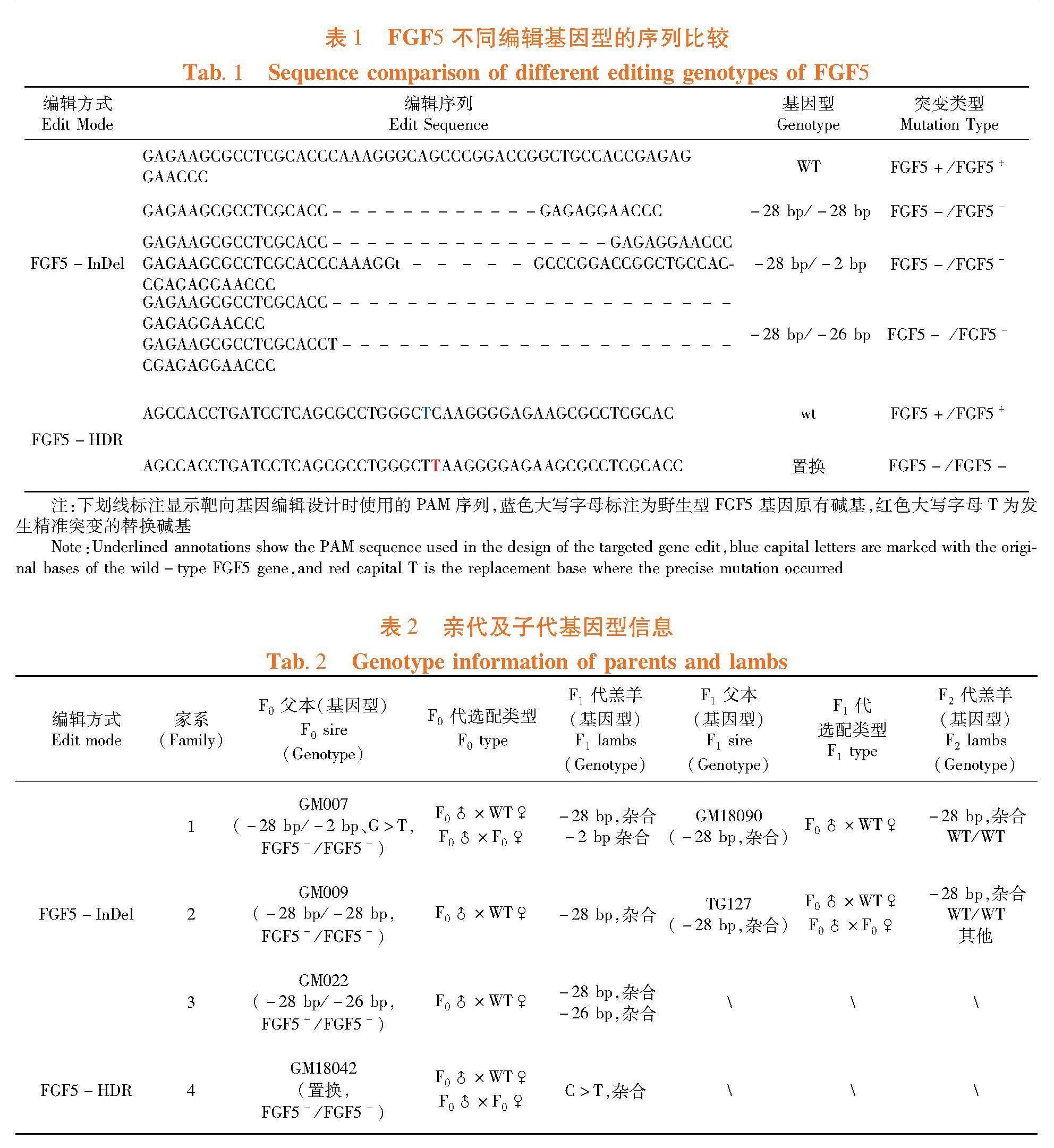
前期利用CRISPR/Cas9技术基因编辑技术对中国美利奴细毛羊FGF5基因进行编辑修饰后[12],获得了基于非同源末端连接(Non-homologous end joining,NHEJ)的InDel(Insertion and deletion,InDel)基因编辑细毛羊和基于同源序列介导的同源重组(Homology-directed repair,HDR)的精准编辑的FGF5基因编辑细毛羊F0代。FGF5基因编辑羊主要编辑基因型,其中FGF5编辑基因型28碱基删除、26碱基删除、2碱基删除和置换(c.61 C>T)分别用-28、-26和-2 bp和置换表示。表1
配种前对FGF5基因编辑公羊进行补饲和采精训练,挑选4只F0代公羊作为配种公羊,进行精液基因型鉴定和品质分析,确定含有FGF5基因编辑公羊的精子携带了FGF5编辑基因突变。采用基因编辑纯合子公羊配基因编辑杂合子母羊或野生型母羊、杂合子基因编辑公羊配杂合子基因编辑母羊或野生型母羊的配种方案,并用人工输精和自然本交的配种方式对基因编辑细毛羊进行配种扩繁,获得的扩繁后代包含4个不同的家系。
采集扩繁后代的尾部组织样品,用TIANamp Genomic DNA Kit试剂盒(北京天根)提取基因组DNA,按照文献[12],采用目标片段PCR扩增、产物测序和序列比对为主、T-A克隆为辅的策略进行基因编辑羊扩繁个体编辑基因型的鉴定。表2
1.2.2 主要羊毛性状性能测定
基因编辑羊与正常野生羊产羔期(3~4月)基本一致,所有性状均按照《细毛羊鉴定项目、符号、术语》(NY1-2004)标准测量。羊毛自然长度和剪毛重由鉴定员场内测定,根据“国家羊毛质量检验标准”(GB1523-2013)采集周岁母羊身体左侧肩胛骨后缘一掌处部位的羊毛样品在实验室进行伸直长度手工测量,将采集每只个体毛样,顺着毛丛的方向,分出10个毛束。在毛样自然卷曲状态下,测量毛束从根部到毛梢的长度,取平均值作为实验室测量毛束自然长度;另外,每个毛丛用尖头镊子捏住羊毛的根部和毛梢拉直羊毛,测量毛丛从根部到毛梢的长度,取平均值作为实验室测量毛束伸直长度。计算毛束伸直率,即毛束伸直率(毛束伸直长度-毛束自然长度)/毛束自然长度,以“现场鉴定自然长度×(1+伸直率)”作为个体的实际伸直长度。
根据GB/T21030-2007操作手册利用OFDA 2000测定个体毛样的羊毛纤维平均直径,委托农业部-新疆种羊及羊毛羊绒质量监督检验测试中心完成。
1.3 数据处理
运用Excel 2021软件对数据进行整理后得到148条FGF5-InDel基因编辑周岁羊记录,33条FGF5-HDR基因编辑周岁羊记录,29条阴性对照周岁羊记录,以用于FGF5基因编辑羊毛用性状的分析。应用IBM SPSS Statistics 25软件对记录数、平均值、标准差、最大值和最小值等描述性统计量进行分析,对不同编辑方式、编辑基因型和突变类型各组数据进行单因素方差分析,以LSD法进行多重比较,试验结果采用平均值±标准差表示。以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 FGF5基因编辑羊毛用性状的描述性统计
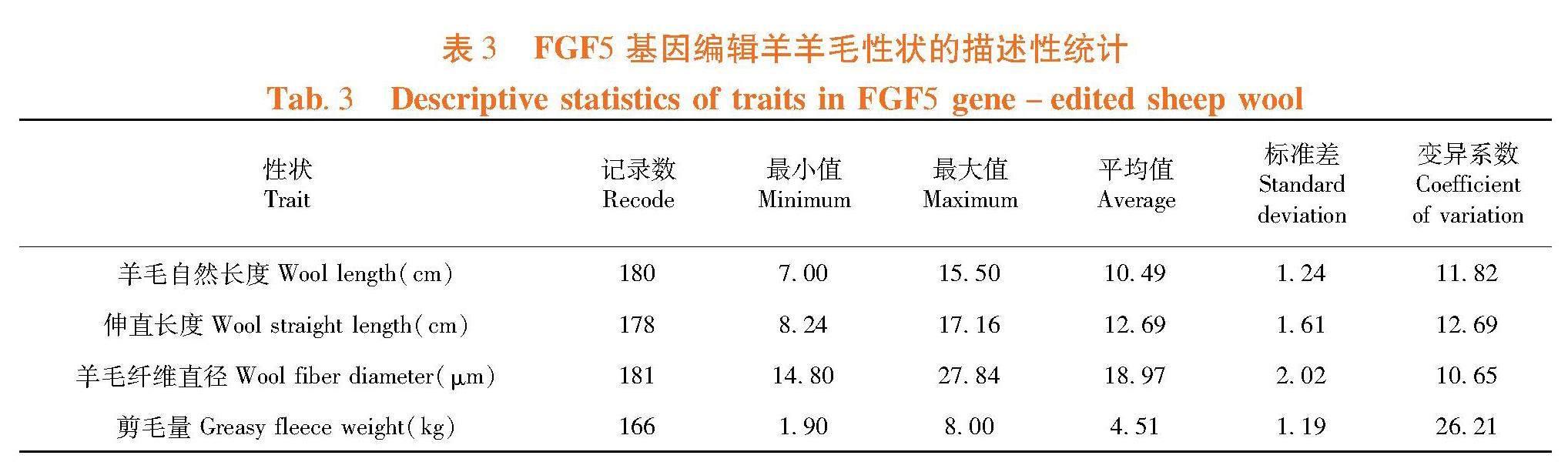
研究表明,FGF5基因编辑羊群体的羊毛自然长度平均为10.49 cm,变异系数为11.82%。该群体的伸直长度、羊毛纤维直径和剪毛量的测量值均存在较大的差异,有较大的变异系数,FGF5基因编辑羊的主要羊毛性状存在较大的个体差异,有着一定的选育潜力。表3
2.2 FGF5-InDel和FGF5-HDR基因编辑方式对羊毛性状的影响
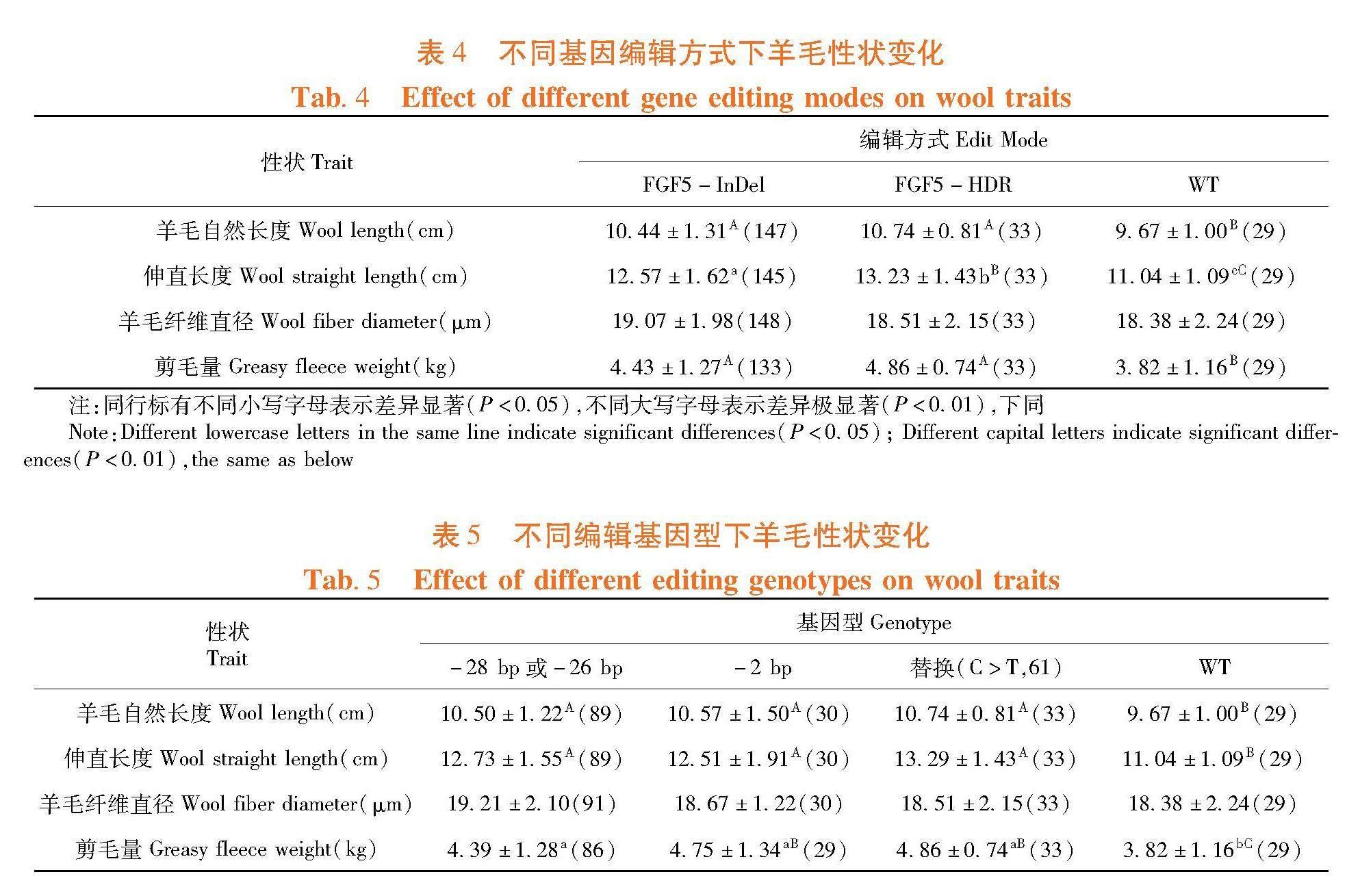
研究表明,FGF5-InDel和FGF5-HDR两种编辑类型的羊毛自然长度和剪毛量均极显著高于野生型细毛羊(WT)(P<0.01),FGF5-InDel和FGF5-HDR两者差异不显著(P>0.05);FGF5-HDR的伸直长度显著高于FGF5-InDel(P<0.05),极显著长于WT(P<0.01);3组间羊毛纤维直径均无显著差异(P>0.05)。表4
2.3 编辑基因型对羊毛性状的影响
研究表明,携带FGF5不同编辑基因型,即-28 bp或-26 bp、-2 bp和置换的基因编辑羊羊毛自然长度和伸直长度均极显著长于野生型(WT)(P<0.01),2 bp和置换的剪毛量极显著高于WT(P<0.01),-28 bp或-26 bp的剪毛量显著高于WT(P<0.05),各组间羊毛纤维直径均无显著差异(P>0.05)。表5
2.4 相同编辑基因型中等位基因编辑对羊毛性状的影响
研究表明,选择群体数量较多,携带-28 bp删除编辑基因型的FGF5基因编辑羊,比较双等位基因编辑(-/-)和單等位基因编辑(-/+)突变对羊毛性状的影响。双等位基因编辑和单等位基因编辑突变的羊毛自然长度和伸直长度极显著长于野生型(+/+)(P<0.01),单等位基因编辑突变的剪毛量显著高于野生型(P<0.05),与双等位基因的剪毛量差异不显著,羊毛纤维直径均无显著差异(P>0.05)。表6
3 讨 论
3.1
研究中使用CRISPR/Cas9技术创制的FGF5基因编辑羊及其扩繁后代的羊毛性状显著提高,羊毛自然长度为10.49 cm,剪毛量为4.51 kg,与其他通过CRISPR/Cas9技术使FGF5基因功能失活能显著提高羊毛长度的研究结果一致[16,17],但这些研究仅是基因编辑羊F0代的羊毛性状结果且群体数量较少。关鸣轩等[20]报道了苏博美利奴羊的毛长和剪毛量性状均值分别为10.2 cm和3.7 kg;魏趁等[21]报道的中国美利奴羊(新疆型)的毛长和剪毛量的均值分别为8.949 cm和4.994 kg;乔国艳等[22]以高山美利奴羊为研究对象,毛丛长度和剪毛量的均值分别为10.08 cm和4.195 kg;与选育的正常细毛羊群体的表型均值相比不一致,除中国美利奴羊(新疆型)的剪毛量高于本群体,其余均低于试验研究群体。其可能是试验群体为FGF5基因编辑羊,经CRISPR/Cas9技术编辑后使FGF5基因功能失活,羊毛长度得到显著增加。
3.2
前期通过预测的蛋白质结构表明,由FGF5-InDel所导致的截短FGF5蛋白丧失了原有FGF5的大部分蛋白序列,其中包括行使其生物学功能作用的β-折叠结构,形成的突变FGF5导致其不能有效激活FGF受体,阻碍了下游的信号传导,造成FGF5功能丧失[12];FGF5-HDR精准替换突变是在FGF5基因外显子1中提前引入终止密码子TAA,使得FGF5基因翻译的蛋白提前终止,进而造成FGF5基因仅能翻译成20个氨基酸序列,无法正常发挥生物学功能,从而达到阻断功能型基因表达的目的。因此研究比较了使用FGF5-InDel和FGF5-HDR方式创制的F0代及其扩繁后代的周岁基因编辑细毛羊的羊毛性状,发现FGF5-InDel和FGF5-HDR基因编辑细毛羊羊毛自然长度和伸直长度显著长于正常野生型细毛羊(P<0.01)。FGF5-InDel和FGF5-HDR基因编辑细毛羊的剪毛量也较正常野生型细毛羊显著增加。而且,基因编辑细毛羊的平均羊毛纤维直径相比野生型细毛羊却无显著性差异(P>0.05)。FGF5-InDel和FGF5-HDR两种编辑方式的基因编辑细毛羊都能显著提高羊毛自然长度和剪毛量,剪毛量的增加归因于羊毛长度的增长。
3.3
目前,大多数通过转基因或基因编辑技术将外源基因或编辑后的基因整合到宿主动物基因组后,均可以得到较好的表达水平,并且宿主动物能表达相应的表型特征[23-25]。其中部分基因编辑动物可以将目标基因通过生殖细胞遗传给下一代。经过对基因编辑羊个体进行鉴定,共鉴定到-28 bp、-2 bp和置换等20多种FGF5突变基因型,且通过对F0代基因编辑细毛羊精液基因型鉴定的研究表明,基因编辑公羊的精液中均存在已知的FGF5编辑基因型,亲本所具有的FGF5编辑基因突变能够通过精液遗传给后代[19];进一步对常规繁育技术获得的FGF5基因编辑羊的扩繁群体开展FGF5突变类型的研究分析,通过比较亲本和后续三代以上后代之间FGF5突变的基因型,发现亲本的FGF5突变的基因型能够通过生殖细胞稳定地遗传给后代,其遗传规律符合孟德尔遗传规律。然而,基因编辑动物经过扩繁的后代是否能够稳定遗传F0代表型性状具有不确定性。因此研究对FGF5-InDel中产生的-28 bp或-26 bp、-2 bp以及FGF5-HDR中产生的置换这3种不同编辑基因型的基因编辑细毛羊羊毛性状进行比较,结果显示3种不同基因型的基因编辑细毛羊自然长度和伸直长度均极显著长于野生型(P<0.01),剪毛量也较正常野生型细毛羊显著增加,羊毛纤维直径差异不显著。3种不同基因型的基因编辑细毛羊均能显著提高羊毛自然长度和剪毛量,提高羊毛长度可增加剪毛量,扩繁后代携有的编辑基因型均能使FGF基因功能失活,从而获得羊毛长度显著增长的这种突出表型性状
3.4
研究选择群体数量较多,携带-28 bp基因型的FGF5基因编辑羊的双等位基因编辑和单等位基因编辑突变进行比较,结果显示两种突变类型的羊毛自然长度和伸直长度都显著长于野生型细毛羊(P<0.01),单等位基因编辑突变的剪毛量显著高于双等位基因编辑突变和野生型细毛羊(P<0.05),但双等位基因突变、单等位基因突变和野生型的剪毛量差异不显著,是受到选配方案造成近亲繁殖的影响。FGF5基因编辑羊的单、双等位基因编辑突变均能显著提高羊毛长度,基因编辑羊扩繁后代具有亲本突出表型性状。
3.5
FGF5不同基因编辑类型(包括編辑方式、编辑基因型和突变类型)的羊毛性状较野生型有显著提高。但由于NHEJ途径修复DSBs通常会产生小片段的插入和缺失,使得FGF5-InDel编辑策略会导致阳性FGF5编辑羊产生多种形式的编辑基因型,会给随后的群体扩繁、选种选配,以及组建基因编辑类型相对单一的育种群体造成一定困难。另外,群体中个体的羊毛性状依然存在较大变异,下一步需在大规模群体上开展遗传评估,但由于现阶段群体规模有限,完全依靠F0代组建具有一定群体数量的FGF5基因编辑羊群体存在困难,因此要通过现有技术策略对表型性状突出的基因编辑羊后代进行选育,借助常规繁殖手段对基因编辑F0代以及表型性状突出、基因型相对一致的后代进行扩繁是今后主要手段,扩繁能稳定遗传突出表型性状的后代对核心编辑羊群体的建立至关重要。
4 结 论
FGF5不同基因编辑类型均可显著提高FGF5基因编辑羊的羊毛自然长度和剪毛量。FGF5-InDel和FGF5-HDR两种编辑策略获得的基因编辑羊及其后代的周岁主要羊毛性状表型值均优于正常野生型细毛羊,其中FGF5-HDR编辑方式的羊毛性状表型值最高。FGF5-HDR基因编辑羊的编辑基因型相对单一,有利于获得编辑基因型一致、性状突出、遗传稳定的核心编辑羊群体。
参考文献(References)
[1]
李忠慧.CRISPR/cas9基因编辑技术在羊毛品质改良中的应用[J].饲料博览,2020,(11):32-34.
LI Zhonghui.Application of CRISPR/cas9 gene editing technology in wool quality improvement [J].Feed Review,2020,(11):32-34.
[2]Zhao H Y,Hu R X,Li F D,et al.Five SNPs Within the FGF5 Gene Significantly Affect Both Wool Traits and Growth Performance in Fine-Wool Sheep(Ovis aries)[J]. Front Genet, 2021,12:732097.
[3]徐鑫,刘明军.CRISPR/Cas9基因编辑技术在绵羊中的应用研究进展[J].中国畜牧兽医,2022,49(11):4129-4138.
XU Xin,LIU Mingjun.Research progress on application of CRISPR/Cas9 genome editing systems in sheep [J].China Animal Husbandry & Veterinary Medicine,2022,49(11):4129-4138.
[4]史玉潔,李芳,王昕.CRISPR技术应用于山羊和绵羊育种的研究进展[J].中国畜牧杂志,2022,58(4):16-21.
SHI Yujie,LI Fang,WANG Xin.Research progress on application of CRISPR in goat and sheep breeding [J].Chinese Journal of Animal Science,2022,58(4):16-21.
[5]曹俊霞,王友亮,王征旭.精准调控CRISPR/Cas9基因编辑技术研究进展[J].遗传,2020,42(12):1168-1177.
CAO Junxia,WANG Youliang,WANG Zhengxu.Advances in precise regulation of CRISPR/Cas9 gene editing technology [J].Hereditas (Beijing),2020,42(12):1168-1177.
[6]王欢,邹惠影,朱化彬,等.CRISPR/Cas9基因编辑技术在家畜育种新材料创制中的研究进展[J].畜牧兽医学报,2021,52(4):851-861.
WANG Huan,ZOU Huiying,ZHU Huabin,et al.Advances in evaluation of livestock breeding new materials by using the CRISPR/Cas9 gene editing technology [J].Acta Veterinaria et Zootechnica Sinica,2021,52(4):851-861.
[7]Fan Z Q,Perisse I V,Cotton C U,et al.A sheep model of cystic fibrosis generated by CRISPR/Cas9 disruption of the CFTR gene [J].JCI Insight,2018,3(19):e123529.
[8]Yoshizawa Y,Wada K,Shiomi G,et al.A 1-bp deletion in Fgf5 causes male-dominant long hair in the Syrian hamster[J].Mammalian Genome,2015,26(11):630-637.
[9]Mizuno S,Iijima S,Okano T,et al.Retrotransposon-mediated Fgf5(go-Utr) mutant mice with long pelage hair[J].Experimental Animals,2011,60(2):161-167.
[10]Ota Y,Saitoh Y,Suzuki S,et al.Fibroblast Growth Factor 5 Inhibits Hair Growth by Blocking Dermal Papilla Cell Activation [J].Biochemical and Biophysical Research Communications,2002,290(1):169-176.
[11]Rosenquist T A,Martin G R.Fibroblast growth factor signalling in the hair growth cycle:expression of the fibroblast growth factor receptor and ligand genes in the murine hair follicle [J].Developmental Dynamics:an Official Publication of the American Association of Anatomists,1996,205(4):379-386.
[12]Li W R,Liu C X,Zhang X M,et al.CRISPR/Cas9-mediated loss of FGF5 function increases wool staple length in sheep [J].The FEBS Journal,2017,284(17):2764-2773.
[13]Ito C,Saitoh Y,Fujita Y,et al.Decapeptide with fibroblast growth factor(FGF)-5 partial sequence inhibits hair growth suppressing activity of FGF-5[J].Journal of Cellular Physiology,2003,197(2):272-283.
[14]He X L,Chao Y,Zhou G X,et al.Fibroblast growth factor 5-short(FGF5s) inhibits the activity of FGF5 in primary and secondary hair follicle dermal papilla cells of Cashmere goats[J].Gene,2016,575(2):393-398.
[15]Zhang L H,He S G,Liu M J,et al.Molecular cloning,characterization,and expression of sheep FGF5 gene[J].Gene,2015,555(2):95-100.
[16]高原,阿力玛,李璐,等.靶除内蒙古白绒山羊FGF5基因对其毛被性状的影响[J].内蒙古农业大学学报(自然科学版),2016,37(1):61-65.
GAO Yuan,A Lima,LI Lu,et al.Effecs of knockout FGF5 in Inner Mongolian white Cashmere goats on fleece traits [J].Journal of Inner Mongolia Agricultural University(Natural Science Edition),2016,37(1):61-65.
[17]Hu R,Fan Z Y,Wang B Y,et al.RAPID COMMUNICATION:Generation of FGF5 knockout sheep via the CRISPR/Cas9 system [J].J Anim Sci,2017,95(5):2019-2024.
[18]毛林军.FGF5基因编辑绵羊精液冷冻及体外胚胎的制备与分析[D].乌鲁木齐:新疆农业大学,2022.
MAO Linjun.Preparation and analysis of frozen semen and in vitro embryos of FGF5 gene-edited sheep [D].Urumqi:Xinjiang Agricultural University,2022.
[19]胡慧宇.FGF5基因编辑细毛羊的遗传稳定性和自身健康评估[D].乌鲁木齐:新疆农业大学,2021.
HU Huiyu.Evaluation of genetic stability and self-health safety by FGF5 gene edited fine-wool sheep [D].Urumqi:Xinjiang Agricultural University,2021.
[20]关鸣轩,魏趁,佀博学,等.苏博美利奴羊主要经济性状的遗传参数估计[J].中国畜牧杂志,2022,58(1):97-101.
GUAN Mingxuan,WEI Chen,SI Boxue,et al.Estimation of genetic parameters of main economic traits of Subo Merino sheep [J].Chinese Journal of Animal Science,2022,58(1):97-101.
[21]魏趁,關鸣轩,付雪峰,等.运用贝叶斯方法估计中国美利奴羊(新疆型)毛用性状及繁殖性状的遗传参数[J].畜牧兽医学报,2020,51(7):1537-1547.
WEI Chen,GUAN Mingxuan,FU Xuefeng,et al.Estimates of genetic parameters for wool and reproductive traits in Chinese Merino sheep(Xinjiang type) by bayesian method [J].Acta Veterinaria et Zootechnica Sinica,2020,51(7):1537-1547.
[22]乔国艳,袁超,李文辉,等.高山美利奴羊重要经济性状遗传参数估计[J].中国畜牧杂志,2019,55(10):58-62.
QIAO Guoyan,YUAN Chao,LI Wenhui,et al.Estimation of genetic parameter for important economic traits of Alpine Merino sheep [J].Chinese Journal of Animal Science,2019,55(10):58-62.
[23]Wang X,Niu Y,Zhou J,et al.CRISPR/Cas9-mediated MSTN disruption and heritable mutagenesis in goats causes increased body mass[J].Animal Genetics,2018,49(1):43-51.
[24]尚利青,宋绍征,张婷,等.MSTN基因突变纯合子兔的繁育和表型分析[J].生物工程学报,2022,38(5):1847-1858.
SHANG Liqing,SONG Shaozheng,ZHANG Ting,et al.Propagation and phenotypic analysis of mutant rabbits with MSTN homozygous mutation [J].Chinese Journal of Biotechnology,2022,38(5):1847-1858
[25]Xu Y X,Liu H M,Pan H L,et al.CRISPR/Cas9-mediated Disruption of Fibroblast Growth Factor 5 in Rabbits Results in a Systemic Long Hair Phenotype by Prolonging Anagen[J].Genes,2020,11(3):297.
Effects of different gene editing types on traits of FGF5 gene-edited sheep wool
YUE Chenggung1,LI Zhonghui1,2,LIU Chenxi1,2,HE Sangang1,2,MA Haiye3,LIU Xuan3,LI Jingping1,LI Wenrong1,2
(1. Institute of Biotechnology,Xinjiang Academy of Animal Sciences,Urumqi 830011,China; 2.Key Laboratory of Animal Biotechnology of Xinjiang,Urumqi 830011,China; 3.College of Animal Sciences,Xinjiang Agricultural University,Urumqi 830052,China)
Abstract:【Objective】 To study the effects of different gene editing types on wool traits in FGF5 gene-edited fine-wool sheep in the hope of providing a theoretical basis for subsequent studies on the genetic parameters of wool traits in gene-edited fine-wool sheep.
【Methods】 In this study,data on traits such as wool length,wool straight length,wool fiber diameter and greasy fleece weight from 181 FGF5-year-old gene-edited fine-wood sheep from the sheep breeding base of Xinjiang Academy of Animal Sciences were collected for analysis.
【Results】 The wool length of FGF5 gene editing fine wool sheep was 10.49 cm with a coefficient variation of 11.82%.Wool length and greasy fleece weight of FGF5-InDel and FGF5-HDR gene-edited fine-wool were extremely significant higher than that of the wild type(P<0.01).The wool length and wool straight length of -28 bp or -26 bp,-2 bp and replacement(c.61 C>T) were extremely significant longer than that of the wild type(P<0.01),and the greasy fleece weight at -28 bp or -26 bp was significantly higher than that of the wild type(P<0.05).The wool length and wool straight length of double-allele-edited and single-allele-edited mutations of the -28 bp genotype had extremely significantly longer than those of thewild type(P<0.01).
【Conclusion】 Different gene editing types of FGF5 gene editing in fine wool sheep significantly increase the wool length and greasy fleece weight,which can be used to form a core population of gene-edited sheep with outstanding phenotypic traits,promote the selection and expansion of FGF5 gene-edited sheep.
Key words:FGF5 gene-edited fine-wool sheep; edit type; wool length; greasy fleece weight; genotype; mutation type
Fund project:National Major Special Sub project for the Cultivation of New Genetically Modified Biological Varieties "Cultivation of Long Hair Type Genetically Modified Superfine Wool Sheep"(2016ZX0808001-002)
Correspondence author: LI Wenrong(1969 -),female,from Jiangsu, researcher,Ph.D, doctoral supervisor,majoring in animal genetics and breeding,(E-mail) xjlwr@126.com
