紫花苜蓿炭疽病病原新记录种(Colletotrichum liriopes)的鉴定及生物学特性分析
2024-04-28柳丰祖丽皮耶·安外尔李克梅托伦巴特·毕亚洪
柳丰 祖丽皮耶·安外尔 李克梅 托伦巴特·毕亚洪

doi:10.6048/j.issn.1001-4330.2024.03.019
摘 要:【目的】从炭疽病症状的紫花苜蓿病株分离得到一种炭疽菌,与此前报道的三叶草炭疽菌(Colletotrichum trifolii)、北美炭疽菌(C.americae-borealis)形态上略有差异,研究该菌致病性、分类地位及其生物学特性并鉴定。
【方法】采用组织分离法获得炭疽菌菌株,经柯赫氏法则证明其致病性,并运用形态学观察结合多基因片段PCR扩增法鉴定病原菌种类,测定不同培养基、碳源、氮源、温度、pH值、光照对该菌菌落生长的影响。
【结果】从紫花苜蓿炭疽病病部分离获得一种新的致病炭疽菌,为麦冬炭疽菌(Colletotrichum liriopes)。该菌在5~35℃,pH值4~11的多数供试培养基、氮源、碳源条件下均能生长。
【结论】麦冬炭疽菌(C.liriopes)可侵染紫花苜蓿引起炭疽病,其菌落最适生长温度为28℃,最佳氮源、碳源分别是酵母和可溶性淀粉,最适pH为7,菌丝致死温度61℃,12 h光暗交替对菌落生长有利。
关键词:苜蓿炭疽病;麦冬炭疽菌;鉴定;生物学特性
中图分类号:S435.5 文献标志码:A 文章编号:1001-4330(2024)03-0690-09
收稿日期(Received):
2023-08-03
基金项目:
国家重点研发计划项目(2022YFD1401101)
作者简介:
柳丰(1998-),女,新疆人,硕士研究生,研究方向为植物病理学,(E-mail)1968484375@qq.com
通讯作者:
李克梅(1972-),女,江苏人,教授,博士,硕士生导师,研究方向为植物病理学,(E-mail)likemei@xjau.edu.cn
0 引 言
【研究意义】紫花苜蓿(Medicago sativa)是一种多年生豆科牧草,营养价值高,适口性好,产量高[1]。苜蓿还具有固氮[2]、改良土壤、防风固沙、恢复植被的能力[3],在我国主要牧区广泛种植,近年种植面积已达到3.77×106 hm2[4]。随着苜蓿种植面积不断增加,病害问题日渐突出[5]。苜蓿炭疽病是危害紫花苜蓿的主要病害之一,在世界各苜蓿主要种植区普遍发生[6],我国主要苜蓿种植区也有发生。苜蓿炭疽病最早在新疆阿勒泰地区发生,之后在塔城地区、昌吉州、阿克苏地区、喀什地区等主要种植区均有发现。在昌吉州呼图壁县种牛场,苜蓿炭疽病的发病率由2016年的7.5%增加到2020年的76%[7],发病苜蓿枝条枯萎,植株稀疏,减产15%~20%。对新获得的一种炭疽菌的致病性、分类地位和生物学特性开展研究,了解其菌丝生长所需营养物质和适宜的环境条件,对新疆苜蓿炭疽病的防治有实际意义。【前人研究进展】苜蓿炭疽病在多个研究文献中均有报道[8,9]。Maloy[10]研究发现苜蓿种子携带炭疽菌可能会导致苜蓿嫩枝坏死或萎蔫。Barnes[11]报道苜蓿炭疽病使北卡罗莱纳州和马里兰州的感病苜蓿品种干草产量,且周期性复发,降低了苜蓿的产量和品质,造成严重经济损失。目前已知引起苜蓿炭疽病的病原有三叶草炭疽菌(C.trifolii)、毁灭炭疽菌(C.destructivum)、平头炭疽菌(C.truncatum)、球状炭疽菌(C.coccodes)、束状炭疽菌(C.dematium)、亚麻炭疽菌(C.linicola)、禾生炭疽菌(C.graminicola)、盘长孢炭疽菌(C.gloeosporioides)、菜豆炭疽菌(C.incanum)、菠菜炭疽菌(C.spinaciae)和北美炭疽菌(C.americae-borealis)11种[7,12]。苜蓿炭疽病在我国甘肃酒泉、宁夏银川、内蒙古赤峰、内蒙古图牧吉、四川新都、云南小哨、吉林白城、河北廊坊、河北张家口、黑龙江齐齐哈尔等地均有发生,有的发病率最高可达70%[8,9]。王雪薇[13]研究报道了三叶草炭疽菌引起的苜蓿炭疽病在新疆阿勒泰地区发生。李克梅、胡文静[13,14]报道了北美炭疽菌在新疆引起苜蓿炭疽病。【本研究切入点】新疆是我国苜蓿主要种植区[15],苜蓿炭疽病是危害苜蓿的主要病害之一。胡文静[7]对引起新疆苜蓿炭疽病的三叶草炭疽菌(C.trifolii)、北美炭疽菌(C.americae-borealis)做了生物学特性、藥剂筛选研究,并开展了40个苜蓿品种对三叶草炭疽菌的抗性评价。但关于苜蓿炭疽病新的病原菌的分类地位、病原菌生物学特性缺少明确描述。因此需研究该菌致病性、分类地位及其生物学特性并鉴定。【拟解决的关键问题】采用组织分离法分离病原菌,结合形态学和分子生物学确定病菌分类地位,并研究其生物学特性,为新疆苜蓿炭疽病的发生与防治提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试菌株
供试菌株由新疆农业大学牧草病害课题组从紫花苜蓿炭疽病病株上分离获得并保存。
1.1.2 供试培养基
马铃薯葡萄糖琼脂培养基(PDA)、察氏培养基(Czapek)、燕麦片琼脂培养基(OMA)、淀粉琼脂培养基(SA)、葡萄糖蛋白胨琼脂培养基(GPA)、马铃薯蔗糖琼脂培养基(PSA)、玉米粉琼脂培养基(CMA)、平板计数培养基(PCA)、酵母浸膏琼脂培养基(YEA)、麦芽糖琼脂培养基(MA)。
1.1.3 仪器及试剂
供试仪器:超净工作台;高压灭菌锅;恒温培养箱;电子显微镜;电子天平;冰箱;高速冷冻离心机;PCR扩增仪;电泳仪;凝胶成像仪;水浴锅等。
供试试剂:2×Taq PCR Mater Mix,2k bp DNA Marker,10×PCR Buffer(Mg2+),均来自上海生工生物技术有限公司。
1.2 方 法
1.2.1 病原菌的分离纯化
采用组织分离[16]进行病原菌的分离。选取苜蓿炭疽病典型症状的植株材料用剪刀将苜蓿病健交接处剪成5 mm的小块,用2%次氯酸钠进行表面消毒1 min,再用无菌水冲洗3次,置于灭菌滤纸上,吸去多余的水分后,均匀摆放在直径7.5 cm的PDA平板上。每个培养皿内放5个组织块,用封口膜密封放置于25℃恒温培养箱黑暗培养,24 h后挑取菌丝接种在PDA平板上,25℃培养7 d,经单胞分离获得纯培养,后续使用甘油法[17]进行菌种保存。
1.2.2 病原菌的致病性测定
使用菌丝块接种法[18],选取健康苜蓿叶片,用2%次氯酸钠进行叶片表面消毒,于叶片正面用无菌接种针形成伤口,在培养基上打取5 mm菌块,菌丝朝下接种于叶片伤口处,以同样大小的无菌PDA块为对照,25℃培养箱培养,重复处理3次,每天观察叶片发病情况。待叶片发病后重新分离病原菌,于显微镜下观察其是否与接种病原菌一致。
1.2.3 病原菌鉴定
1.2.3.1 形态学
将病原菌接种到PDA平板中央,25℃培养箱培养7 d,观察其菌落、分生孢子等形态,对病原菌进行初步鉴定。
1.2.3.2 分子生物学
使用真菌基因组DNA快速抽提试剂盒(生工,B518229)提取目的菌株的DNA,对核糖体内转录间隔区ITS(ITS1/ITS4)、肌动蛋白ACT(ACT-512F/ACT-783R)、几丁质合成酶CHS(CHS-79F/CHS-354R)、β-微管蛋白TUB2(T1/Bt-2b)、组蛋白HIS3(CYLH3F/CYLH3R),5种基因片段进行PCR扩增,并根据各基因对应的PCR反应体系(CHS-1基因序列引物采用20 μL反应体系:1 μLDNA模板液,10 μL2×Tag PCR MaeterMix,0.5 μL上游引物,0.5 μL下游引物,8 μL ddH2O;其余几种为25 μL反应体系:1 μLDNA模板液,12.5 μL2×Tag PCR MaeterMix,1 μL上游引物,1 μL下游引物,9.5 μL ddH2O),以等量ddH2O为模板设置阴性对照,后用1%的琼脂糖凝胶电泳对PCR扩增产物进行检测,检测合格后,送至上海生工生物工程有限公司测序。测序结果与GenBank中已发表的序列进行同源性分析比对,下载同源性高于98%的序列,后采用邻接建树法构建系统发育树。苜蓿疽病菌的ITS、ACT、CHS-1、TUB2和HIS3序列提交至NCBI,获取 GenBank 登录号。
1.2.4 病原菌生物学特性
菌丝最适氮源、碳源、培养基的筛选:置于以Czapek培养基为基础培养基制成的不同氮源培养基平板上,配制方法为将其中的硝酸钠等质量替换为蛋白胨、硫酸铵、氯化铵、L-谷氨酰胺、硝酸钾、酵母浸粉7种不同氮源;置于以Czapek培养基为基础培养基制成的不同碳源培养基平板上,配制方法为将其中的蔗糖等质量替换为葡萄糖、麦芽糖、可溶性淀粉、果糖、木糖、乳糖、甘油、菊糖、甘露醇、10种不同碳源;置于PDA、OMA、SA、GPA、PSA、Czapek、CMA、PCA、MA、YEA培养基;
菌丝最适生长温度、光照、pH的测定:置于温度分别为5、10、15、20、25、28、30和35℃的不同溫度梯度的恒温培养箱中进行培养;置于24 h连续光照、24 h连续黑暗、12 h光黑交替的三种光照处理的25℃恒温培养箱中培养;用1 mol/L HCL和1 mol/ NaOH的溶液将PDA培养基的pH分别调试为4、5、6、7、8、9、10、11的8中不同pH的培养基平板中培养;
菌丝致死温度的测定:将培养7 d直径为5 mm的菌饼放到装有1 mL无菌水的1.5 mL离心管中,将其分别置于40、45、50、55、56、57、58、59、60、61、62、63、64和65℃的金属浴孵化器中加热10 min,晾干后分别接种于PDA培养基平板上。
用灭菌的打孔器(5 mm)取菌饼,分别于上述条件下培养7 d,每个处理重复3次,十字交叉法测量菌落直径。
1.3 数据处理
使用Mega 7进行系统发育树的构建;SPSS 2.0软件进行数据统计分析,Prism 8.0.2软件作图。
2 结果与分析
2.1 病原菌的分离纯化及致病性测定
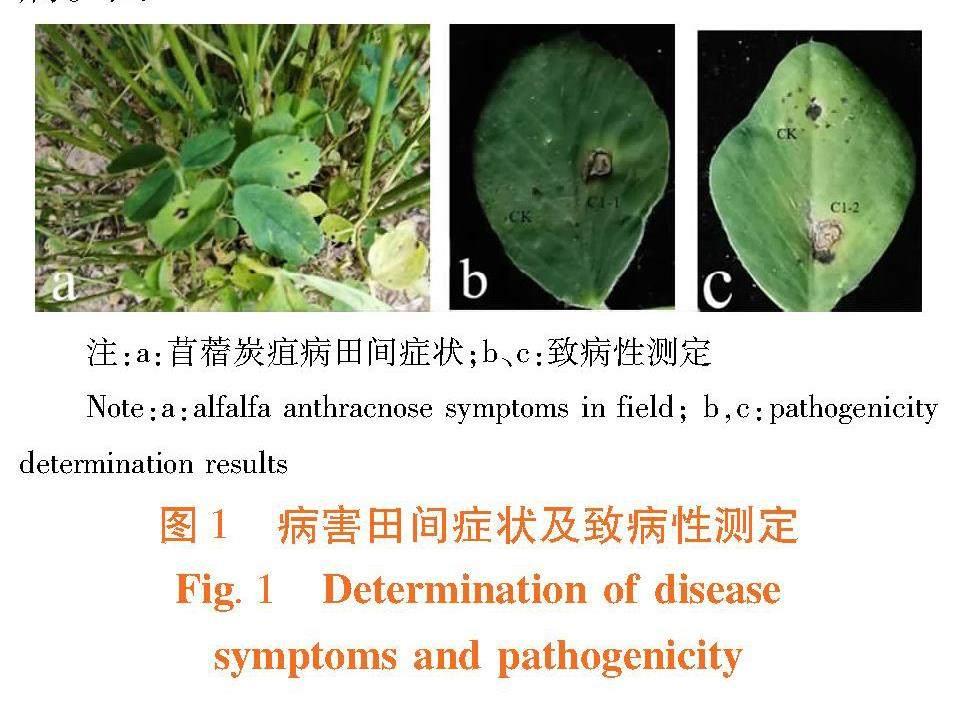
研究表明,苜蓿炭疽病主要危害苜蓿的叶片、茎秆及根部,茎秆被害后呈淡褐色凹陷病斑,菱形至长条状,严重时绕茎一周;叶片受害后变薄褪绿,病斑呈针尖状至圆形或椭圆形,呈黄褐色或赤褐色;病害发生严重时整株枯死。从采集的炭疽病害样品叶片中分离纯化共得到一种炭疽菌菌株,此前分离得到的三叶草炭疽菌(Colletotrichum trifolii)、北美炭疽菌(C.americae borealis)形态上略有差异。选取2个代表菌株C1-1、C1-2进行后续试验。
将病原菌接种至健康的苜蓿叶片上,5 d后叶片褪绿并出现病斑,与田间发病症状相似,对照部位未见感病症状。从病斑处重新分离得到的菌株与接种病菌一致,该菌可侵染苜蓿引致苜蓿炭疽病。图1
2.2 病原菌的形态特征
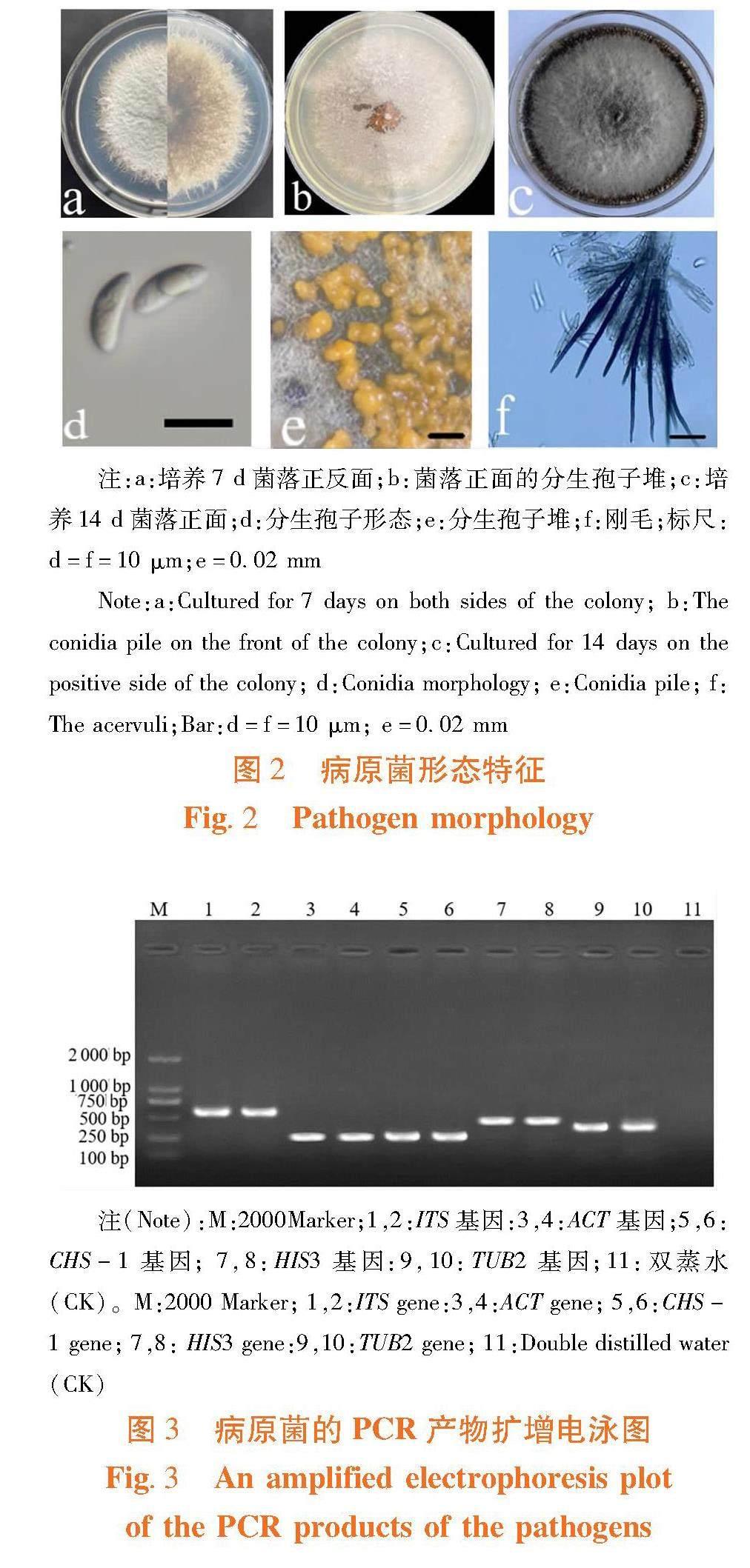
研究表明,该菌于25℃恒温条件下在PDA培养基平板上培养7 d,菌落净生长直径可达49.68 mm;菌落近圆形,边缘不整齐,菌丝致密绒毛状,白色至灰青色,菌落背面呈褐色,长时间培养菌落颜色加深;大量孢子在平板上呈橘黄色,分生孢子无色、单孢、新月形,光滑、两头钝尖,中间膨大,有一个小油球,大小15.30~17.80 × 4.30~6.10 μm;刚毛褐色有隔,大小为27.10~31.40 μm。菌落形态与孢子形态均与模式种C.liriopes(CBS 119444)的形态相似,将其初步鉴定为麦冬炭疽菌。图2
2.3 病原菌分子生物学鉴定
研究表明,提取代表菌株Cl-1、Cl-2的DNA作为模板,采用PCR技术分别扩增其核糖体核苷酸(ITS)、肌動蛋白(ACT)、几丁质合成酶(CHS-1)、组蛋白(HIS3)、β-微管蛋白(TUB2)基因片段,扩增得到的PCR产物经凝胶电泳检测后分别得到大小约为550、260、270、470和400 bp的条带;将特异性条带回收测序,在GenBank数据库中对各基因序列分别进行比对,2个供试菌株均与C.liriopes聚在同一分支,相似性达99%以上。将其进一步鉴定为C.liriopes。菌株C1-1、C1-2的ITS基因登录号分别为OQ678010、OQ678011,ACT基因登录号分别为OQ659467、OQ659468,CHS-1基因登录号分别为OQ659469、OQ659470,HIS3基因登录号分别为OQ659471、OQ6594772,TUB2基因登录号分别为OQ659473、OQ6594774。图3、图4
2.4 病原菌生物学特性测定
2.4.1 菌丝最适培养基筛选
研究表明,麦冬炭疽菌(C.liriopes)在供试的10种培养基上均能生长,在25℃恒温条件下培养7 d,菌株在PCA培养基上菌丝生长最快,菌落平均净生长直径可达54.55 mm,其后依次为MA、SA、PDA、OMA、YEA,与其他培养基存在显著性差异(P<0.05)。PDA为麦冬炭疽菌(C.liriopes)菌丝生长最适培养基。图5
2.4.2 菌丝最适生长氮源筛选
研究表明,麦冬炭疽菌(C.liriopes)在供试的7种不同氮源培养基上均能生长。在25℃恒温条件下培养7 d,当以蛋白胨、酵母为氮源时菌丝生长最快,菌落平均净生长直径分别可达58.21、59.20 mm,与其他不同含氮培养基存在显著性差异(P<0.05)。酵母为麦冬炭疽菌(C.liriopes)最适氮源,有利于菌丝生长。图6
2.4.3 菌丝最适生长碳源筛选
研究表明,菌麦冬炭疽菌(C.liriopes)在供试的10种不同碳源培养基上均能生长;在25℃恒温条件下培养7 d,菌株在含可溶性淀粉的培养基中菌丝生长最快,菌落平均净生长直径可达57.33 mm,在碳源分别为菊糖、麦芽糖、甘油、蔗糖时菌丝生长也较快,与其他处理存在显著性差异(P<0.05)。可溶性淀粉是最适宜菌麦冬炭疽菌(C.liriopes)菌丝生长的碳源。图7
2.4.4 菌丝最适生长温度的测定
研究表明,菌麦冬炭疽菌(C.liriopes)在5~35℃温度范围内菌丝均能生长,但温度较低时(5、10℃)菌丝生长缓慢,温度过高(35℃)会降低菌丝生长速率。28℃时菌丝生长最快,菌落平均净生长直径可达56.90 mm,20、25和30℃菌丝生长也较好,菌落平均净生长直径分别为48.98、49.97和48.12 mm,与其他温度处理存在显著性差异(P<0.05)。28℃为该菌菌丝最佳生长温度。图8
2.4.5 菌丝最适生长pH的测定
研究表明,菌麦冬炭疽菌(C.liriopes)在pH为4~11的培养基上均能生长,其酸碱适应性范围较广。当pH为7时最适合菌株生长,菌落平均净生长直径可达58.30 mm,与其他pH条件存在显著性差异(P<0.05)。该菌在中性环境下生长更适宜。图9
2.4.6 菌丝最适生长光照条件的测定
研究表明,在25℃恒温培养7 d条件下,菌株在不同光照条件下均能生长,连续光照、12 h光暗交替及连续黑暗,菌落净生长直径分别为51.87、54.58和50.05 mm,与连续黑暗处理存在显著性差异(P<0.05),12 h光暗交替有利于菌株生长。图10
2.4.7 菌丝致死温度的测定
研究表明,25℃恒温培养7 d,菌株经40~60℃水浴10 min后,菌丝仍可正常生长;该菌经61℃水浴10 min后不再生长,与其他温度处理差异显著(P<0.05),故61℃为供试菌株致死温度。图11
3 讨 论
3.1
从苜蓿上分离获得一种致病炭疽菌,采用形态学结合分子生物学的方法,将其鉴定为麦冬炭疽菌(C.liriopes),证实麦冬炭疽菌侵染苜蓿引起叶斑,为麦冬炭疽菌(C.liriopes)在国内新记录寄主。Damm等[19]发现麦冬炭疽菌(C.liriopes)是墨西哥麦冬属风信子的病原菌,将其记录为新种;Yang等[20]在中国西南地区报道了麦冬炭疽菌(C.liriopes)是兰花根茎上的内生真菌;Tao等[21]发现麦冬炭疽菌(C.liriopes)是中国白芨兰上的内生菌。李娟[22]发现C.liriopes能引起多种植物炭疽病,无寄主专一性且在部分寄主植物上是首次发现。C.liriopes属于白蜡树炭疽复合种(C.spaethianum complex)下的一个种,该菌株分生孢子大小和形态与张申萍[23]报道一致,但菌落形态有所不同,可能与菌种保存多次继代培养有关。
3.2
麦冬炭疽菌(C.liriopes)在温度为5~35℃均可生长,28℃菌丝生长最快,与娄喜艳等[24]对引起月季炭疽病的胶孢炭疽菌(C.gloeosporioides)的以及胡文静[7]对引起苜蓿炭疽病的北美炭疽菌(C.americae-borealis)研究结果一致,但与黄蔚等[25]对西瓜炭疽病以及胡文静[7]对引起苜蓿炭疽病的三叶草炭疽菌(C.trifolii)的研究结果不同,其菌丝最适生长温度均为25℃,可能是病原菌对不同寄主、不同地域温度要求不同。该菌在pH为4~11时均可生长,菌丝最适生长pH为7,其生长对酸碱度要求不高,在中性环境下生长较适宜,与张宝清等[26]报道的引起四季秋海棠炭疽病的平头炭疽菌(C.truncatum)的研究结果一致,但与余贤美等[27]报道引起柿树炭疽病的哈锐炭疽菌(C.horii)生长最适pH为5不同,也有别于胡文静[7]报道引起苜蓿炭疽病的北美炭疽菌(C.americae-borealis)、三叶草炭疽菌(C.trifolii)的生长最适pH均为6。上述结果表明不同炭疽菌生长所需酸碱环境不同。该菌在多数常见培养基均能生长,在PCA培养基上生长最佳,且光照对其生长影响不大,菌丝致死温度为61℃。该菌能利用所有供试碳氮源,不同处理间差异显著。其中最适氮源为酵母,最适碳源为可溶性淀粉,最适碳源与施玉萍等[28]对橡胶树炭疽病菌的研究结果一致。对麦冬炭疽菌引起苜蓿炭疽病的发病率、病害严重程度还需要进一步开展深入调查;对该菌生物学特性研究也仅限于环境对菌丝生长特性的影响,对病菌产孢性能及致病力的影响还需要进一步研究。
4 结 论
麦冬炭疽菌(C.liriopes)可侵染紫花苜蓿引起炭疽病,该菌菌落最适生长温度为28℃,最佳氮源、碳源分别是酵母和可溶性淀粉,最适pH为7,菌丝致死温度61℃,12 h光暗交替对菌落生长有利。
参考文献(References)
[1]
潘卫仓.紫花苜蓿的主要成分及其在畜牧业中的应用[J].中兽医医药杂志,2015,34(2):73-77.
PAN Weicang.Main composition of alfalfa and its application in animal husbandry [J].Journal of Traditional Chinese Veterinary Medicine,2015,34(2):73-77.
[2]朱勤,陈忆凤,颜婕,等.紫花苜蓿用于水产饲料的特性探究[J].南方农业,2019,13(12):5-6.
ZHU Qin,CHEN Yifeng,YAN Jie,et al.Study on the characteristics of alfalfa in aquatic feed [J]. South China Agriculture,2019,13(12):5-6.
[3]Gholami A,De Geyter N,Pollier S,et al.Natural product biosynthesis in Medicago species [J].Natural Product Reports, 2014,31(3):356-80.
[4]赵晓登,李玉帅,陈腾达,等.紫花苜蓿在动物饲养与生态治理领域的应用研究进展[J].安徽农学通报,2020,26(8):37-40.
ZHAO Xiaodeng,LI Yushuai,CHEN Tengda,et al.Research progress on the application of alfalfa in the field of animal feeding and ecological governance[J].Anhui Agricultural Science Bulletin,2020,26(8):37-40.
[5]袁庆华.我国苜蓿病害研究进展[J].植物保护,2007,33(1):6-10.
Qinghua.Research progress of alfalfa diseases in China [J].Plant Protection, 2007,33(1):6-10.
[6]胡文靜,杨亚鹏,阿斯亚姆·阿布都克依木,等.40个苜蓿品种对炭疽病的苗期抗性评价[J].草业科学,2021,38(8):1579-1586.
HU Wenjing,YANG Yapeng,Asiyamu Abudukeyimu,et al.Evaluation of seedling resistance of 40 alfalfa cultivars to anthrax [J]. Pratacultural Science, 2021,38(8):1579-1586.
[7]胡文静.新疆苜蓿炭疽病病原学及防治技术初探[D].乌鲁木齐:新疆农业大学,2021.
HU Wenjing.Preliminary study on pathogenology and prevention technology of alfalfa anthrax in Xinjiang [D].Urumqi:Xinjiang Agricultural University,2021.
[8]马甲强,王生荣,袁庆华,等.苜蓿毁灭刺盘孢菌的主要生物学特性[J].植物保护,2016,42(4):105-110.
MA Jiaqiang,WANG Shengrong,YUAN Qinghua,et al.The main biological characteristics of alfalfa destroying Spinosporus [J].Plant Protection, 2016,42(4):105-110.
[9]徐杉.紫花苜蓿炭疽病的病原及其致病性研究[D].兰州:兰州大学,2019.
XU Shan. Study on pathogens and pathogenicity of alfalfa anthracnose [D].Lanzhou:Lanzhou University,2019.
[10]Maloy O C.Alfalfa anthracnose in Washington[J].Plant Disease Reporter, 1968,52(12):983.
[11]Barnes D K,Ostazeski S A,Schillinger J A.Effect of anthracnose(Colletotrichum trifolii) infection on yield,stand and vigor of alfalfa[J].Crop Science, 1969,9(3):344-346.
[12]罗庭,李彦忠.紫花苜蓿炭疽病的研究进展[C].植物健康与病虫害防控,2020:42.
LUO Ting,LI Yanzhong.Research progress of alfalfa anthracnose [C].Plant Health and Pest Control, 2020:42.
[13]王雪薇,王纯利,周刚,等.新疆阿勒泰新垦区苜蓿病害调查与分析[J].新疆农业科技,1996,(3):42-46.
WANG Xuewei,WANG Chunli,ZHOU Gang,et al.Investigation and analysis of alfalfa disease in Altay Xinken District,Xinjiang[J].Xinjiang Agricultural Science and Technology,1996,(3):42-46.
[14]Li K M,Hu W J,Don X L,et al.First Report of Alfalfa Anthracnose Caused by Colletotrichum americae-borealis in Xinjiang,China .[J].Plant Dis,2021,105:3307.
[15]李克梅,赵莉,孙红艳.新疆苜蓿病害研究现状与展望[J].新疆农业科学,2010,47(7):1348-1352.
LI Kemei,ZHAO Li,SUN Hongyan.Research status and prospect of alfalfa disease in Xinjiang [J].Xinjiang Agricultural Sciences,2010,47(7):1348-1352.
[16]方中达.植病研究方法(第3版)[M].北京:中国农业出版社,2001.
FANG Zhongda.Research methods of plant diseases (3rd.Edition)[M].Beijing:China Agriculture Press,2001.
[17]郭玲玲.微生物菌種保藏方法及关键技术[J].微生物学杂志,2019,39(3):105-108.
GUO Lingling.Preservation methods and key technologies of microbial cultures [J].Chinese Journal of Microbiology, 2019,39(3):105-108.
[18]周洁,吴金平,王明安,等.鱼腥草炭疽病病原鉴定及室内药剂筛选[J].南方农业学报,2022,53(10):2919-2927.
ZHOU Jie,WU Jinping,WANG Ming'an,et al.Pathogen identification and indoor agent screening of Houttuynia anthracnose[J].Southern Journal of Agricultural Sciences, 2022,53(10):2919-2927.
[19]Damm U,Woudenberg,J H C,Cannon P F,et al.Colletotrichum species with curved conidiafrom herbaceous hosts [J]. Fungal Diversity,2009,39:45-87.
[20]Y Y L,Cai L,Yu Z N,et al.Colletotrichum species on Orchidaceae in southwest China [J]. Cryptogamie Mycologie,2011,32(3):229-253.
[21]Tao G,Liu Z Y,Liu F,et al.Endophytic Colletotrichum species from Bletilla ochracea(Orchidaceae),with descriptions of seven new species [J].Fungal Diversity, 2013,61(1):139-164.
[22]李娟.成都市常见园林植物炭疽菌的分子系统发育研究[D].雅安:四川农业大学,2018.
LI Juan.Molecular phylogenetic study of anthracnose,a common garden plant in Chengdu [D].Yaan:Sichuan Agricultural University,2018.
[23]张申萍.重庆常见植物炭疽病菌主要类群、多样性及致病差异分析[D].重庆:西南大学,2019.
ZHANG Shenping.Analysis of the main groups,diversity and pathogenic differences of common plant anthrax bacteria in Chongqing [D].Chongqing:Southwest University,2019.
[24]娄喜艳,王欣阳,裴冬丽.河南商丘月季炭疽病的病原菌鉴定及生物学特性[J].江苏农业科学,2021,49(22):116-121.
LOU Xiyan,WANG Xinyang,PEI Dongli.Identification and biological characteristics of pathogenic bacteria in Shangqiu lunar anthrax,Henan [J].Jiangsu Agricultural Sciences,2021,49(22):116-121.
[25]黄蔚,崔丽红,谢王超,等.西瓜新炭疽病病原菌分子鉴定及其生物学特性初探[J].中国农学通报,2022,38(1):131-136.
HUANG Wei,CUI Lihong,XIE Wangchao,et al.Molecular identification and biological characteristics of pathogenic bacteria of watermelon new anthrax[J].Chinese Agricultural Science Bulletin, 2022,38(1):131-136.
[26]張宝清,翟雅鑫,薛丽芳,等.四季秋海棠炭疽病菌生物学特性及生防因子的筛选[J].北方园艺,2021,(10):66-71.
ZHANG Baoqing,ZHAI Yaxin,XUE Lifang,et al.Biological characteristics and screening of biocontrol factors of begonia anthracnose [J].Northern Horticulture, 2021,(10):66-71.
[27]余贤美,侯长明,王洁,等.柿树炭疽病菌的生物学特性及其抑菌药剂筛选[J].中国南方果树,2018,47(2):114-119.
YU Xianmei,HOU Changming,WANG Jie,et al.Biological characteristics of persimmon anthracnose and screening of its bacteriostatic agent [J].South China Fruits,2018,47(2):114-119.
[28]施玉萍,刘一贤,李岚岚,等.橡胶树炭疽病病原菌Colletotrichum laticiphilum生物学特性研究及防治药剂筛选[J].热带农业科技,2019,42(3):6-11,14.
SHI Yuping,LIU Yixian,LI Lanlan,et al.Study on biological characteristics of Colletotrichum laticiphilum[J].Tropical Agricultural Science and Technology,2019,42(3):6-11,14.
Identification of new pathogens of alfalfa anthracnose(Colletotrichum liriopes) and preliminary study on biological characteristics
LIU Feng1,Zulipiye Anwaier1,LI Kemei1,Tuolunbate Biyahong2
(1. College of Agronomy,Xinjiang Agricultural University/Key Laboratory of Prevention and Control of Invasive Organisms in Agriculture and Forestry in Northwest Desert Oases,Ministry of Agriculture and Rural Affairs(co-constructed by Ministry and Province)/Key Laboratory of Monitoring and Safety Prevention and Control of Agricultural and Forestry Pests,Urumqi 830052,China;2.Agriculture (animal husbandry) development center,Ergong town,Tacheng,Tacheng Xinjiang 834300,China)
Abstract:【Objective】 This project aims to isolate an anthrax strain from alfalfa with the symptoms of anthracnose,which would be slightly different from the previously reported Colletotrichum trifolii and C.americae borealis in morphology in order to clarify the pathogenicity,taxonomic status and biological characteristics of this strain through a series of studies.
【Methods】 Anthrax strain was obtained by tissue isolation,and its pathogenicity was proved by Koch's rule and morphological observation combined with PCR amplification of polygene fragments was used to identify the pathogenic bacteria.Meanwhile,the effects of different culture media,carbon source,nitrogen source,temperature,pH value and light on the colony growth of anthrax strain were determined.
【Results】 A new pathogenic anthrax strain was isolated from alfalfa,and identified as Colletotrichum liriopes.The strain could grow under the conditions of 5-35℃ and pH 4-11,and most of the test medium,nitrogen source and carbon source conditions.
【Conclusion】 C.liriopes can infect alfalfa and cause anthracnose.The optimum growth temperature of C.liriopes is 28℃,the optimum nitrogen source and carbon source are yeast and soluble starch respectively,the optimum pH is 7,the lethal temperature of mycelium is 61℃,and the alternation of light and dark for 12 h is favorable to the growth of the colony.
Key words:alfalfa anthracnose; C.liriopes; identification; biological characteristics
Fund project:Nationaal Key R&D Program of China(2022YDF1401101)
Correspondence author: LI Kemei(1972-), female,from Jiangsu,professor,research direction is plant pathology,(E-mail)likemei@xjau.edu.cn
