1例滤泡性非霍奇金淋巴瘤持续新冠病毒阳性伴耶氏肺孢子菌肺炎的药物治疗调整与药学监护
2024-02-27罗芬张捷青叶晓芬李晓宇毕晶
罗芬 张捷青 叶晓芬 李晓宇 毕晶
摘 要 1例滤泡性非霍奇金淋巴瘤感染新冠病毒后持续阳性及并发急性呼吸窘迫综合征,多疗程抗病毒治疗后仍未转阴,同时合并三系降低,且继发了耶氏肺孢子菌肺炎、细菌感染、巨细胞病毒感染等,针对该免疫抑制宿主长病程的不同阶段,不同治疗矛盾,综合患者当时情况及药物特点及时进行了药物调整和药学监护,患者整体情况逐渐好转。本例反映了在复杂的病情变化中,药物治疗要抓住实时的主要矛盾,动态地调整治疗方案。
关键词 滤泡性非霍奇金淋巴瘤 新型冠状病毒感染 耶氏肺孢子菌肺炎 药物治疗调整 药物监护
中图分类号:R969.3 文献标志码:B 文章编号:1006-1533(2024)01-0069-06
引用本文 罗芬, 张捷青, 叶晓芬, 等. 1例滤泡性非霍奇金淋巴瘤持续新冠病毒阳性伴耶氏肺孢子菌肺炎的药物治疗调整与药学监护[J]. 上海医药, 2024, 45(1): 69-74.
基金项目:湖南省自然科学基金资助项目(2020JJ5821)
Adjustment of drug therapy and pharmaceutical care for a case of follicular non-Hodgkin lymphoma with persistent coronavirus positivity accompanied by Pneumocystis jirovecii pneumonia
LUO Feng1,2, ZHANG Jieqing1, YE Xiaofen1, LI Xiaoyu1, BI Jing3
(1. Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China; 2. Department of Pharmacy, the Second Xiangya Hospital, Central South University, Changsha 410011, China; 3. Respiratory Department, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT A case of follicular non-Hodgkin lymphoma remained persistently positive for the coronavirus and developed acute respiratory distress syndrome (ARDS) after infection and his viral status did not revert to negative despite multiple courses of antiviral therapy, and meanwhile he experienced decrease in all three blood cell lines and developed secondary complications including Pneumocystis jirovecii pneumonia, bacterial infections and cytomegalovirus infection. Addressing the different stages of prolonged immunosuppression in the host, conflicting treatment strategies were identified. Considering the patients evolving condition, medication characteristics, timely adjustments to drug therapy and pharmaceutical monitoring were implemented. The patients overall condition was gradually improved. This case highlights the importance of capturing real-time primary contradictions in complex and evolving medical conditions, dynamically adjusting treatment plans.
KEY WORDS follicular non-Hodgkin lymphoma; COVID-19; Pneumocystis jirovecii pneumonia; drug therapy adjustment; pharmaceutical care
1 病史摘要
患者男性,56歲,167 cm,75 kg,体质量指数(BMI)26.89 kg/m2。因“发热2月余、气促1月”入院。
患者于2022-12-30出现发热,Tmax 39 ℃,自测新冠抗原(+),自服布洛芬退热,否认咳嗽、咳痰、胸闷等不适,3 d后体温平,复测新冠抗原(+)。2023-01-06起间断发热,间断使用非甾体抗炎药退热。2023-01-13外院胸部CT示两肺GGO密度影及条索状、片絮状密度增高影。2023-01-21复查胸部CT示GGO及渗出较前进展,2023-01-24予奈玛特韦/利托那韦(300 mg/100 mg,q12h×5 d)第一疗程治疗,2023-01-29查新冠核酸CT值为35,予激素抗炎、抗感染治疗(具体药物不详)。2023-02-06复查CT示两肺病灶较前吸收。2023-02-19患者再次出现发热伴气促,Tmax>38 ℃,无咳嗽、咳痰咯血、胸痛,体温较前升高,自测指脉氧饱和度(SpO2)<95%。遂至当地医院住院治疗,SpO2(鼻导管吸氧2 L/min)97%~99%。2023-02-20查新冠核酸CT值为23,予阿兹夫定(5 mg,qd)治疗。2023-02-21胸部CT示两肺多发斑片状、磨玻璃样高密度影,边界模糊。2023-02-25停用阿兹夫定,予奈玛特韦/利托那韦(300 mg/100 mg,q12h×5 d)第二疗程治疗,并加用地塞米松(剂量不详)抗炎,莫西沙星、哌拉西林他唑巴坦抗感染。2023-03-05查新冠核酸CT值为22,2023-03-06再次予奈玛特韦/利托那韦(300 mg/100 mg,q12h×5 d)第三疗程治疗,同时将地塞米松改为口服甲泼尼龙(剂量不详),并加用尼达尼布抗纤维化治疗,患者气促逐渐加重。为进一步诊治,于2023-03-22转运至我院。入院时患者SpO2(鼻导管吸氧3 L/min)<90%。
患者既往确诊滤泡性非霍奇金淋巴瘤(Ⅱ级,Lugano分期Ⅳb期,FLIPI评分4分)1年余,已行12周期苯达莫司汀+利妥昔单抗治疗,评估病情稳定,后予奥妥珠单抗治疗6周期,末次治疗时间2022年11月。
抽烟史600年支,已戒烟2年,无嗜酒史,其他无殊。体温(T)36.8 ℃,心率(HR)120次/min,呼吸(R)35次/min,血压(BP)130/74 mmHg;呼吸急促,两肺呼吸音粗,可闻及干啰音,三凹征(+)。
血常规:红细胞计数(RBC)3.30×109/L,血红蛋白(Hb)111 g/L,白细胞计数(WBC) 5.42×109/L,中性粒细胞百分比(N%)89 %,血小板计数(PLT)60×109/L,淋巴细胞计数(L) 0.4×109/L。
肝肾功能:肝酶稍有升高,肾功能基本无异常;血电解质:K+ 2.8 mmol/L,余无异常。
其他:C-反应蛋白(CRP)67.3 mg/L;降钙素原(PCT)0.20 ng/mL;D-二聚体1.48 mg/L;唾液酸化糖链抗原(KL-6)1 990 U/mL。
动脉血气分析(HF 50 L/min 80%):pH 7.48,二氧化碳分压(PaCO2)36.26 mmHg,氧分压(PaO2)99.5 mmHg,血氧饱和度(SaO2)98.6%。
细胞免疫:T淋巴细胞CD3 85.5%,Th淋巴细胞CD4 14.5%,Ts淋巴细胞 CD8 68.8%,CD4/CD8 0.2,B淋巴细胞绝对计数0 cells/mL。
细胞因子:白介素-6(IL-6)18.1 pg/mL。
新冠病毒IgG抗体(-);痰细菌、真菌涂片均(-)。
胸部CT示双肺弥漫炎症伴间质性改变;心脏稍大,心包少量积液,双侧胸腔少量积液;下肢静脉彩超:双下肢深静脉血流通畅。
诊断:①急性呼吸窘迫综合征(ARDS);②重症肺炎;③滤泡性非霍奇金淋巴瘤;④低钾血症;⑤贫血;⑥血小板减少;⑦心功能不全。
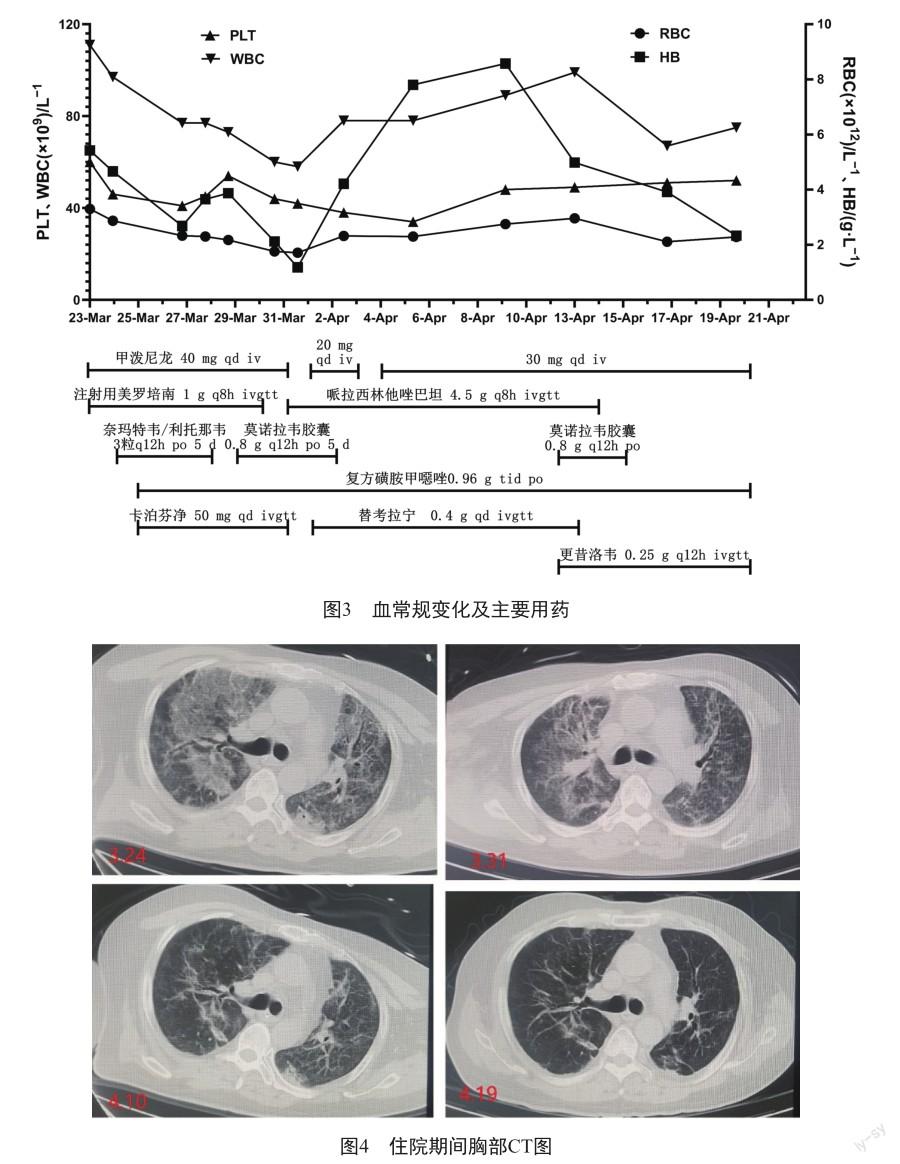
入院后予气管插管,呼吸机辅助通气,并行纤维支气管镜检查。予甲泼尼龙(40 mg,qd, iv)抗炎,美罗培南(1 g,q8h,ivgtt)抗感染,奈玛特韦/利托那韦(300 mg/100 mg,q12h×5 d)抗病毒治疗,重组人促血小板生成素及促红细胞生成素升血小板和纠正贫血,并予丙种球蛋白、抗凝、补钾、化痰平喘、保肝、护胃、营养支持等治疗。入院第4天(2023-03-25)支气管肺泡灌洗液宏基因组下一代测序(mNGS)结果回报:耶氏肺孢子菌(序列数40615);巨细胞病毒(CMV)(序列数615);新冠病毒(奥密克戎BA 5.2,序列数19401)。全血CMV-DNA为1.92×104 copies/mL。予复方磺胺甲噁唑(2片,tid,po)联合卡泊芬净(负荷剂量70 mg/维持剂量50 mg,qd,ivgtt)治疗耶氏肺孢子菌感染。
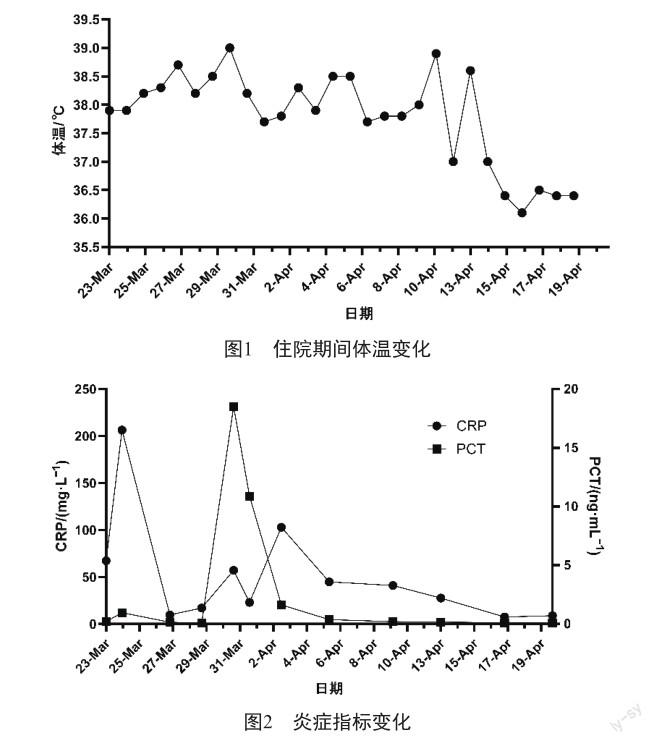
入院第9天(2023-03-30),仍发热Tmax 39 ℃,炎症指标明显下降,测新冠抗原(+),予莫诺拉韦(0.8 g,q12h×5 d)治疗。入院第10天血培养示屎肠球菌(+),CRP、PCT复又升高,胸部CT较前无明显改善。停美罗培南,增加哌拉西林他唑巴坦(4.5 g,q8h,ivgtt)及替考拉宁(负荷剂量0.4 g,q12h/维持剂量0.4 g,qd,ivgtt)。入院第20天(2023-04-10)患者氧合改善明显,胸部CT示病灶较前有吸收,予间歇性脱机训练。入院第21天(2023-04-11)体温又升至38.9 ℃,测新冠抗原(+),继续予莫诺拉韦(0.8 g,q12h×5 d)。同时全血CMV-DNA为3.38×105copies/mL,较前复又升高,遂予更昔洛韦(0.25 g,q12h,ivgtt)抗CMV治疗。经评估可拔除气管插管,予高流量吸氧(40 L/min 35%) 。方案调整后,患者体温较前逐渐下降,且整体情况较入院时明显改善。入院第30天(2023-04-20)患者一般情况可,体温平,复查胸CT示双肺弥漫性肺炎较前吸收。于2023-04-20出院转康复医院治疗。
患者住院期间体温见图1,炎症指标见图2,主要用药见图3,胸部CT见图4。
2 分析討论
2.1 患者淋巴瘤基础疾病,新冠病毒检测持续阳性且伴发热,经多疗程抗病毒治疗后仍未转阴,该如何继续治疗?
患者一般情况差,入院时氧合指数124,可能合并其他感染,已在外院经多轮抗新冠病毒治疗,仍持续阳性,且新冠病毒载量高(序列数19401),新冠病毒感染明确,病毒性肺炎可能。患者有淋巴瘤基础疾病,新冠感染前1月余使用抗CD20单抗奥妥珠单抗,入院时RBC和PLT明显降低,B淋巴细胞为0,CD4降低,为免疫抑制宿主。目前认为B细胞和CD4+ T细胞在病毒清除过程中扮演着重要角色[1]。淋巴恶性肿瘤是新冠病毒持续感染的一大人群,B细胞耗竭是持续感染的关键免疫驱动因素[2]。一项回顾性队列研究(n=422)表明抗CD20治疗后6个月内感染严重新冠病毒的患者预后更差,传染性的持续时间可能会更长,COVID-19的复发率超过15%,并且与病毒复制有关,感染得到控制后,可重新开始抗CD20治疗[3]。对于免疫正常人群,研究表明58%~83%在感染后28 d实现病毒清除,病毒转阴中位时间为7~12 d[1]。对于免疫抑制宿主,新冠感染的病程可能会持续数月[2]。一项回顾性研究(n=2 518)表明持续排毒(超过14 d)与6个月死亡率增加显著相关[4]。
根据《免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023版)》推荐免疫缺陷人群如明确新冠感染,应尽快启动抗病毒治疗,首选奈玛特韦/利托那韦或先诺特韦/利那特韦,RdRp抑制剂也可作为一线药物选用[5]。目前并无新冠病毒持续阳性的抗病毒治疗疗程推荐。《奥密克戎变异株所致重症新型冠状病毒感染临床救治专家推荐意见(2023)》指出对于重症患者,发病>5 d但新冠病毒核酸CT值<30者,应用抗病毒药物仍可能有一定获益[6]。《免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023版)》指出免疫缺陷人群感染病毒后,排毒时间延长,易出现病毒持续阳性,可根据临床情况,评估获益风险比后,适当延长小分子抗病毒药物使用时间,或者换用不同种类抗病毒药物,进行第二个疗程的抗病毒治疗[5]。
综合评估,该患者新冠感染后危险程度为极高风险,故考虑延长抗病毒疗程。目前常用的抗病毒药物中,奈玛特韦/利托那韦的临床研究数据最佳,使用时间也最长,循证相对较多。入院后继续新一疗程奈玛特韦/利托那韦,疗程结束后,患者新冠抗原仍阳性,且体温较前进一步升高,有可能病毒清除不佳,故将抗病毒药物更换为为RdRp抑制剂。氘瑞米德临床研究提示疗效不劣于奈玛特韦/利托那韦,但该药可能引起肝功能异常,考虑患者入院时肝酶稍升高,不作首要考虑。阿兹夫定的循证证据相对较少,也不作首要考虑。莫诺拉韦临床研究和循证证据相对较多,且对肝功能无影响,故换用莫诺拉韦继续治疗,住院期间共使用两疗程,患者整体情况好转,氧合和胸部CT都提示好转,体温下降后转入康复医院。
2.2 患者淋巴瘤化疗后,RBC和PLT明显减少,mNGS回报耶氏肺孢子菌和CMV,是否需要同时启动抗PJP和抗CMV药物治疗?
耶氏肺孢子菌肺炎(Pneumocystis jirovecii pneumonia,PJP)是一种发生于免疫功能受损个体中的感染,可能会危及患者生命[7]。该患者持续发热、气促,有淋巴瘤化疗及抗CD20治疗疾病史,外院长期使用激素治疗,胸部CT示双侧弥漫性炎症伴间质改变,mNGS检测示耶氏肺孢子菌序列数高,考虑患者合并有PJP[8]。甲氧苄啶-磺胺甲噁唑(TMP/SMX)为PJP的首选治疗药物,剂量为TMP 15~20 mg/(kg·d),SMX 75~100 mg/(kg·d),分3~4次口服,当存在TMP/SMX禁忌或出现严重不良反应时可选择替代方案,包括克林霉素联合伯氨喹、阿托伐醌、喷他脒等[9]。近年来一些小样本的临床研究报道了TMP/SMX联合卡泊芬净对PJP也有良好疗效[10-12]。CMV引起的人类疾病多种多样,且主要取决于宿主,免疫功能低下患者的CMV感染会导致严重的发病率和死亡率,尤其在移植和HIV感染者中[13]。CMV肺炎症状无特异性,发热、咳嗽、气促和呼吸困难为主要表现,肺部影像学以磨玻璃样改变和间质性肺炎为主[14],患者血CMV-DNA 1.92×105 copies/mL,同时具备CMV肺炎症状,肺泡灌洗液mNGS检测示CMV(序列数615),考虑合并有CMV肺炎。CMV感染首选更昔洛韦或缬更昔洛韦,骨髓抑制是其十分常见的不良反应,替代药物有膦甲酸,主要用于已知或疑似感染耐药性或难治性CMV的患者,但其电解质紊乱发生率高,贫血也是其常见的不良反应[15]。
患者当前的主要治疗矛盾是红系及巨核系偏低,TMP/SMX及更昔洛韦都有进一步加重骨髓抑制风险,而患者目前炎症指标高,免疫抑制,有感染进展及ARDS进一步加重风险。考虑患者目前病情危重,耶氏肺孢子菌菌量高(序列数40615),控制病情为当下更为主要的目标,PJP备选的药物大多不可及,权衡利弊后,予低剂量TMP/SMX联合卡泊芬净抗PJP,密切监测血常规,由于更昔洛韦骨髓抑制发生率高,目前患者低钾血症,贫血均有,膦甲酸也不宜选用,暂不考虑抗CMV治疗,若抗新冠病毒及PJP治疗后病情仍进展,再结合血CMV-DNA情况及血常规情况决定是否加用更昔洛韦。
经抗PJP治疗14 d后及抗病毒治疗2个疗程后,患者整体情况好转,双肺弥漫性病灶较前吸收,但三系均有所下降,对症治疗后WBC已正常,RBC、PLT均低,较前有所恢复。患者体温仍有反复,查血CMV DNA较前升高,目前患者一般情况好转,反复发热的原因不能排除CMV肺炎,清除CMV病毒和新冠病毒为当前主要矛盾,故增加更昔洛韦抗CMV治疗,密切监测血常规,對症支持治疗,同时继续抗新冠病毒。
3 随访
出院后第4天(2023-04-24)患者复又有低热(Tmax 37.8 ℃),不伴咳嗽、咳痰、胸闷、气急,外院查新冠核酸阳性(CT值不详),肝肾功能正常,予奈玛特韦/利托那韦一疗程治疗后,患者情况基本稳定。
4 总结与体会
对于免疫缺陷宿主,应尽早使用抗病毒药物,同时考虑到病毒清除延迟,可适当延长抗病毒治疗的疗程,以尽快实现病毒清除和症状控制。治疗过程中,遇到治疗矛盾时,需充分分析当下的主要矛盾,权衡利弊,解决主要矛盾,兼顾次要矛盾,当主要矛盾得到缓解时,次要矛盾可能会上升为主要矛盾,需要及时监测及处理。
参考文献
[1] DeWolf S, Laracy JC, Perales MA, et al. SARS-CoV-2 in immunocompromised individuals[J]. Immunity, 2022, 55(10): 1778-1779.
[2] Lee CY, Shah MK, Hoyos D, et al. Prolonged SARS-CoV-2 infection in patients with lymphoid malignancies[J]. Cancer Discov, 2022, 12(1): 62-73.
[3] Calderón-Parra J, Mú?ez-Rubio E, Fernández-Cruz A, et al. Incidence, clinical presentation, relapses and outcome of severe acute respiratory syndrome coronavirus 2 (SARSCoV-2) infection in patients treated with anti-CD20 monoclonal antibodies[J]. Clin Infect Dis, 2022, 74(10): 1786-1794.
[4] Batra A, Clark JR, Kang AK, et al. Persistent viral RNA shedding of SARS-CoV-2 is associated with delirium incidence and six-month mortality in hospitalized COVID-19 patients[J]. GeroScience, 2022, 44(3): 1241-1254.
[5] 廣州医科大学附属第一医院广州呼吸健康研究院, 国家呼吸医学中心, 国家呼吸疾病临床研究中心, 等. 免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023版)[J]. 中华传染病杂志, 2023, 41(6): 367-377.
[6] 中华医学会呼吸病学分会, 中国医师协会呼吸医师分会危重症医学专家组. 奥密克戎变异株所致重症新型冠状病毒感染临床救治专家推荐意见[J]. 中华结核和呼吸杂志, 2023, 46(2): 101-110.
[7] Thomas CF Jr, Limper AH. Pneumocystis pneumonia[J]. N Engl J Med, 2004, 350(24): 2487-2498.
[8] Thomas CF, Limper AH. 非HIV感染者中肺孢子菌肺炎的流行病学、临床表现和诊断[EB/OL]. (2023-10-31)[2023-12-08]. https://www.uptodate.com/contents/zh-Hans/ treatment-and-prevention-of-pneumocystis-pneumonia-inpatients-without-hiv#!.
[9] Maschmeyer G, Helweg-Larsen J, Pagano L, et al. ECIL guidelines for treatment of Pneumocystis jirovecii pneumonia in non-HIV-infected haematology patients[J]. J Antimicrob Chemother, 2016, 71(9): 2405-2413.
[10] Armstrong-James D, Stebbing J, John L, et al. A trial of caspofungin salvage treatment in PCP pneumonia[J]. Thorax, 2011, 66(6): 537-538.
[11] Tu GW, Ju MJ, Xu M, et al. Combination of caspofungin and low-dose trimethoprim/sulfamethoxazole for the treatment of severe Pneumocystis jirovecii pneumonia in renal transplant recipients[J]. Nephrology (Carlton), 2013, 18(11): 736-742.
[12] Utili R, Durante-Mangoni E, Basilico C, et al. Efficacy of caspofungin addition to trimethoprim-sulfamethoxazole treatment for severe pneumocystis pneumonia in solid organ transplant recipients[J]. Transplantation, 2007, 84(6): 685-688.
[13] Friel TJ. Epidemiology, clinical manifestations, and treatment of cytomegalovirus infection in immunocompetent adults[EB/ OL]. (2023-10-30)[2023-12-08]. https://www.uptodate.com/ contents/epidemiology-clinical-manifestations-and-treatmentof-cytomegalovirus-infection-in-immunocompetent-adults.
[14] 中华医学会血液学分会干细胞应用学组. 异基因造血干细胞移植患者巨细胞病毒感染管理中国专家共识(2022年版)[J]. 中华血液学杂志, 2022, 43(8): 617-623.
[15] Santos CA, Vella J, Brennan DC. 肾移植受者中巨细胞病毒病的临床表现、诊断和治疗[EB/OL]. (2023-07-25)[2023-12-12]. https://www.uptodate.com/contents/zh-Hans/ clinical-manifestations-diagnosis-and-management-ofcytomegalovirus-disease-in-kidney-transplant-patients#!.
