miR-30a-5p调控ECM-受体作用信号通路相关蛋白抑制肺腺癌细胞的侵袭和迁移
2023-02-19夏建洪周立庆严研马婷婷苏欣宇
夏建洪 周立庆 严研 马婷婷 苏欣宇
肺腺癌是最常见的肺癌类型。尽管学者在肺腺癌的诊断和治疗策略上已经取得了进展,但肺腺癌的死亡率依然很高。因此,阐明肺腺癌发生、发展的分子机制,寻找早期检测的新方法和新的分子治疗靶点非常必要。微小RNA(microRNA,miRNA)是一种小的、高度保守的非编码RNA分子,是一种有前途的生物标志物,可用于早期癌症的检测和准确的预后,并可作为癌症治疗的靶点[1-2]。miRNA的表达水平与肺腺癌细胞的生物学功能息息相关[3-4]。miR-30家族包括 miR-30a、miR-30b、miR-30c-1、miR-30c-2、miR-30d、miR-30e,这些基因在不同肿瘤中也起着重要的作用[5-7]。作为miR-30家族的一员,miR-30a-5p也被大家广泛研究。尽管miR-30a-5p已经被发现其可以调控乳腺癌[8]、胆囊癌[9]、肝癌[10]、肾细胞癌[11]和口腔癌[12]等肿瘤细胞的发生、发展,但其在肺腺癌细胞中的功能和机制还鲜有研究。本研究通过生物信息学分析、分子实验和细胞功能实验探究miR-30a-5p与细胞外基质(extracellular matrix,ECM)-受体作用信号通路相关蛋白对肺腺癌细胞增殖和侵袭的调节作用,为寻找肺腺癌新的靶向治疗方法提供参考。
1 材料和方法
1.1 材料 肺腺癌细胞系SPC-A1(批号:BNCC100120)、Calu-3(批号:BNCC338514)、HCC827(批号:BNCC342007)、PC14(批号:BNCC341851)以及人正常支气管上皮细胞BEAS-2B(批号:BNCC338205)均购自中国北纳生物科技公司。miR-30a-5p模拟物及其阴性对照(批号:miR10000087-1-5)、miR-30a-5p抑制剂及其阴性对照(批号:miR20000087-1-5)均购自中国锐博生物公司;Trizol试剂(批号:10296010)、PBS(批号:10010072)、免疫沉淀分析裂解缓冲液(批号:FNN0011),BCA试剂盒(批号:23227)、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(批号:B1000B)均购自美国 Thermo Fisher公司;反转录试剂盒M-MLV reverse transcriptase(批号:18057018)、Lipofectamine 2000试剂(批号:11668019)均购自美国Invitrogen公司;7500 real-time PCR system(批号:4351107)购自德国Applied Biosystems公司;含10%FBS的DMEM培养基(批号:PM150210B)购自武汉普诺赛赛生命科技有限公司;TBST溶液(批号:28360)购自中国Solarbio公司;二抗山羊抗兔IgG(1∶2 000,批号:ab205718)、一抗为兔抗纤维连接蛋白(Fibronectin)(1∶1 000,批号:ab32419)、兔抗磷酸化纤维连接蛋白(p-Fibronectin)(1∶1 000,批号:ab3349826)、兔抗 E-钙黏蛋白(E-Cadherin)(1∶500,批号:ab15148)、兔抗磷酸化E-钙黏蛋白(p-ECadherin)(1∶5 000,批号:ab226779),兔抗 β-actin(1∶200,批号:ab115777)均购自英国Abcam公司;EC试剂盒(批号:P0018S)购自中国碧云天生物技术公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(批号:D5879-100 ml)购自美国Sigma公司;分光光度计(型号:N50 Touch)购自德国Implen公司;ECM-受体作用信号通路通道相关蛋白抑制剂(ML327,HY-103038)购自美国Medchemexpress公司。
1.2 方法
1.2.1 细胞培养 将4种肺腺癌细胞及上皮BEAS-2B细胞放在含10%FBS的DMEM培养基中,置于37℃、5%CO2的细胞培养箱中培养。
1.2.2 细胞转染及分组 将Calu-3细胞接种于24孔板(1×105个细胞/孔)中,当细胞融合率达到70%~80%时,根据产品说明书使用Lipofectamine 2000 Reagent将miR-30a-5p模拟物及其阴性对照(设为miR-30a-5p模拟物组、模拟物对照组)、miR-30a-5p抑制剂及其阴性对照(设为miR-30a-5p抑制剂组、抑制剂对照组)转染到细胞内,随后,将细胞放置于37℃、5%CO2的细胞培养箱中培养,转染后48 h收集细胞行进一步分析。在miR-30a-5p抑制剂组的细胞中加入ECM-受体相互作用通路相关蛋白抑制剂,设为miR-30a-5p抑制剂+ECM-受体相互作用抑制剂组。
1.2.3 miR-30a-5p的mRNA水平检测 采用qRTPCR法。使用Trizol试剂从细胞中提取总RNA,并使用反转录试剂盒将miRNA转化为cDNA。然后使用7500 real-time PCR system进行qRT-PCR。以U6为miR-30a-5p的标准化内参,miR-30a-5p上游引物:5'-TACGGATCCCCTTCATCTTACTTTTTTCCCCCAA-3',下游引物:5'-ATCGCTAGCGAAACTAGAAGCTCGGTGATGAATA-3';U6 上 游 引 物 :5'-GGTCGGGCAGGAAAGAGGGC-3';下游引物:5'-GCTAATCTTCTCTGTATCGTTCC-3'。采用 2-ΔΔCt法计算不同处理组细胞中miR-30a-5p相对表达量。
1.2.4 ECM-受体作用信号通路相关蛋白(Fibronectin和E-cadherin)的表达水平及磷酸化水平检测 采用Western blot法。将细胞用冷PBS洗涤3次,加入免疫沉淀分析裂解缓冲液后在冰上裂解10 min,采用BCA试剂盒测定蛋白水平。4℃12 000 r/min离心20 min,提取蛋白。将蛋白进行SDS-PAGE电泳,电泳结束后将蛋白转移至PVDF膜上。用含5%脱脂牛奶的PBS孵育过夜,加入一抗,4℃孵育过夜,一抗孵育结束后,用TBST溶液室温下摇床摇动洗膜3次,5 min/次。结束后加入二抗山羊抗兔IgG进行孵育,同样用TBST溶液洗膜3次,5 min/次。用ECL试剂盒拍照观察蛋白印记,实验重复3次。
1.2.5 细胞增殖能力检测 采用噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]实验。将上述1.2.2部分转染的肺腺癌细胞Calu-3以每孔4 000个细胞的密度接种于96孔板中。分别培养0、24、48、72 h后,每孔中添加20 μl MTT溶液(0.5 mg/ml),在37℃下孵育4 h,丢弃上层液,加入200 μl DMSO溶解细胞。在490 nm波长处用分光光度计测量吸光度值。
1.2.6 细胞迁移能力检测 采用细胞划痕愈合实验。将细胞培养于6孔板中,密度为每孔2×105个。当细胞达到80%的融合度时,用100 μl无菌移液管轻轻刮擦穿过孔中心的单层。细胞用PBS洗涤后,在含有2%FBS的DMEM中孵育24 h,用显微镜观察细胞迁移情况并拍照。
1.2.7 细胞侵袭能力检测 采用Transwell侵袭实验。Transwell过滤器的上表面涂有Matrigel。取上述1.2.2部分转染后的肺腺癌细胞Calu-3进行细胞培养,当细胞处于对数生长期(即融合度达到70%-80%时),将细胞添加于Transwell的上室,下室加入200 μl含有10%FBS的DMEM培养基。37℃孵育24 h后,轻轻取出滤膜和培养基,用棉签刮除过滤器上表面未被侵入的细胞,然后用4%甲醛溶液固定膜下细胞20 min,细胞用0.1%结晶紫染色,在光学显微镜下观察入侵细胞并拍照。
1.2.8 生物信息学方法 通过癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)下载表达量数据,利用“edgeR包”进行标准化分析,以miR-30a-5p表达量中位数进行分组,利用基因集富集分析(gene set enrichment analysis,GSEA)软 件(http://software.broadinstitute.org/gsea/index.jsp)对miR-30a-5p进行通路富集分析。
1.3 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌细胞系和人正常支气管上皮细胞中miR-30a-5p表达水平比较 与人正常支气管上皮细胞BEAS-2B比较,肺腺癌细胞系SPC-A1、Calu-3、HCC827、PC14中miR-30a-5p表达水平均下调(均P<0.05),其中Calu-3细胞系miR-30a-5p表达水平相对较低,故采用Calu-3细胞系进行后续的功能实验,见图1。
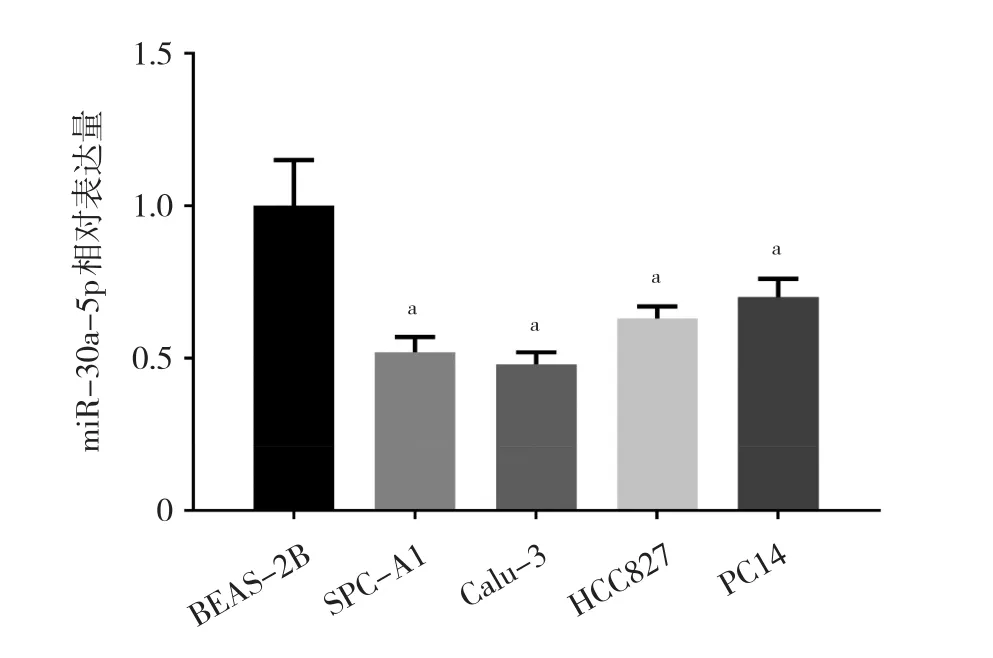
图1 肺腺癌细胞系和人正常支气管上皮细胞中miR-30a-5p表达水平比较
2.2 miR-30a-5p模拟物对Calu-3细胞增殖、迁移和侵袭的影响 miR-30a-5p模拟物组Calu-3细胞中miR-30a-5p表达水平高于模拟物对照组(P<0.05),见图2A。培养0、24、48和72 h后,miR-30a-5p模拟物组Calu-3细胞的增殖能力低于模拟物对照组(均P<0.05),见图2B。miR-30a-5p模拟物组Calu-3细胞的迁移能力低于模拟物对照组(P<0.05),见图2C。miR-30a-5p模拟物组Calu-3细胞的侵袭能力也低于模拟物对照组(P<0.05),见图2D。这些结果显示上调miR-30a-5p可以抑制肺腺癌细胞增殖、迁移和侵袭。

图2 miR-30a-5p 模拟物对Calu-3 细胞增殖、迁移和侵袭的影响(A:miR-30a-5p 模拟物组和模拟物对照组Calu-3 细胞中miR-30a-5p 的表达水平比较;B:miR-30a-5p 模拟物组和模拟物对照组Calu-3 细胞的增殖水平比较;C:miR-30a-5p 模拟物组和模拟物 对照组Calu-3 细胞的迁移变化比较,×40;D:miR-30a-5p 模拟物组和模拟物对照组Calu-3 细胞的侵袭能力比较,0.1%结晶紫染 色,×100)
2.3 miR-30a-5p通过调控ECM-受体作用信号通路相关蛋白抑制Calu-3细胞的侵袭和迁移 GSEA通路富集分析结果显示,在Calu-3细胞中,miR-30a-5p显著富集在ECM-受体作用信号通路上,见图3A。与抑制剂对照组相比,miR-30a-5p抑制剂组中Fibronectin和E-cadherin的磷酸化水平均上调(均P<0.05),miR-30a-5p抑制剂+ECM-受体相互作用抑制剂组Fibronectin和E-cadherin的磷酸化水平得到恢复,见图3B。与抑制剂对照组相比,miR-30a-5p抑制剂组Calu-3细胞的增殖能力提高(P<0.05),miR-30a-5p抑制剂+ECM-受体相互作用抑制剂组Calu-3细胞的增殖能力得到恢复,见图3C。还发现,与抑制剂对照组相比,miR-30a-5p抑制剂组Calu-3细胞的迁移能力上调(P<0.05),miR-30a-5p抑制剂+ECM-受体相互作用抑制剂组Calu-3细胞的迁移能力得到恢复,见图3D。同样,与抑制剂对照组相比,miR-30a-5p抑制剂组Calu-3细胞的侵袭能力上调(P<0.05),miR-30a-5p抑制剂+ECM-受体相互作用抑制剂组Calu-3细胞的侵袭能力得到恢复,见图3E。这些结果表明miR-30a-5p是通过调控ECM-受体作用信号通路相关蛋白的磷酸化水平抑制肺Calu-3细胞的增殖、迁移和侵袭。
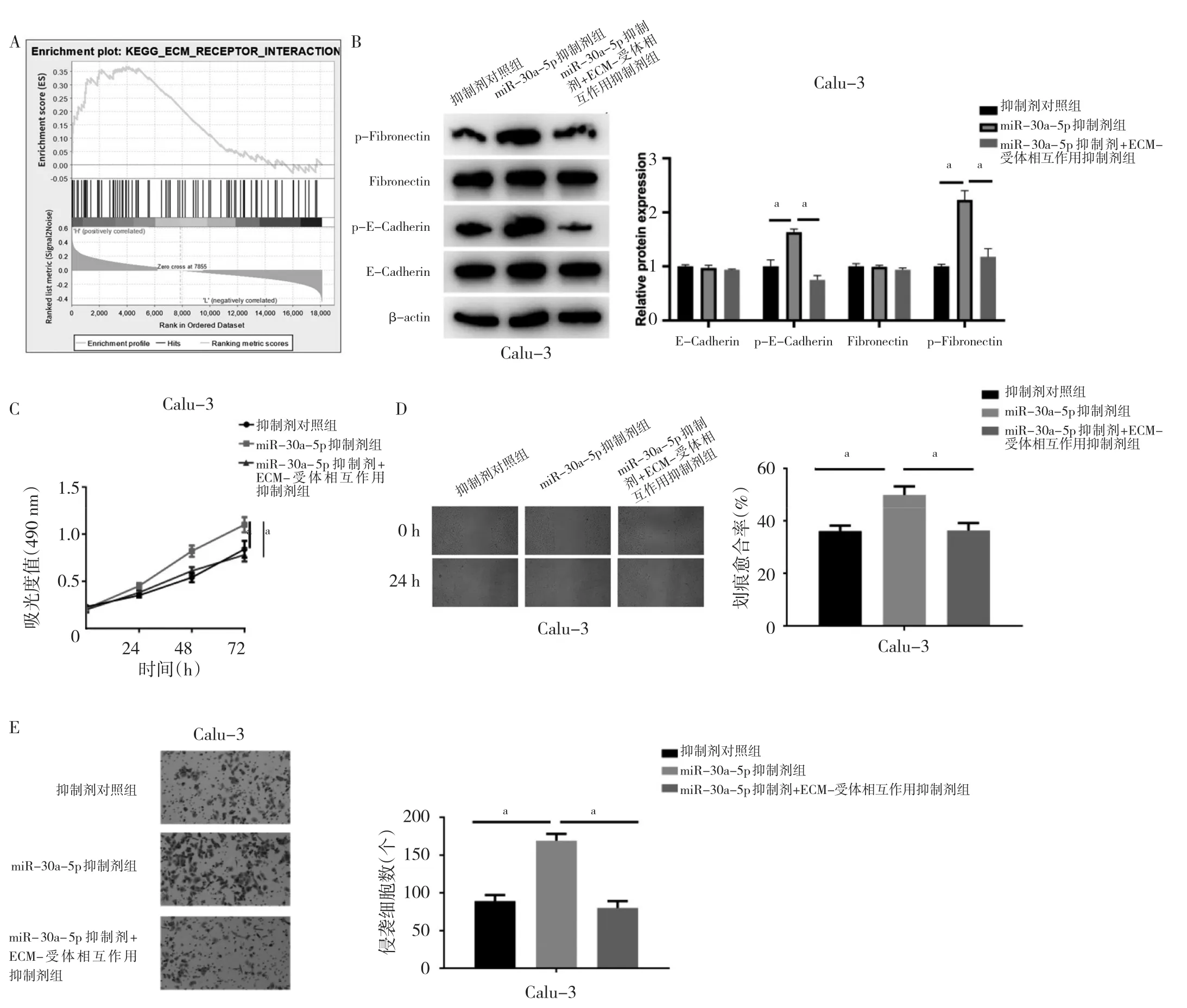
图3 miR-30a-5p通过调控ECM-受体作用信号通路相关蛋白抑制Calu-3细胞的增殖、迁移和侵袭(A:miR-30a-5p的GSEA富集通路;B:各处理组细胞ECM-受体作用信号通路相关蛋白磷酸化水平及蛋白表达水平比较;C:各处理细胞组处理后的增殖水平比较;D:各处理组细胞处理后的迁移能力比较,×40;E:各处理组细胞处理后的侵袭能力比较,0.1%结晶紫染色,×100)
3 讨论
肺腺癌是最常见的肺癌类型,严重危害着人类的生存。虽然肺腺癌的治疗已经取得了相当大的进展,包括手术切除、化疗、放疗或这些方法的结合,但患者的5年生存率仍然处于较低水平[13]。研究证明,miRNA作为致癌或抑癌基因调控肿瘤细胞的生物学功能,包括细胞分化、侵袭、增殖、凋亡等功能[14-15]。作为miR-30a家族中的一员,miR-30a-5p已经被证实与肿瘤的生长有着必要的关系[16-18]。本研究证实miR-30a-5p在肺腺癌细胞中低表达,而后的功能实验也证明了在肺腺癌细胞中过表达miR-30a-5p明显抑制了细胞的增殖、迁移和侵袭,因此miR-30a-5p在肺腺癌细胞中很可能是一个抑癌因子,这与先前许多的研究相一致。例如,miR-30a-5p能够通过阻断F-盒蛋白45(F-box protein 45,FBXO45)的表达抑制肺鳞状细胞癌增殖[19];还能够通过靶向核苷酸 2(nucleobindin 2,NUCB2)来抑制鼻咽癌的进展[20]。
ECM-受体相作用信号通路是细胞内重要信号转导通路之一,其在肿瘤的脱落、黏附、降解、运动和增生过程中都起着重要的作用[21]。Yan等[22]发现ECM参与了胃癌肿瘤细胞的侵袭过程。姜黄素能够通过抑制致癌转录因子 AP-2 α(transcription factor AP-2 alpha,TFAP2A)介导的ECM途径抑制LGR5(+)结肠直肠癌细胞的增殖[23]。同样的,本研究对miR-30a-5p的GSEA通路富集结果显示miR-30a-5p明显富集在ECM-受体作用信号通路上。因此,本研究通过Western blot法检测了ECM-受体作用信号通路相关蛋白磷酸化水平,实验证明在肺腺癌细胞中下调miR-30a-5p显著促进了ECM-受体作用信号通路相关蛋白的磷酸化水平。最后的功能实验发现miR-30a-5p通过调控ECM-受体作用信号通路促进肺腺癌细胞的增殖、迁移和侵袭。
综上所述,本研究表明miR-30a-5p在肺腺癌细胞中显著下调,miR-30a-5p对肺腺癌细胞有负调节作用,过表达miR-30a-5p能抑制肺腺癌细胞的生物学功能。而且miR-30a-5p对肺腺癌细胞的影响有部分是通过调控ECM-受体作用信号通路相关蛋白达到的。本研究结果有助于深入了解miR-30a-5p在肺腺癌中的作用,miR-30a-5p也有望成为肺腺癌早期诊断和临床治疗的分子靶向。
