荜茇酰胺抑制破骨细胞分化的机制研究
2023-02-19黄微星万玲君黄幻王威雷新环袁赤亭章礼炜
黄微星 万玲君 黄幻 王威 雷新环 袁赤亭 章礼炜
骨骼作为人体运动系统的重要器官,在体内发挥着保护、代谢、支持、运动、造血等功能。在正常机体的骨代谢中,成骨细胞所介导的骨形成作用与破骨细胞所介导的骨吸收作用至关重要,使骨量维持在动态平衡的状态[1]。起源于骨髓单核巨噬细胞的破骨细胞,是体内唯一具有骨吸收功能的终末分化细胞。绝经后的女性,由于体内缺乏雌激素,使得破骨细胞数目增加及功能异常,骨吸收速度提高,出现明显的骨量丢失现象,导致骨质疏松[2]。此外,破骨细胞分化异常活跃在肿瘤骨转移、类风湿性关节、关节置换假体周围骨溶解等疾病的发生过程中发挥着重要作用[3]。由此可见,抑制破骨细胞分化是防治骨量丢失疾病的重要靶点之一。荜茇酰胺提取自胡椒科胡椒属植物荜茇,是一种天然生物碱,具有抗肿瘤、抗血小板凝集、抗炎、降血脂、保护神经等作用,但是其在骨代谢领域的功能尚未揭示[4-5]。本研究旨在通过体外实验探讨荜茇酰胺对破骨细胞分化的影响及其潜在机制。
1 材料和方法
1.1 实验动物 6~8周龄SPF级C57BL/6小鼠10只,体质量16~20 g,购自上海杰思捷实验动物有限公司[SCXK(沪)2018-0004],饲养于浙江大学台州医院公共科研平台SPF动物房[SYXK(浙)2019-0030]。小鼠在室温20~25℃,湿度40%~60%,24 h自然光暗循环条件下饲养,不限制饮水及进食,相关饲养及操作经浙江大学台州医院动物伦理委员会审批(tzyy-2019033)。
1.2 试剂和仪器 荜茇酰胺粉末(批号:HY-N2329)购自美国MedChemExpress公司,高速离心后使用二甲基亚砜(批号:ST038,上海碧云天生物技术有限公司)溶解制成100 mmol/L母液,分装后置于-80℃冰箱保存。巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)(批号:315-02)购自美国Peprotech公司;NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)(批号:P00226)、总 RNA 提取试剂(批号:R1100)均购自北京索莱宝科技有限公司;α-改良型MEM培养基(批号:SH30265.01)购自美国Hyclone公司;澳洲特级FBS(批号:10099-141)购自美国Gibco公司;CCK-8试剂盒(批号:K1018)购自美国APExBIO公司;cDNA第一链合成试剂盒(批号:R123-01)、SYBR Green荧光实时定量PCR试剂盒(批号:Q121-02)均购自南京诺唯赞生物科技股份有限公司。PBS(批号:C0221)、胰酶细胞消化液(批号:C0201)、青霉素-链霉素双抗溶液(批号:C0222)均购自上海碧云天生物技术有限公司;24孔Osteo Assay Surface骨细胞表面培养板(批号:3987)购自美国Corning公司;破骨细胞特征性标志酶抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(批号:BZ-OC02)购自苏州必中生物科技有限公司。Multiskan SkyHigh全波长酶标仪购自美国Thermo Fisher公司,ABI 7500实时荧光定量PCR仪购自美国Applied Biosystems公司,DM IL LED倒置实验室显微镜购自德国Leica公司。
1.3 方法
1.3.1 小鼠骨髓来源单核巨噬细胞(bone marrow-derived monocytes/macrophages,BMMs)提取与培养 解剖小鼠,收集小鼠胫腓骨置于无菌PBS中,剔净肌肉、生长板及黏附其上的韧带等结缔组织,3次无菌PBS漂洗后,于股骨近端、胫骨远端暴露骨髓腔,使用1 ml针筒抽取PBS反复冲洗骨髓腔。将分离的骨髓使用含10%血清的α-改良型MEM培养基重悬后1 500 r/min离心4 min,倒掉上清液后使用含30 ng/ml M-CSF的完全培养基重悬,接种于10 cm细胞培养皿中,过夜。第2天去除细胞培养皿中的培养液,并用无菌PBS冲洗3次,加入适量含30 ng/ml M-CSF的完全培养基,将仍贴壁的细胞继续培养2 d细胞呈短梭形,密度80%~90%。随后去除培养液并使用PBS冲洗3次,胰酶消化,计数后备用,即为BMMs。后续BMMs培养均使用含30 ng/ml M-CSF的完全培养基,进行破骨分化诱导时采用含50 ng/ml RANKL、30 ng/ml M-CSF的完全培养基。
1.3.2 BMMs增殖活性检测 采用CCK-8法。将BMMs按0.4×104细胞/孔的密度接种于96孔板内,设置1 个 对照组和9个浓度(0.25、0.5、1、2、5、10、25、50、100 μmol/L)荜茇酰胺干预组,共10组,每组3个复孔。待细胞过夜贴壁后,将孔内液体更换为含对应药物的完全培养基进一步培养,隔天换液1次。分别培养48、72、96 h后,向每孔中加入10 μl CCK-8试剂,于细胞培养箱中继续培养2 h后,使用酶标仪测定各孔450 nm波长处吸光度(OD450)值。
1.3.3 BMMs破骨分化诱导 将BMMs分别按10×104、40×104细胞/孔的密度接种于24、6孔板内。过夜贴壁后,使用破骨诱导分化完全培养基(完全培养基+50 ng/ml RANKL+30 ng/ml M-CSF)进行破骨分化诱导,隔天换液。第4天显微镜下见BMMs开始汇聚、融合,出现3个细胞核以上的细胞,第6天见边界清晰、巨大、煎饼样的成熟破骨细胞。
1.3.4 BMMs破骨分化能力检测 采用TRAP染色。吸去成熟破骨细胞24孔板中各个培养孔中的培养基,PBS冲洗1遍后加入500 μl 4%多聚甲醛固定细胞10 min,随后PBS冲洗2遍,按照试剂盒说明书进行TRAP染色。倒置显微镜下观察并拍照,TRAP阳性且细胞核数目≥3个的细胞计为破骨细胞,并通过Image J软件进行破骨细胞相对大小的计算,破骨细胞相对大小=各组破骨细胞大小/溶剂对照组中破骨细胞大小的平均值。
1.3.5 破骨细胞骨吸收能力检测 采用24孔Osteo Assay Surface骨细胞表面培养板。将BMMs按10×104细胞/孔的密度接种于24孔板中,细胞过夜贴壁后将培养基更换为破骨诱导分化完全培养基,进行破骨诱导,隔天换液。3 d后倒置显微镜下见BMMs开始融合成较小的、不成熟的破骨细胞,随后去除培养液并使用PBS冲洗3次,胰酶消化并重新进行细胞计数。随后,将消化后的未成熟破骨细胞按10×104细胞/孔的密度接种于Osteo Assay Surface骨细胞表面培养板中,共9孔,分为对照组和0.5、1 μmol/L荜茇酰胺干预组,加入含对应药物的破骨诱导分化完全培养基继续培养2 d。最后使用5%次氯酸钠清洗孔板,去除黏附的细胞,并用双蒸水清洗2次。倒置显微镜下观察骨板的骨吸收情况并拍照,通过Image J软件进行骨吸收相对面积的计算,相对骨吸收面积=结晶涂层吸收区域面积/同一视野下的总面积。
1.3.6 BMMs破骨分化过程中核心转录因子活化T-细胞核因子1(nuclear factor of activated T cells c1,NFATc1)及相关特征基因耐酒石酸酸性磷酸酶(acid phosphatase 5,tartrate resistant,ACP5)、破骨细胞相关受体(osteoclast associated receptor,OSCAR)、组织蛋白酶K(cathepsin K,CTSK)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)mRNA表达水平检测 采用qRTPCR法。将BMMs按40×104细胞/孔的密度接种于6孔板中,过夜贴壁后,将培养基更换为含对应药物的破骨诱导分化完全培养基,进行破骨诱导,隔天换液。6 d后吸去各个培养孔中的培养基,用预冷的PBS冲洗1次后每孔加入500 μl总RNA提取试剂,置于冰上按说明书提取细胞总RNA。RNA样品使用RNA/DNA紫外可见光度法定量测定浓度,然后使用cDNA第一链合成试剂盒逆转录合成cDNA(1 μg RNA,使用20 μl逆转录体系,反应结束后使用双蒸水稀释至100 μl备用)。后续qPCR所用引物序列如下:NFATc1上游:5'-CAACGCCCTGACCACCGATAG-3',下游:5'-GGCTGCCTTCCGTCTCATAGT-3';ACP5上游:5'-TGTGGCCATCTTTATGCT-3',下游:5'-GTCATTTCTTTGGGGCTT-3';OSCAR 上游:5'-CTGCTGGTAACGGATCAGCTCCCCAGA-3',下游:5'-CCAAGGAGCCAGAACCTTCGAAACT-3';CTSK上游:5'-ACGGAGGCATTGACTCTGAAGATG-3',下游:5'-GGAAGCACCAACGAGAGGAGAAAT-3';MMP-9上游:5'-GTCCAGACCAAGGGTACAGC-3',下游:5'-ATACAGCGGGTACATGAGCG-3';18S核糖体RNA(18S ribosomal RNA,Rn18s)上游:5'-CGGCTACCACATCCAAGGAA-3',下游:5'-GCTGGAATTACCGCGGCT-3'。所使用的qPCR反应体系为 20 μl(SYBR Green 10 μl,cDNA 2 μl,前后链引物mix 0.5 μl,ddH2O 7.5 μl),反应条件为95 ℃ 5 min预变性,随后95℃10 s变性,65℃30 s扩增共循环40次。分析结果时,以Rn18s为内参,使用2-ΔΔCt法计算各个基因转录水平的相对表达量。
1.4 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 荜茇酰胺对BMMs增殖的影响 在荜茇酰胺处理BMMs 48 h后,10 μmol/L荜茇酰胺干预组OD450值由对照组的0.78±0.01降低至0.62±0.02(P<0.01);72 h后,5 μmol/L荜茇酰胺干预组OD450值由对照组的1.30±0.02降低至 1.04±0.04(P<0.01);96 h后,5 μmol/L荜茇酰胺干预组OD450值由对照组的1.84±0.04降低至 1.42±0.06(P<0.01),见图1。CCK-8实验提示,2 μmol/L及以下浓度的荜茇酰胺对BMMs增殖无明显毒性反应。

图1 荜茇酰胺对BMMs增殖的影响(A:不同浓度荜茇酰胺处理48 h后对BMMs增殖的影响;B:不同浓度荜茇酰胺处理72 h后对BMMs增殖的影响;C:不同浓度荜茇酰胺处理96 h后对BMMs增殖的影响)
2.2 荜茇酰胺对破骨细胞分化的影响 对照组、0.5 μmol/L荜茇酰胺干预组、1 μmol/L荜茇酰胺干预组、2 μmol/L荜茇酰胺干预组经过6 d培养后,各组孔内细胞经固定、TRAP染色,倒置显微镜下观察可见对照组中出现大量多核、肥大、煎饼样的成熟破骨细胞,而在0.5 μmol/L荜茇酰胺处理下,成熟破骨细胞数目显著下降。与此同时,1 μmol/L荜茇酰胺干预组、2 μmol/L荜茇酰胺干预组中几乎只有极少量破骨细胞生成,见图2(插页)。进一步统计分析显示,0.5 μmol/L荜茇酰胺干预组中TRAP阳性且细胞核数目≥3个的破骨细胞数目由对照组的(216.30±13.20)个降低至(79.00±8.72)个(P<0.01),而1 μmol/L荜茇酰胺干预组与2 μmol/L荜茇酰胺干预组比较差异无统计学意义[(30.67±3.79)个比(27.00±2.65)个,P>0.05]。与此同时,0.5 μmol/L荜茇酰胺干预组中破骨细胞相对大小由对照组的1.00±0.04降低至0.32±0.04(P<0.01),见图3。

图2 荜茇酰胺对BMMs破骨分化的影响

图3 荜茇酰胺对BMMs破骨分化过程中细胞数目及相对大小的影响(A:荜茇酰胺对成熟破骨细胞数目的影响;B:荜茇酰胺对破骨细胞相对大小的影响)
2.3 荜茇酰胺对破骨细胞骨吸收能力的影响 对照组、0.5 μmol/L荜茇酰胺干预组、1 μmol/L荜茇酰胺干预组分别在Osteo Assay Surface骨细胞表面培养板上进行骨吸收实验后,对照组中可见大量破骨细胞进行骨吸收后形成透亮的骨吸收陷窝,而在0.5 μmol/L荜茇酰胺处理下骨吸收数目明显减少,而在1 μmol/L荜茇酰胺干预组中几乎仅有少量的骨吸收陷窝生成,见图4(插页)。进一步统计分析显示,与对照组的1.00±0.12比较,0.5 μmol/L荜茇酰胺干预组中相对骨吸收面积降低至0.20±0.03(P<0.01),而在1 μmol/L荜茇酰胺干预组中仅为0.04±0.01(P<0.01),见图5。2.4 荜茇酰胺对BMMs破骨分化过程中核心转录因子及特征基因mRNA表达水平的影响 在荜茇酰胺处理后,与对照组比较,0.5 μmol/L荜茇酰胺干预组和1 μmol/L荜茇酰胺干预组破骨分化核心转录因子NFATc1和特征基因 ACP5、OSCAR、CTSK、MMP-9 mRNA表达水平均下调(均P<0.01),见图6。

图4 荜茇酰胺对破骨细胞骨吸收能力的影响
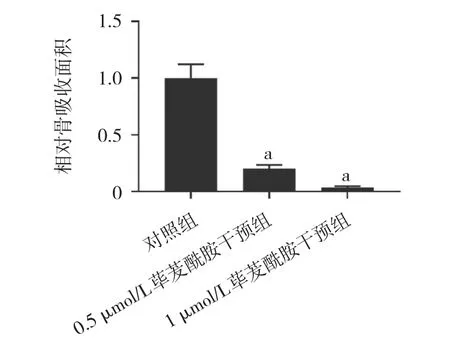
图5 荜茇酰胺对破骨细胞骨相对骨吸收面积的影响

图6 荜茇酰胺对BMMs破骨分化过程中核心转录因子及特征基因mRNA表达水平的影响
3 讨论
目前骨质疏松症的预防主要为调整生活方式、补充钙剂和维生素D,其治疗主要集中在抑制破骨细胞介导的骨吸收和(或)促进成骨细胞介导的骨形成。双膦酸盐、降钙素、雌激素受体调节剂(雷洛昔芬)、雌激素治疗、甲状旁腺素类似物(特立帕肽)及RANKL单抗(狄诺塞麦)等抗骨质疏松药物均有不同的适应证、用法、用量、不良反应,且部分药物价格较高而难以被广泛应用[6-7]。破骨细胞主要来自于血系单核/巨噬细胞系统,其作为体内唯一具有骨吸收作用的终末分化细胞,在骨发育、骨塑性、骨折修复、骨稳态中均发挥着至关重要的作用。破骨前体细胞在M-CSF、RANKL刺激下,MAPKs(p38、Erk1/2、JNK)、NF-κB、Akt/Src、PLCγ/Ca2+等大量信号通路激活,共同促进下游转录因子NFATc1的活化,这一过程在破骨细胞分化、成熟中发挥着重要作用[8]。破骨细胞的过度激活及伴随骨吸收功能的过度活化是骨质疏松、假体周围骨溶解、肿瘤骨破坏、废用性骨丢失等疾病发生、发展过程中的核心致病机制[9]。临床上目前广泛应用的抗骨质疏松药物中,以狄诺塞麦为代表的RANKL单抗可直接靶向抑制RANKL与破骨前体细胞胞膜上NF-κB受体活化因子(receptor activator of NF-κB,RANK)结合,双膦酸盐(如阿仑膦酸、唑来膦酸等)可通过骨表面的羟基磷灰石结合进而被破骨细胞吸收,发挥抑制其骨吸收活性并促进破骨细胞凋亡的作用[10]。除此以外,大量小分子化合物可直接作用于RANKL/RANK下游信号通路的活化,发挥抑制破骨细胞分化、减少其骨吸收功能,进而缓解骨量丢失[11]。
本研究所聚焦的药物单体荜茇酰胺具有抗肿瘤、抗炎、抗氧化和降血脂等药理作用[4]。其中,荜茇酰胺可通过上调过氧化物酶 4(peroxiredoxin 4,PRDX4)的表达促进胞内活性氧(reactive oxygen species,ROS)的累积,引起胶质瘤细胞凋亡[12]。荜茇酰胺也可通过增加肿瘤细胞内ROS水平,激活下游抑癌基因p53和半胱氨酸天冬氨酸蛋白酶(cysteine aspartic protease,Caspase)依赖性途径,抑制人胃癌MKN45细胞增殖并促进其细胞凋亡[13]。在荜茇酰胺处理下,三阴性乳腺癌细胞系MDA-MB-231迁移和侵袭能力降低,与上皮-间充质细胞转化密切相关的MMP-2和MMP-9表达降低,并且可抑制转化生长因子β诱导的转录因子ZEB1和SNAI2表达[14]。本研究显示2 μmol/L及以下浓度的荜茇酰胺对BMMs增殖无明显抑制作用,并且TRAP染色提示在1 μmol/L荜茇酰胺干预下几乎无成熟破骨细胞分化,骨吸收能力检测表明在1 μmol/L荜茇酰胺干预下破骨细胞骨吸收能力显著减弱。在机制探索层面上,本研究揭示了荜茇酰胺可浓度依赖性地抑制RANKL刺激下BMMs破骨分化过程中核心转录因子NFATc1在mRNA水平的表达,从而降低下游破骨相关特征基因ACP5、OSCAR、CTSK、MMP-9的转录,达到抑制破骨分化的作用。BMMs作为破骨细胞的前体细胞,可在体外50 ng/ml RANKL、30 ng/ml MCSF等诱导因子的作用下分化成为成熟破骨细胞。其中RANKL作为破骨细胞功能维持的重要细胞因子,发挥着促进破骨细胞分化成熟、抑制其凋亡、增加其骨吸收活性等功能。目前研究已揭示在RANKL刺激下,BMMs细胞内MAPKs、NF-κB、PI3K/Akt等信号通路出现明显激活,可导致共同的下游核心转录因子NFATc1的扩增,并入核促进相关破骨细胞特征蛋白的转录表达,最终促进破骨细胞分化成熟[15]。近年研究表明,破骨细胞对骨基质的吸收过程主要由无机成分的溶解和骨基质有机成分的消化所组成。首先,黏附于骨表面的破骨细胞将氢离子泵入亚破骨细胞室从而创造一个酸性微环境,增加骨矿物质的溶解度,导致骨矿物质释放并重新进入破骨细胞的细胞质。在去除矿物质后,胶原酶和明胶酶被分泌到亚破骨细胞隔室中,进一步消化和降解脱钙骨基质的胶原蛋白和其他有机成分,降解产物最终也被破骨细胞所吞噬[16]。
综上所述,抑制破骨细胞的分化成熟及骨吸收功能对机体病理过程中骨量丢失的防治意义重大,本研究揭示了荜茇酰胺对该过程的抑制作用。荜茇酰胺的应用,可起到防治破骨细胞分化过度或功能活跃所导致的骨质疏松、假体周围骨溶解、肿瘤骨破坏等骨量丢失疾病,但尚需更进一步的机制研究及动物体内实验结果论证。
