血清白介素-10、胸苷激酶1在急性淋巴细胞白血病患儿中的表达及与危险度分层的相关性
2022-11-03宋春艳林云碧雷庆龄吕瑜肖祖刚
宋春艳 林云碧 雷庆龄 吕瑜 肖祖刚
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种恶性克隆性疾病,该疾病的发病机制复杂,临床多认为与基因改变、遗传因素等密切相关[1]。目前,临床对于ALL的治疗手段较多,包括化疗、造血干细胞移植及免疫治疗等,但ALL仍具有一定的复发及病死风险[2]。研究指出,临床依据ALL患儿病情、治疗反应等情况,可将患儿分为低危、中危和高危3种危险度分层,在治疗前进行充分的危险度分层,对于选择合理的治疗路径尤为重要[3]。因此,积极探讨分析与ALL患儿危险度分层相关的指标,有利于准确判断患儿病情,并为后续治疗提供新思路,更有助于后续治疗方案的优化。相关研究指出,细胞免疫功能在ALL的发生、发展过程中发挥关键性作用[4]。血清白介素(Interleukin,IL)-10是一种多细胞源、多功能的细胞因子,可参与调节细胞的生长与分化、炎性反应和免疫反应等病理生理过程,在急性白血病患者中存在明显异常[5]。另有研究指出,骨髓异常增殖与ALL发病有关[6]。胸苷激酶1(thymidine kinase 1,TK1)是一种在分裂的细胞内表达的激酶,可参与催化胸苷磷酸化补救途径,是细胞增殖的标志物,主要用于检测体内细胞异常增殖速度[7]。因此,结合IL-10、TK1与免疫功能、细胞增殖的关系,推测IL-10、TK1在ALL患儿中存在异常表达,且与患儿危险度分层存在一定的关系。基于此,本研究重点分析血清IL-10、TK1在ALL患儿中的表达及其与患儿危险度分层的相关性,为病情评估提供依据,并为后续ALL治疗提供新的靶点。
资料与方法
1样本量计算 参照下列样本量公式估算样本量:,其中n代表总样本量,P代表总体比例的估计值,δ代表总体比例估计值的容许误差;经查阅文献获取估计值,ALL发病率为0.35%,检验方式为双侧检验,α(检验水准)为0.05,μα取1.96,容许误差为1.5%,得出最小样本量为60例,以失访率为20%计算,则最少需要71例样本,故本研究共纳入100例患儿进行研究。
2一般资料 研究实施已获得医院伦理委员会的批准同意。选取2018年5月~2021年5月医院收治的100例ALL患儿作为研究对象,全部患儿家属对研究内容知情,且签署同意书。纳入标准:(1)ALL符合《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[8]中相关诊断标准,且经骨髓象、血液检查等确诊;(2)年龄≤16岁;(3)新发ALL。排除标准:(1)伴有心、肝、肾等脏器功能不全;(2)伴有先天性心脏病;(3)既往有放疗、化疗和生物学治疗史;(4)合并其他恶性肿瘤;(5)继发性免疫缺陷病;(6)伴有唐氏综合征;(7)合并其他血液系统疾病和自身免疫性疾病的患儿;(8)伴有视力、听力等障碍;(9)预计生存期≤3个月;(10)伴有神志不清或精神障碍患儿;(11)成熟B细胞型ALL。100例患儿中男60例,女40例;年龄1~12岁,平均年龄(5.81±0.46)岁;身高67~161 cm,平均身高(112.51±8.79)cm;体重6~56 kg,平均体重(31.06±3.51)kg。
3方法
3.1治疗方法:参照《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》中相关内容,全部患儿在确诊后均接受VDLP(B-ALL)或VDLD(T-ALL)治疗方案,VDLP方案内容包括长春新碱[静脉注射,1.5 mg/(m2·d),d8,d15,d22,d29]、柔红霉素[静脉滴注,30 mg/(m2·d),LR:d8,d15,IR和HR:d8,d15,d22,d29]、培门冬酶,肌注,2 500 IU/(m2·d),d9、d23共2次;泼尼松,口服,60 mg/(m2·d),d1~d28]治疗。VDLD方案包括长春新碱[静脉注射,1.5 mg/(m2·d),d8,d15,d22,d29]、柔红霉素[静脉滴注,30 mg/(m2·d),LR:d8,d15,IR和HR:d8,d15,d22,d29]、培门冬酶,肌注,2 500 IU/(m2·d),d9、d23共2次;泼尼松,口服,60 mg/(m2·d),d1~d7和地塞米松6 mg/(m2·d),d8~d28,口服,d29起用药量每2天减半,1周内减停]治疗。低度、中度和高度危险:鞘注甲氨蝶呤d1,三联鞘注d15,d33。
3.2ALL患儿的危险度分层判定及分组方法:参照《国家临床路径》[9]中相关内容,将全部患儿分为标危组、中危组和高危组。判定标准:标危组必须同时满足以下所有条件:(1)年龄≥1岁且<10岁;(2)白细胞计数(white blood cell,WBC)<50×109/L;(3)非急性T淋巴细胞白血病;(4)非成熟B细胞型ALL;(5)无t(9;22)或BCR/ABL融合基因;无t(4;11)或MLL/AF4融合基因;无t(1;19)或E2A/PBX1融合基因;(6)治疗第15天骨髓呈M1(原幼淋细胞<5%)或M2(原幼淋细胞5%~25%),第33天骨髓完全缓解。中危必须同时满足以下4个条件:(1)无t(9;22)或BCR/ABL融合基因;(2)中枢白血病或和睾丸白血病;(3)标危诱导缓解治疗第15天骨髓呈M3(原幼淋细胞>25%)或中危诱导缓解治疗第15天骨髓呈M1/M2;(4)如有条件进行微小残留病检测,则第33天危险残留病<10-2。同时至少符合以下条件之一:(1)WBC≥50×109/L;(2)年龄≥10岁;(3)急性T淋巴细胞白血病;(4)t(1;19)或E2A/PBX1融合基因阳性;(5)年龄<1岁且无MLL基因重排。高危必须满足下列条件之一:(1)t(9;22)或BCR/ABL融合基因阳性;(2)t(4;11)或MLL/AF4融合基因阳性;(3)中危诱导缓解治疗第15天骨髓呈M3;(4)第33天骨髓形态学未缓解(>5%),呈M2/M3;(5)如有条件进行微小残留病检测,则第33天危险残留病≥10-2,或第12周危险残留病≥10-3。
3.3基线资料调查方法:由研究人员设计一般资料调查问卷,询问患儿家属,记录相关内容:(1)性别;(2)年龄;(3)身高、体重(可从病案室调取患儿身高、体重)。
3.4实验室指标检测方法:全部患儿均于初诊当天采集静脉血8 mL,分为4支试管。(1)血常规:取1支试管标本,使用日本希森美康XS-800i血细胞分析仪测定血红蛋白(hemoglobin,Hb)、WBC、红细胞计数(red blood cell count,RBC)及血小板(blood platelet,PLT)。(2)IL-10:取1支试管标本,经离心机进行离心处理(离心速度3 000 r/min,离心10 min,离心半径15 cm),离心后取血清待检。使用上海酶联的试剂盒,采用酶联免疫吸附试验法测定IL-10水平。(3)TK1:取1支试管标本,经离心机进行离心处理(3 500 r/min,5 min,15 cm),离心后取血清待检。使用海西唐生物科技有限公司的试剂盒,采用酶联免疫吸附试验法测定TK1水平。(4)凝血功能:取1支试管样本,经离心机进行离心处理(3 000 r/min,10 min,15 cm),离心完毕后取血浆待检。使用深圳市美思康的US-2200血液分析仪测定活化部分凝血酶原时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)、凝血酶原时间(prothrombin time,PT)水平。
4统计学方法 采用SPSS24.0软件进行数据处理,全部计量资料均经Shapiro-Wilk正态性检验,符合正态分布的资料以表示,组间用独立样本t检验,多组间用单因素方差分析,组间两两比较采用LSD检验;计数资料用百分比表示,采用χ2检验;若期望值<5,则采用连续校正卡方检验;血清IL-10、TK1表达与ALL患儿危险度分层之间的相关性采用Kendall's tau-b相关性检验;血清IL-10、TK1表达与ALL患儿危险度分层的关系采用Logistic回归分析检验;P<0.05为差异具有统计学意义。
结果
1ALL患儿危险度分层情况 全部患儿均接受危险度分层评估,其中24例标危,50例中危,26例高危,占比分别为24.00%(24/100),50.00%(50/100),26.00%(26/100)。
23组基线资料对比 3组患儿基线资料对比,差异无统计学意义(P>0.05)。见表1。
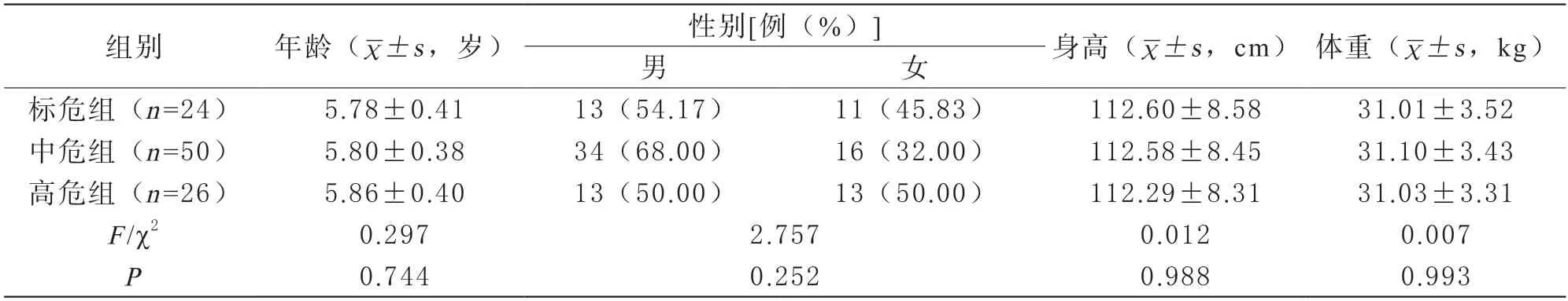
表1 3组基线资料对比
33组患儿实验室指标检测 全部ALL患儿的平均IL-10、TK1表达分别为(9.81±2.94)pg/mL、(4.79±1.35)pmol/L;高危组的IL-10、TK1及WBC计数均高于标危组和中危组,且组间两两比较,差异有统计学意义(P<0.05)。见表2。
表2 3组患儿实验室指标对比()

表2 3组患儿实验室指标对比()
注:与标危组对比,aP<0.05;与中危组对比,bP<0.05。
4血清IL-10、TK1及WBC计数与ALL患儿危险度分层的相关性分析 采用Kendall's tau-b相关性分析结果显示,ALL患儿血清IL-10、TK1及WBC计数与危险度分层之间呈正相关(r>0,P<0.05)。见表3。

表3 血清IL-10、TK1及WBC计数与ALL患儿危险度分层的之间的相关性分析
5血清IL-10、TK1及WBC计数与ALL患儿危险度分层关系的多元Logistic回归分析 将血清IL-10、TK1及WBC计数作为自变量,将ALL患儿危险度分层作为因变量(1=标危,2=中危,3=高危),建立多元Logistic回归分析结果显示,血清IL-10、TK1及WBC计数与ALL患儿危险度分层有关(P<0.05)。相关参数见表4。

表4 血清IL-10、TK1及WBC计数与ALL患儿危险度分层关系的多元Logistic回归分析结果
讨论
作为儿童群体中高发的恶性血液肿瘤,ALL约占全部白血病类型的70%,具有起病急骤、病程短及进展迅速等特点,存在发生感染、贫血、出血等风险[10]。目前,经过规范化的诊治,ALL患儿的长期无事件生存率已增长至70%~80%,但仍有少数部分患儿临床治疗效果不理想,发生难治、复发等,对患儿预后产生不良影响[11]。临床既往通常采用WBC计数、原始/幼稚细胞比例、遗传学等指标判断ALL患儿病情、预后等情况,已成为临床公认指标[12]。但为了更好地评估ALL患儿病情和预后,仍需积极寻找其他与ALL发生、发展密切相关的生物分子标志物,或可为后续治疗提供新的靶点。
研究指出,机体免疫功能在白血病的发生、发展过程中发挥关键性作用,免疫功能异常不仅是白血病发病的重要原因之一,也会造成白血病患者体内的细胞因子分泌失衡[13]。IL-10是由辅助性T淋巴细胞(T helper cells,Th)2合成、分泌的一种细胞因子,可抑制抗原已致敏的CD4+Th0细胞向Th1细胞分化,进而促使Th0细胞向Th2方向分化,减弱Th1细胞分泌细胞因子的能力,从而抑制机体免疫功能,在肿瘤等疾病的发生、发展中占据重要角色[14]。另有研究指出,白血病进展过程中因克隆性白血病细胞的增殖失控、分化障碍及凋亡受阻等多种作用机制,导致骨髓或其他造血组织中的白血病细胞大量增殖,影响机体正常造血功能,进而引发疾病相关症状[15]。B系或T系淋巴细胞大量增殖是ALL的显著特征,患儿WBC计数明显升高,且极易发生眼、中枢神经系统等髓外浸润,增加预后不良的风险[16]。而TK1是一种细胞周期依赖性标志物,主要存在于增殖细胞质中,有研究表明TK1与细胞的增殖密切相关,其能够敏感反映细胞增殖异常,动态评估细胞增殖发展趋势,可用于评估肿瘤增殖速度和分期,与肿瘤发生密切相关[17]。既往研究证明,细胞的增殖速度、DNA的合成与TK1水平变化呈正相关,TK1在细胞分裂的G1期浓度较低,在G1和S期交界处开始逐渐升高,直至S/G2期达到高峰[18]。因此,本研究试图通过测定有关免疫功能和细胞增殖的血清指标IL-10、TK1水平,研究二者与ALL患儿危险度分层的关系。本研究结果发现,高危组的IL-10、TK1水平均高于标危组和中危组,ALL患儿血清IL-10、TK1水平与危险度分层之间呈正相关,表明ALL患儿的血清IL-10、TK1水平存在异常变化,且血清IL-10、TK1水平与不同危险度分层的ALL患儿存在一定的关系。究其原因:当IL-10水平升高时,机体免疫功能受到抑制,免疫监控能力降低,极易促使白血病细胞发生免疫逃逸,与ALL的发生与发展密切相关[19]。并且,IL-10可抑制炎症反应,导致细胞毒性T淋巴细胞对免疫无应答,增加免疫功能缺陷的发生风险,促进ALL的发生与发展[20]。TK1与细胞增殖速度有关,当其水平增加时,则提示细胞增殖分裂旺盛,淋巴细胞具有更强的增殖能力和侵袭能力,ALL患儿的危险度分层越高[21]。最后,本研究多元Logistic回归分析结果显示,以高危为参照,血清IL-10、TK1表达降低时,ALL患儿危险度分层低的可能性分别为7.128倍、13.572倍,进一步证实,血清IL-10、TK1与ALL患儿危险度分层密切相关。未来或可将血清IL-10、TK1作为评估ALL病情与预后的潜在生物标志物,有较好的应用前景。但本研究也存在一定的局限性,如血清IL-10、TK1二者能否相互作用、相互影响,促进ALL的发生和发展,其中机制尚未完全明确,未来仍需开展更多的研究进一步探索、分析。
综上所述,血清IL-10、TK1在ALL患儿中存在异常表达,且与危险度分层具有相关性,联合传统WBC计数、原始/幼稚细胞比例等检测有助于更加准确评估ALL患儿的病情,同时也为了解ALL的发病机制和ALL的靶向治疗提供新的思路。
利益冲突所有作者均声明不存在利益冲突
