肿瘤新抗原肽诱导献血者PBMC特异反应性T细胞*
2022-11-03杨颖路丽明李勤郭忠慧杨启修张嘉敏赵俸涌王晨朱自严
杨颖 路丽明 李勤 郭忠慧 杨启修 张嘉敏 赵俸涌 王晨 朱自严
T细胞相关的细胞免疫治疗[1]目前已被证实可用于治疗实体肿瘤[2]和血液肿瘤[3],如CAR-T(chimeric antigen receptor-T)治疗[4-7]、抗PD-1[8-9]等,而利用肿瘤新抗原制备特异T细胞,并加以回输也可缓解肿瘤黑色素瘤生长以及胸腺瘤等[10-12]等。而以上治疗大多数基于自体T细胞的改造和加工,受限于肿瘤患者疾病状态,如肿瘤患者无法耐受大量采血,或自身免疫细胞已被肿瘤负载所耗竭[13],可能无法进行这种治疗。针对以上问题,本研究使用来自于健康献血者的PBMC作为制备原料,用肿瘤患者来源的肿瘤组织,先制备获得肿瘤细胞,再测序获得新抗原序列,然后人工合成这些抗原肽,在体外利用健康献血者的PBMC在诱导DC后装载抗原肽,进而刺激PBMC中的PBL,使其增殖分化为针对肿瘤新抗原特异反应性T细胞[14],期望以上T细胞可通过细胞毒作用而起到杀瘤效果。
材料与方法
1实验材料与仪器 24孔COSTAR细胞培养板(批号16218055,美国Corning公司)96孔COSTAR细胞培养板(批号16221601,美国Corning公司),75cm2培养瓶(批号30420601,美国Corning公司),完全培养剂含RPMI1640(批号05118006,美国Corning公司)90%、10% FBS(批号35081002,美国Corning公司)、青霉素10 IU/mL、10 μg/mL链霉素,细胞置于37℃、5% CO2培养箱培养;GMCSF(批号111930、011830,工作浓度为0.1 μg/μL,10 μL,美国Peprotech公司);IL-4(批号051914、041814,工作浓度0.1 μg/μL,10 μL,美国Peprotech公司);IL-2(批号091912,工作浓度40 IU/μL,美国Peprotech公司)。RayBio human IFN -gamma ELISA kit(批号:0506220131,0212210131,美国RayBiotech公司);BFA/Monensin Mixture(250×,布雷非德菌素A/莫能霉素混合物,联科生物,70-CS1002),BFA(批号M2294-03,AbMole中国),Ionomycin(批号5608212,美国Biogems公司),PHA(植物血凝素,批号SLBZ9469,美国Sigma公司),LPS(脂多糖,批号L4130,美国Sigma公司),破膜固定剂(批号GAS003/2,联科生物);Fc block(MTG-001,批号10,MBL公司);DNA抽提试剂(血液基因组DNA提取试剂盒,上海天根公司);流式抗体见表1。5% CO2培养箱(三洋MCO-18AC,日本松下公司);流式细胞仪(FACSVerse,美国BD公司;CytoFLEX,美国贝克曼库尓特公司);化学发光仪(SpectraMax i3X,美国Molecuar Devices)。
表1 本实验所用流式标记抗体
肿瘤抗原肽(LM1-LM11,LM13-LM14)委托上海生工合成并分装为1 mg/支,肿瘤抗原肽NSLC、NSLC-Cl、NSLC-st[12]委托南京金斯瑞公司合成并分装为1 mg/支。
2单个核细胞(PBMC)制备及定向诱导DC细胞 当日采集的随机健康献血者富含白细胞的白膜血,用淋巴细胞分离液进行密度梯度离心分离,进行细胞计数及活力测定后,用1640重悬后加入75 cm2培养瓶,于37℃ 5% CO2培养箱静置数小时,然后用1640吹打2遍后,收集不贴壁细胞,于37℃5% CO2培养箱培养过夜,次日冻存于-80℃冰箱作为PBL;75 cm2培养瓶中剩余贴壁细胞则加入完全细胞培养剂,并加入GM-CSF、IL-4各10 μL(0.1 μg/μL),于37℃5%CO2培养箱培养,用于诱导DC,每三天进行半量换液,并加入GM-CSF、IL-4同前,Day 5加LPS;Day 6复苏PBL备用;Day 7收集DC细胞,计数并用1640调整DC细胞为0.5×105~1×105/mL,接种于24孔板,每孔0.5~1 mL,共20孔,4孔留待备用PBL孔,剩余的DC用流式进行DC特征分析。如果用96孔细胞板代替24孔板,则所有试剂和细胞均用原来的1/5体系,所有孔均设置复孔,操作均与24孔板相同,不再另外赘述。
3DC细胞装载肿瘤抗原肽并诱导淋巴细胞分化为肿瘤抗原肽特异T细胞 在上述已分装好DC的24孔板中每孔加入一种肿瘤抗原肽10 μL(2 μg/μL)作为实验组,并设置无肽孔、单独PBL孔各4孔,分别用于基准对照组、以及备用加PHA作为阳性刺激对照组,视细胞数量,对照组复孔数可调整,一般不得少于2孔,37℃ 5% CO2培养箱孵育5 h,取出复苏12 h以上的PBL,调整为DC的 4~10倍细胞密度,每孔加入等体积PBL,继续于37℃ CO2培养箱培养,48~72 h后加入IL-2,终浓度为20~40 IU/mL,每三天进行半量换液,并补充IL-2。Day14加入肿瘤抗原肽,剂量同前;Day 21则用达科为无血清培养基0.5 mL重悬细胞,再加入肿瘤抗原肽,剂量同前,单独PBL孔加PHA 作为阳性对照孔,37℃ 5% CO2培养箱培养,16 h后加入BFA/Monensin 各2 μL,或BFA(0.5 mg/mL)/Ionomycin(50 μg/mL)各2 μL,继续37℃ 5%CO2培养箱培养6 h后取出,留取上清液100~200 μL/孔。
4肿瘤抗原肽特异T细胞反应性 上述24孔细胞板每孔分别加入Fc block 2 μL,并各取4孔(使用单独PBL孔、无肽孔)分别用于不染、FITC、APC、PE单染,室温20 min后加入FITC-CD3APC-CD8抗体,室温30 min,然后根据联科破膜试剂盒所示,分别进行染色固定破膜,并加入胞内染色荧光抗体PE抗IFN-γ,室温30 min后,洗涤后用于流式分析。
5流式细胞仪分析DC特征或T细胞反应性 所有实验均设置无荧光标记的空白管,多色荧光标记时每一荧光分别设置单色标记对照,必要时加上同型对照。根据不染管、单标管,调整细胞选取门和阈值,流式细胞仪(FACSVerse,美国BD公司)、至少读取10 000个细胞(Events)后记录结果;CytoFLEX至少读取5 000个细胞(Events)后记录结果。
5.1DC特征分析:分几组进行流式抗体标记设置以下几种染色组合①APC-CD80、FITC-CD86、PECD83;②APC-HLA-I、PE-CD14、FITC-CD1a;③APC-CD123、PE-CD49f、FITC-CD86;④APCCD56、PE-CD64、FITC-DR;组合①为必选,②~④根据DC数量,选择性选取,加入抗体孵育30 min,PBS洗涤2~3次后进行流式分析,并另取一孔进行7-ADD 单独染死活细胞。
5.2T细胞反应性分析:主要观察CD3+IFN-γ+/CD8+IFN-γ+T细胞群占比,这些细胞代表分泌IFN-γ的反应性T细胞。
6ELISA法分析细胞培养板中IFN-γ含量 按照厂商说明操作,用1.3中所留取的上清液进行IFN-γ含量测定,并同步用标准品建立标准曲线,用SpectraMax i3X仪器自带软件计算得到拟合方程和拟合度,并计算出各待测样品的IFN-γ浓度。
7统计学处理 采用IBM SPSS Statistics 20进行相关统计分析,所有实验结论都经至少三次的独立实验证实。
结果
1DC细胞分析 可观察到本实验用PBMC诱导成熟DC,其HLA-I、HLA-DR、CD86、CD83、CD80均为高表达(图1),符合成熟DC细胞特征,DC占比不同健康个体样品具有差异,诱导率为5%~30%。除了以上标记以外,这些样品还进行了CD1a、CD3、CD14、CD16、CD49f、CD56、CD64、CD123等标记的检测,其中CD1a、CD14在不同样品中呈现出不同的阳性比例,CD49f为部分阳性,CD3、CD16、CD56、CD64、CD123基本以阴性为主。

图1 献血者来源PBMC诱导培养为成熟的DC细胞
2不同肿瘤抗原肽诱导的T细胞反应性 用不同肿瘤抗原肽装载DC后和PBL共培养后,我们可以观察到装载多肽LM5等多组,IFN-γ+CD3+的T细胞明显增多(图2 DMSO-LM5),甚至比PHA刺激阳性对照组(图2 PHA10)更明显,而显示装载多肽NSLC-ST后的分泌IFN-γ+的CD3+T细胞占比差别无明显区别。由于所有实验孔采用的起始细胞量、涉及的试剂、操作、环境均为一致的,只有装载多肽有区别,说明IFN-γ+T细胞占比不同是因加入的抗原肽不同而异。

图2 装载肿瘤抗原肽的DC刺激PBL诱导为分泌IFN-γ的T细胞
3上清液IFN-γ的ELISA结果和CD3+IFN-γ+/CD8+IFN-γ+T细胞比较 利用上清液进行IFN-γ的ELISA分析,测定浓度列于表2,和流式细胞分析结果进行比较并作了相关分析,图3a、3b是流式结果的截图,具体细胞占比也一并列于表2。
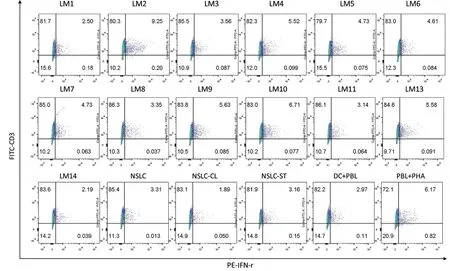
图3a FITC-CD3PE-IFN-γ染色后T细胞群

图3b APC-CD8PE-IFN-γ染色后的T细胞群
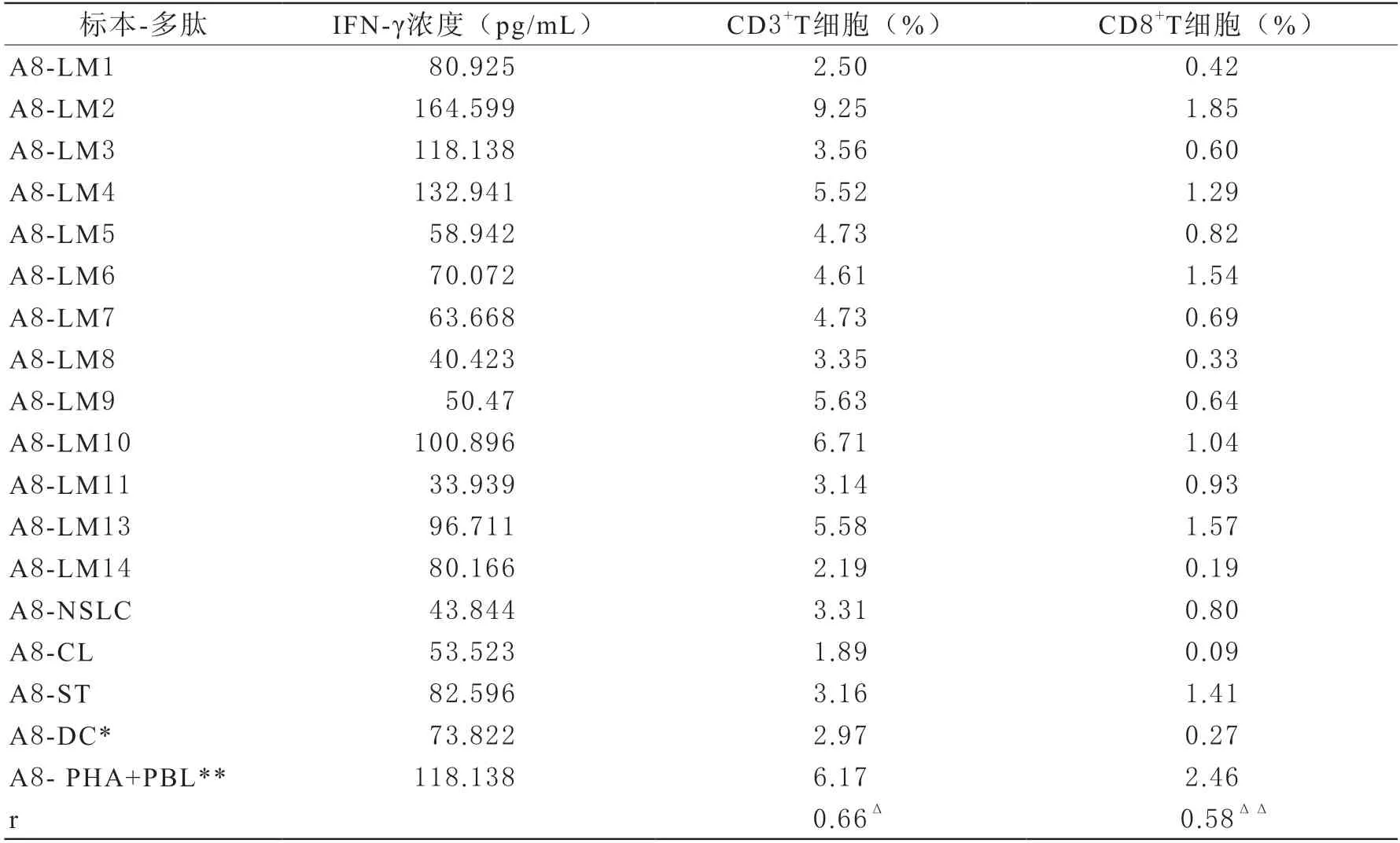
表2 A8样品的IFN-γ ELISA测定浓度与IFN-γ+T细胞比值的比较和相关系数
从表2中可以看到,除阳性对照外,三组中LM2、LM4、LM10、LM13也呈现出比较一致的高IFN-γ,而LM3、LM6组具有部分结果升高,但并没有3组线性同比例增高,可能流式分析的是封闭在细胞内的IFN-γ,而上清液中IFN-γ浓度则是在多肽刺激后前16 h内已经分泌释放到细胞外的,上清液和细胞胞内标志具有时间上的不同步性,反应性高的细胞分泌快,事实上实验中设置的LM3复孔也是同样的情况。IFN-γ浓度和IFN-γ+CD3+T细胞比值相关系数达到0.66,和IFN-γ+CD8T细胞比值相关系数达到0.58,为中等相关,且均具有统计学显著意义,类似相关结果在其他具有细胞反应增高的多份标本中也得到证实,说明上清液中直接测定IFN-γ浓度也可作为检测细胞反应性的一种实验工具。
4献血者PBMC对于新抗原肽的总体反应性 本研究发现可诱导3份或3份以上PBMC产生反应性T细胞的新抗原肽包括LM2、LM3、LM4、LM5、LM6、LM7、LM9、LM10、LM11、LM13,占10/13;但不同PBMC对应具有反应性的多肽数量差异性较大,根据文献[15],我们也采用相同的标准:具有反应性的定义是CD8+IFN-γ+T细胞或CD3+IFN-γ+T细胞数增加超过基准对照组2倍。而部分个体具有较广泛的高反应性,超过基准组10倍,其临床或医学意义需要留待进一步探讨。

图4 不同多肽在不同PBMC中诱导产生细胞毒性T细胞的能力比较
讨论
最近的细胞免疫治疗包括肿瘤疫苗研制等为征服肿瘤提供了曙光,尤其是CAR-T等细胞治疗产品,正式获得临床试验许可,彰显了其应用价值,但目前仅限于血液系统的肿瘤[3-6],而实体肿瘤治疗的免疫治疗手段依然需要进一步的研究[2,10,15]。肿瘤临床治疗领域另一个新的热点-基于免疫检查点阻断的治疗性抗体也具有明显疗效,但仅在20%的患者人群中有效[8],且有效性也可能因突变而不同[16],已有实验证实可通过肿瘤新抗原作为疫苗可诱导获得抗肿瘤治疗效果[10-15,17],而免疫检查点阻断的治疗和肿瘤新抗原诱导T细胞抗瘤等几种联合治疗目前认为可能具有良好效果[18],但采集自肿瘤患者的自身细胞,可能具有免疫反应能力低下、采集量有限等缺点,其有效反应株可在病程发展中被不断耗竭[1,13,19-20],而从健康献血者处分离获取免疫细胞具有数量众多、可重复采集、细胞兼有多样性,可打击肿瘤的不同抗原、可预先制备储存,以利紧急使用等优点,虽然目前没有得到共识,但考虑到本研究的实验流程所制备获取的肿瘤新抗原特异性T细胞是经过抗原肽数次定向诱导活化的,不再是免疫幼稚期,因而我们认为其中具有再次被诱导分化针对未来的同种宿主的克隆株已被大幅清除了[14,23],所以其诱导移植物抗宿主病的能力应该相对低下;另一方面,健康献血者来源PBMC,大部分T细胞只有经过合适的DC诱导“教育”,才可能具备针对DC诱导提呈抗原肽的T细胞克隆[14,23-27]。
有鉴于此,我们设计了本研究,利用肿瘤患者的肿瘤组织获取单细胞,根据单细胞测序得到的序列合成新抗原肽,再用MHC多样化的众多健康献血者来源PBMC作为实验细胞,通过诱导培养成熟DC装载新抗原肽,“教育”Naïve T细胞获得识别抗原肽的能力并活化增殖成熟,从而获得抗肿瘤抗原肽的能力。我们的实验也证实了献血者的PBMC可被诱导而产生明显的活化状态,17位献血者中的13位,他们的PBMC能使用本团队获得的新抗原肽而诱导出明显的反应性T,而13种新抗原多肽中有10种至少在3份血样中可诱导得到反应性T细胞,如LM3、LM4、LM5、LM7、LM13等,可能因为健康献血员的血样具有更高杀瘤潜力。
同时我们的实验也表明ELISA法测量IFN-γ浓度也是可行的,在多肽刺激后16 h进行的封闭,并不影响大部分实验样本已分泌出部分IFN-γ,浓度已处于可测范围内,且结果和流式细胞学分析具有一定的相关性。考虑ELISA实验的简便性和实验检材的易保存特征,IFN-γ浓度测定有望可增加作为细胞毒性或反应性T细胞检测辅助筛选手段之一。
我们也关注到实验过程中有些个体差异非常明显,如PHA刺激T细胞反应性,有的样品能分泌出高达2 000 pg/mL的IFN-γ,而同样条件下有的样品只分泌出100 pg/mL,健康献血员中这种受刺激后高表达细胞因子的倾向,有何实际意义尚不得知,是否和感染后容易产生细胞因子风暴有关或者具有更高的抵抗肿瘤发生能力,都需要进一步研究。
本研究希望能利用血液中心的特点——广泛而不间断的献血者来源,具备多样化HLA特征而且可以预先冻存等优势,为肿瘤的治疗提供新的资源和方法,使得健康献血员来源PBMC得到更有效的利用,先利用肿瘤组织获取肿瘤新抗原,进行肿瘤疫苗的“量身订做”,再从众多冻存预制的库存中筛选出符合不同病人的细胞资源,根据MHC匹配或部分匹配原则,制造出合适的抗瘤细胞,过继输注或局部注射给病人进行后续治疗,从而造福人类。
利益冲突所有作者均声明不存在利益冲突
(致谢:资金资助方:中国输血协会威高重点CSBT-MWG-2020-01;上海市卫健委面上项目202040503 ;东南大学免疫系沈传来教授给予的实验帮助)
