lncRNAs ABHD11-AS1靶向miR-133a上调EGFR表达促进卵巢癌细胞增殖*
2022-11-03王之丰孙昊胡电金志军刘晓军
王之丰 孙昊 胡电 金志军 刘晓军
卵巢癌的发病率低于宫颈癌和子宫内膜癌,居妇科恶性肿瘤的第三位,但死亡率却超过宫颈癌及子宫内膜癌之和,居妇科癌症首位,是严重威胁妇女健康的最大疾患[1-2]。由于卵巢癌的症状不典型,容易被归为其他疾病的并发症,“无声的杀手”因此得名。临床上缺乏有效的筛查技术,因此卵巢癌通常在晚期才被诊断出来,预后较差[3-4]。目前,卵巢癌的治疗依赖于手术和铂类药物,但肿瘤在腹腔内和盆腔内的种植转移无法控制。最新研究显示,卵巢癌5年后的存活率仅为48.6%[2,5]。因此,迫切需要开发新的诊断指标和预后治疗靶标来优化治疗方案。
lncRNAs是一种调节性的非编码RNA,其异常调控被认为与许多疾病有关。miRNAs在不同类型的肿瘤中起着抑癌或癌基因的作用[6],而lncRNAs常常作为miRNAs间接调控基因表达的靶点。大量研究表明,miRNAs与lncRNAs之间的相互作用能较大程度影响癌症的发生和发展[7]。因此,建立一种有效的方法来鉴定与癌症相关的lncRNA-miRNA相互作用是非常重要的。竞争性内源RNA(CeRNA)假说的提出让人们对lncRNA-miRNA之间作用机制的认识上升到一个新的层面[8]。至今已有许多报道证实lncRNAs ABHD11-AS1对卵巢癌的进程有促进作用,但作用机制还有待进一步的探究[9]。而值得关注的是lncRNAs ABHD11-AS1存在miR-133a的结合位点[10],而miR-133a是否通过介导ABHD11-AS1信号从而影响卵巢癌的进程目前还没有相关研究。故本研究旨在探究miR-133a能否通过介导ABHD11-AS1信号影响卵巢癌的进展,并深入分析其作用机制。
材料与方法
1细胞株 人卵巢癌细胞TOV-112D和CaVO3购自中国科学院上海细胞库。人输卵管上皮细胞TEC购自上海钰博生物科技有限公司。所有细胞均使用42.5%MCDB105(含1.5 g/L碳酸氢钠)+42.5% M199(含2.2 g/L碳酸氢钠)培养液中,同时加入15%胎牛血清以及1%的青霉素-链霉素培养。并将细胞置于37 ℃、5% CO2的培养箱内培养,常规消化传代,选用对数生长期的细胞进行实验。
2主要试剂 PRMI-1640培养液购自HyClone公司;胎牛血清购自Gibco;RIPA裂解液和BCA试剂盒购自上海碧云天生物技术有限公司;NC siRNA,lncRNAsABHD11-AS1 siRNA,NC siRNA inhibitor、miR-133a inhibitor以及NC mimic和miR-133a mimic委托上海合星生物科技有限公司合成;Lipofectamine 2000转染试剂购自Invitrogen公司;TRLzol试剂以及TIANSeq M-MLV反转录酶购自北京普洛麦格生物技术有限公司;SYBR Green qPCR Mix购自于Thermo Fisher Scientific公司;CCK-8检测试剂购自北京索莱宝公司;pMIR-reporter荧光素酶载体购自美国Ambion 公司;双荧光素酶报告基因检测试剂盒购自于北京索莱宝公司。
3Real-time PCR 采用TRIzol试剂按照说明书从细胞中分离出总RNA。然后按照操作说明书通过TIANSeq M-MLV逆转录成cDNA。采用SYBR Green qPCR Mix进行Real-time PCR反应,控制条件在95℃ 10 min;95℃ 10 s,60℃ 30 s,72℃ 10 s下利用SYBR Green qPCR Mix进行Real-time PCR反应,经历35个循环后检测其溶解曲线并分析样本Ct值。以GAPDH为内参,采用2-△△Ct法计算mRNA的相对表达量。实验中所用引物序列见表1。
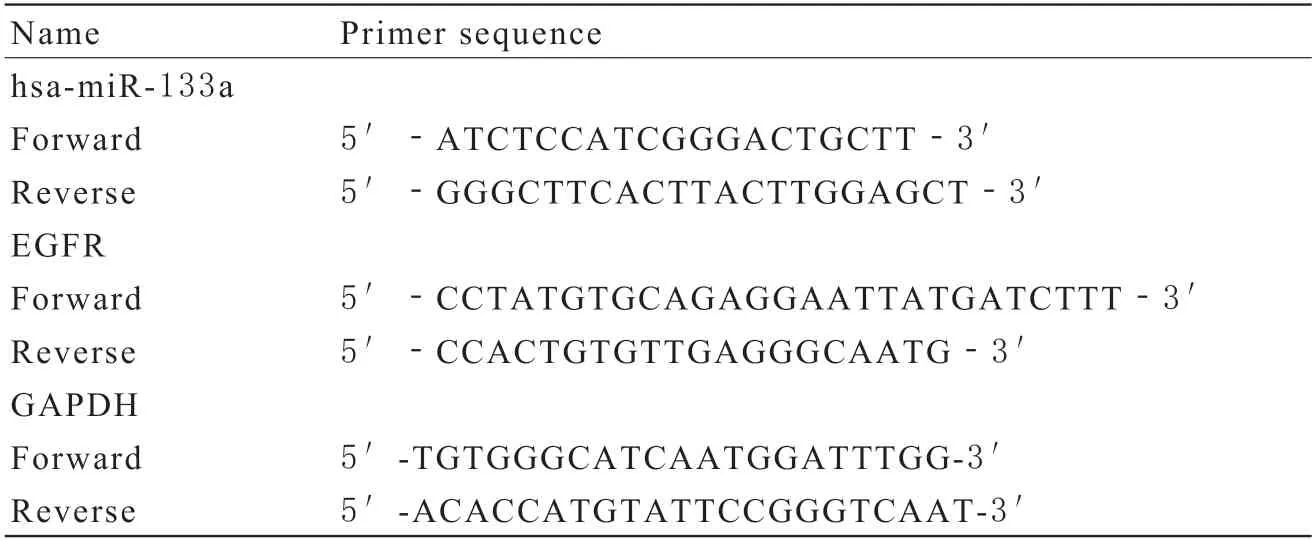
表1 Real-time PCR引物序列
4免疫印迹分析 在冰上用预冷后的RIPA裂解液裂解细胞。使用BCA试剂盒对细胞总蛋白进行定量,操作严格按照说明书进行。每组总蛋白上样量为20 μg,再用10%聚丙烯酰胺凝胶进行分离,最后转移到PVDF膜上。在室温下用5%脱脂牛奶封闭1.5 h后,用以下主要抗体在4 ℃下培养过夜:小鼠单克隆抗人β-actin antibody(1∶3 000;Cell Signaling Technology),小鼠单克隆抗人EGFR(1∶1 500;Cell Signaling Technology)。用PBS冲洗膜5次,每次5 min,并在室温下用辣根过氧化物酶(HRP)结合的山羊抗鼠IgG(1∶5 000;Santa Cruz Biotechnology)培养2 h。用化学发光(ECL)检测系统检测条带,并用image-j软件对结果进行分析。
5细胞转染 将对数生长期的细胞接种于6孔板中,待细胞增长到70% 融合时,采用Lipofectamine 2000转染试剂进行细胞转染,按照试剂盒说明书转染NC siRNA、ABHD11-AS1 siRNA和NC inhibitor、miR-133a inhibitor或者NC mimic和miR-133a mimic。ABHD11-AS1 siRNA的序列为:Forward:5'-GCUACGAGAUCAUGAGCCA-3',Reverse:5'-UGGCUCAUGAUCUCGUAGC-3'。
6CCK-8实验 将细胞接种至96孔板,每孔的密度为1.0×103/孔。分别于细胞转染后的 0、24、48、72和96 h时加入10 μL的CCK-8试剂。2 h后用酶标仪测量OD450值。
7双荧光素酶检测 将含有ABHD11-AS1野生型序列的质粒wt-ABHD11-AS1和突变型序列的质粒mut-ABHD11-AS1分别与miR-133a mimic或者NC mimic共转染至TOV-112D细胞内,24 h后采用双荧光素酶报告的基因检测试剂盒检测各组的荧光强度。以荧光素酶pGL-3.0为内参,分析各组荧光素酶的活性。
8统计学分析 数据分析主要用GraphPad Prism 8.0和SPSS17.0软件进行。两样本的比较采用独立样本的t检验分析,三组及以上的差异分析则利用单因素方差分析,事后比较采用LSD法。当P<0.05时,差异具有统计学意义。
结果
1lncRNAs ABHD11-AS1对卵巢癌细胞增殖的影响Real-time PCR检测lncRNAs ABHD11-AS1在卵巢癌细胞TOV-112D和CaVO3和人输卵管上皮细胞TEC中的表达,结果显示:ABHD11-AS1在TOV-112D和CaVO3中的表达水平明显高于TEC细胞。为了探究lncRNAs ABHD11-AS1的表达水平对卵巢癌细胞增殖影响,在TOV-112D和CaVO3细胞中转染ABHD11-AS1 siRNA,运用CCK-8实验进行检测,结果表明:下调lncRNAs ABHD11-AS1表达水平可明显抑制卵巢癌细胞的增殖(图1,P<0.01)。

图1 Real-time PCR检测lncRNAsABHD11-AS1在卵巢癌细胞和人输卵管上皮细胞中的表达
2lncRNAs ABHD11-AS1对miR-133a的调控作用 在转染ABHD11-AS1 siRNA后,用Real-time PCR检测CaVO3和TOV-112D中的miR-133a的表达。一方面,从图2A(Real-time PCR)可以看出在CaVO3和TOV-112D中转染ABHD11-AS1 siRNA后,miR-133a的表达明显升高(P<0.01)。另一方面,图2B(双荧光素酶)结果表明,转染miR-133a mimic和野生型lncRNAs ABHD11-AS1后的细胞荧光强度显著降低(P<0.01)。因此,上述结果说明lncRNAsABHD11-AS1参与调控miR-133a的表达。

图2 lncRNAs ABHD11-AS1对miR-133a的调控
3miR-133a在卵巢癌细胞系和人输卵管上皮细胞TEC中的表达情况 Real-time PCR检测卵巢癌细胞系TOV-112D、CaVO3和人输卵管细胞TEC中miR-133a的表达,结果显示:相对于TEC细胞,miR-133a在TOV-112D和CaVO3中的表达水平显著降低(图3),在TOV-112D和CaVO3细胞中分别转染NC mimic和miR-133a mimic,Real-time PCR结果(图3)显示:与NC mimic组相比,在转染了miR-133a mimic后的TOV-112D和CaVO3细胞中miR-133a的表达水平会明显增加(P<0.01)。转染miR-133a mimic能够显著增加TOV-112D和CaVO3细胞中miR-133a的表达水平。

图3 miR-133a在卵巢癌细胞系和人输卵管上皮细胞TEC中的表达
4miR-133a对卵巢癌细胞增殖的影响 在得出上述结论后,我们进一步探究了miR-133a的表达水平对卵巢癌细胞增殖的影响。首先对TOV-112D和CaVO3细胞进行转染miR-133a mimic并培养24 h,随后用CCK-8检测二者的增殖能力,结果显示转染后细胞的增殖能力降低(图4,P<0.01),说明上调miR-133a的表达有利于抑制卵巢癌细胞的增殖。根据上述结果,进一步探究miR-133a与卵巢癌细胞增殖的关系,在TOV-112D和CaVO3细胞中转染miR-133a inhibitor,结果表明:下调miR-133a表达水平可明显促进卵巢癌细胞的增殖(图5,P<0.01)。

图4 miR-133a对卵巢癌细胞TOV-112D和CaVO3增殖的影响

图5 miR-133a inhibitor 对卵巢癌细胞增殖的检测
5卵巢癌细胞中miR-133a下游靶基因EGFR的表达检测 在TOV-112D和CaVO3细胞中转染miR-133a mimic后,检测下游靶基因EGFR的表达,结果显示:与NC mimic组相比,转染miR-133a mimic后两株细胞中EGFR的表达水平显著降低,差异具有统计学意义(图6,P<0.01)。此外,为了进一步探究miR-133a与卵巢癌细胞中EGFR表达的关系,在前期研究基础上,在TOV-112D和CaVO3细胞中转染miR-133a inhibitor,结果表明:与NC inhibitor组相比,转染miR-133a inhibitor后两株细胞中EGFR的表达水平明显提高,差异具有统计学意义(图7,P<0.01)。

图6 miR-133a mimics对卵巢癌细胞EGFR表达的检测

图7 miR-133a inhibitor对卵巢癌细胞EGFR表达的检测
6卵巢癌细胞中蛋白EGFR的表达检测 在TOV-112D和CaVO3细胞中转染miR-133a mimic后检测下游蛋白EGFR的表达,结果显示:与NC mimic组相比,转染miR-133a mimic能够显著降低两株细胞中EGFR的表达水平,差异具有统计学意义(图8,P<0.01)。与此相反,在TOV-112D和CaVO3细胞中转染miR-133a inhibitor,结果表明:与NC inhibitor组相比,转染miR-133a inhibitor后细胞中EGFR的表达水平明显提高,差异具有统计学意义(图9,P<0.01)。
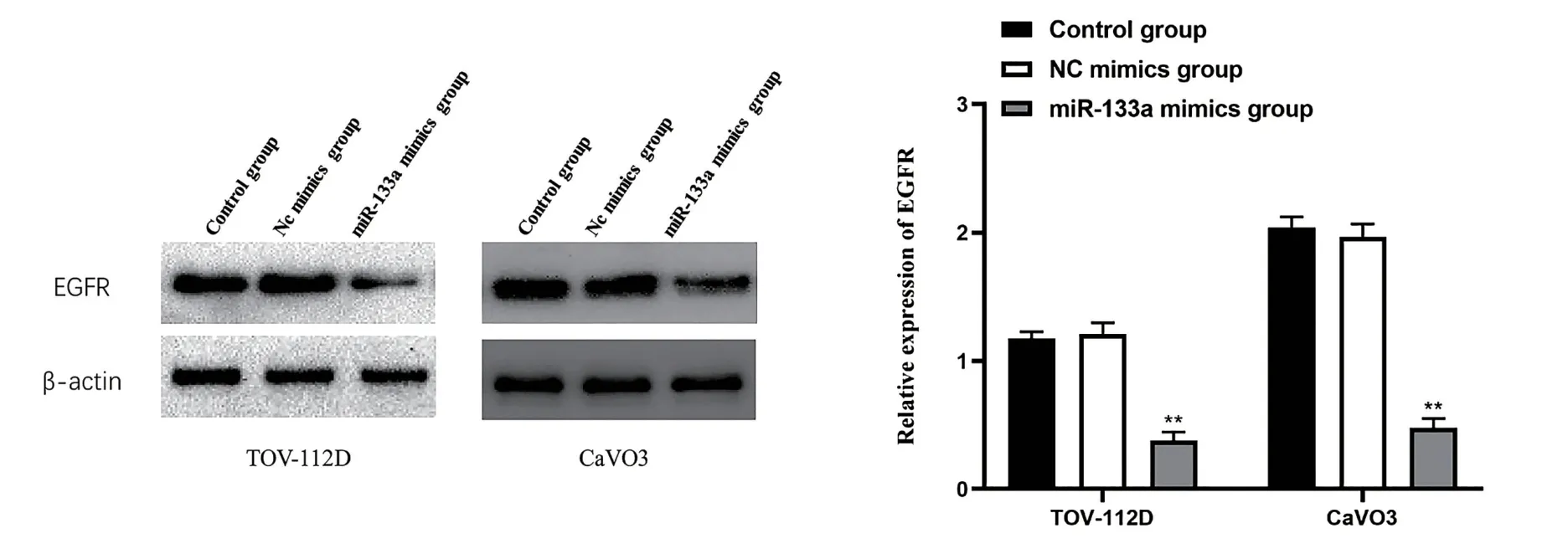
图8 miR-133a mimics对下游蛋白EGFR的表达检测

图9 miR-133a inhibitor对下游蛋白EGFR的表达检测
7lncRNAsABHD11-AS1的表达水平对EGFR表达的影响 根据上述结果,为了探究lncRNAs ABHD11-AS1的表达水平对EGFR表达的影响,在TOV-112D和CaVO3细胞中转染ABHD11-AS1 siRNA,运用Real-time PCR以及WB实验进行检测,结果表明:与NC siRNA组相比,转染ABHD11-AS1 siRNA后细胞中EGFR的表达水平明显降低,差异具有统计学意义(图10,P<0.01)。

图10 Real-time PCR和WB实验检测ABHD11-AS1 siRNA对EGFR表达的影响
讨论
miRNAs作为一种小分子非编码RNA,其长度约21~25个核苷酸,能够结合目的基因的3'非编码区(3'UTRs)来抑制基因表达[8]。由于一个miRNA靶向多个mRNA,因此miRNA在众多生物学过程中发挥着重要作用,如细胞增殖、血管生成、细胞周期和细胞迁移等。研究表明miRNAs的改变影响着肿瘤的发展,miRNAs在肿瘤中异常表达,并且由于其靶点的性质miRNAs起着肿瘤启动子或抑制子的作用[11]。多个miRNAs已经被证实能够调控卵巢癌细胞的增殖,并调节肿瘤的发生进展与转移,其中,miR-133a在卵巢癌的发病和转移的过程中起着至关重要的作用[12-13]。与此类似,lncRNA作为一种长度大于200个核苷酸的非编码RNA。研究表明其与各种疾病尤其是肿瘤有着密不可分的联系,正逐步成为研究热点[14]。ceRNA假说指出lncRNA可以通过miRNA的结合位点吸附miRNA从而释放miRNA下游的靶基因[8]。研究表明,lncRNAsABHD11-AS1通过调控miR-361-3p/PDPK1信号促进胃癌的发展[15],亦有研究证实,其靶向细胞周期蛋白D1促进子宫内膜癌的发展[16],皆表明其与肿瘤密不可分。LEI等通过生物信息学预测发现lncRNAsABHD11-AS1上存有miR-133a的结合位点[10],且有实验证实了该结合位点的可行性[17-18]。而且我们的实验结果更进一步证实,在卵巢癌细胞中下调ABHD11-AS1显著促进了miR-133a的表达,双荧光素酶结果显示,同时转染miR-133a mimic和野生型ABHD11-AS1的片段显著抑制了荧光素酶的活性。上述结果说明ABHD11-AS1能够与miR-133a结合。
miR-133a首次被报道是一项在小鼠上进行的试验研究,研究发现miR-133a通过调节骨形态发生蛋白2(BMP-2)在胚胎肌肉发育过程中对成肌细胞增殖和分化起着至关重要的作用[19-20]。肿瘤细胞与正常细胞最大的区别是肿瘤细胞过度增殖的生长特性,随着对miR-133a进一步的研究,人们发现miR-133a在前列腺癌[21]、头颈部鳞状细胞癌[22]、乳腺[23]、膀胱[24]、食管[25]和结直肠肿瘤[26]中的表达与正常组织相比相对下调。研究表明miR-133a表达的恢复被报道可以抑制癌细胞的增殖、迁移和侵袭,并诱导肿瘤细胞凋亡[21-26]。这些证据都表明miR-133a在多种人类癌症中起抑癌作用。我们的研究也验证了这一点:上调miR-133a能显著抑制卵巢癌细胞的增殖能力,且抑制miR-133a的表达水平会促进其增殖。再结合lncRNAs ABHD11-AS1在卵巢癌组织中的高表达以及抑制ABHD11-AS1的表达能够显著抑制卵巢癌细胞的增殖[9]的研究发现,可以推测下调lncRNAs ABHD11-AS1能够释放miR-133a来抑制卵巢癌细胞的增殖,我们的研究也证实了这一点,通过下调lncRNAs ABHD11-AS1的表达水平,可以明显抑制卵巢癌细胞的增殖以及EGFR的表达水平。
众所周知,miRNAs通常通过与靶mRNAs的3'utr结合抑制靶mRNAs的表达来发挥其生物学功能。SONG等人[27]通过生物信息学的方法预测miR-133a的基因靶点发现表皮生长因子受体(EGFR/ErbB-1/HER1)在3'UTR上有两个高度保守的miR-133a结合位点,miR-133a能够靶向调控EGFR来抑制宫颈癌细胞在体内增殖。研究发现miR-133a通过直接靶向非小细胞肺癌[28]、前列腺癌[29]和乳腺癌[30]中的3'UTR抑制EGFR的表达。EGFR是表皮生长因子(EGF)成员的细胞表面受体,是ErbB受体家族的一员,在刺激细胞内蛋白酪氨酸激酶[31]活性方面起着关键作用。据报道,EGFR在多种肿瘤呈高表达,并且EGFR的过度表达与肿瘤的进展、对化疗和放疗的抵抗以及预后不良有关,表明它是一种癌基因[32]。我们的研究显示,上调miR-133a显著抑制卵巢癌细胞中EGFR的表达,在抑制miR-133a的表达水平后发现此抑制作用被逆转,这提示了miR-133a可能通过抑制EGFR的表达来发挥抗卵巢癌细胞增殖的作用。
综上,本研究主要探讨了卵巢癌细胞中miR-133a的表达水平对抗癌作用的影响,并深入研究了其作用机制。结果表明,相对于人输卵管上皮细胞,miR-133a在卵巢癌细胞中的表达水平更低,而上调其表达则有利于抑制卵巢癌细胞的增殖能力,通过抑制miR-133a的表达水平,也验证了这一点。主要作用机制是lncRNAs ABHD11-AS1通过调控miR-133a,进而上调其下游靶基因EGFR的表达,从而促进卵巢癌的恶性表型。
利益冲突所有作者均声明不存在利益冲突
