肝素结合蛋白在鉴别诊断类风湿性关节炎合并细菌感染患者中的临床价值*
2022-11-03宋波黄猛丰新倩任守凤张树超
宋波 黄猛 丰新倩 任守凤 张树超
类风湿性关节炎(rheumatoid arthritis,RA)是以持续性关节炎症引起软骨和骨骼损伤,最终导致全身并发症为特征的慢性自身免疫性疾病[1]。相关流行病学调查研究显示,RA全球患病率为0.5%~1%,我国大陆地区患病率为0.42%,男性患病率显著低于女性,约为女性的1/4,总患病人群约500万[2]。细胞因子拮抗剂广泛应用于RA的治疗并取得了显著疗效,但仍有发生感染等并发症的局限性,这可能是RA自身的免疫调节作用或免疫抑制剂所致[3]。当前感染已是RA患者常见的死亡原因之一[4]。活动期RA患者临床表现与细菌感染类似,常伴有红细胞沉降速率(ESR)、C反应蛋白(CRP)、白细胞(WBC)等炎症标志物升高。然而,上述常规炎症标志物对鉴别诊断RA合并细菌感染存在一定局限性,特异性较差[5]。传统的微生物培养依然是细菌感染诊断的“金标准”,但耗时久、阳性率低[5]。因此,寻找早期、快速、敏感且特异的能用于鉴别诊断RA合并细菌感染的炎症标志物非常必要。在诊断局部细菌性感染方面,血浆肝素结合蛋白(HBP)被证实优于临床实验室常用炎症指标[6]。本研究旨在探讨各组血浆HBP水平,为RA合并细菌感染患者的鉴别诊断提供依据,报道如下。
资料与方法
1临床资料 采取前瞻性研究方法,选择2021年7月~2022年2月淄博市第一医院就诊的122例RA患者,其中男性45例、女性77例,年龄36~90岁,平均年龄(60.6±11.07)岁。RA活动期组男性16例、女性23例,共39例,平均年龄(60±9.8)岁;RA疾病活动度[7](DAS28)评分为轻度疾病活动7例,中度疾病活动21例,重度疾病活动11例。RA缓解期组男性13例、女性28例,共41例,平均年龄(55.1±11.2)岁。RA合并细菌感染患者男性16例、女性26例,共42例,平均年龄(66±9.3)岁;呼吸系统感染24例,尿路感染12例,皮肤感染2例,颅脑感染2例,菌血症1例,关节感染1例。单纯细菌感染组患者男性8例、女性15例,共23例,平均年龄(62.7±13.5)岁 。健康对照组均为本院健康体检者,其中男性15例、女性45例,共60例,平均年龄(59.2±7.4)岁。5组研究对象的性别、年龄等临床资料比较,差异无统计学意义(P>0.05)。
1.1RA患者的纳入标准[8]:(1)所有患者诊断均符合美国风湿学会(ACR)和欧洲抗风湿联盟(EULAR)2010修订的RA分类标准;(2)单纯细菌感染和RA合并感染患者依据细菌培养结果和临床诊断,严格限定为细菌感染,伴有发热且使用抗生素抗感染治疗后效果明显;(3)患者知情同意参加本研究。该研究经淄博市第一医院伦理委员会批准(编号:YXLL2021072269)。
1.2RA患者的排除标准:(1)患者为孕妇或患有恶性肿瘤;(2)患者有重要脏器的功能受损;(3)患者患有其他免疫性疾病;(4)病史资料残缺。
1.3健康对照组:从我院体检者中抽取60名研究对象,性别、年龄与RA组相匹配。纳入标准:(1)近2个月内无明显感染病史;(2)无心脑血管、糖尿病、病毒性肝炎、高血脂、恶性肿瘤和肾病等慢性疾病。
2仪器与试剂 美国贝克曼库尔特全自动生化分析仪AU5800、深圳迈瑞全自动血液分析仪CAL8000、意大利 Vital Diagnostics全自动血沉仪monitor 100。透射比浊法肝素结合蛋白检测试剂(苏州康和顺医疗技术有限公司,试剂批号:HB2211001)、透射比浊法CRP检测试剂(美国贝克曼库尔特)、溶血剂和缓冲液(深圳迈瑞生物医疗电子股份有限公司)。
3方法
3.1用真空采血系统采集患者治疗前及抗菌治疗1~2 w后静脉血3 mL于乙二胺四乙酸二钾(EDTA-K2)抗凝管内,2 h内离心(2 000 r/min,10 min)分离出血浆,取上层血浆用安剖管分装后于-80℃冰箱冷冻备用。使用美国贝克曼库尔特全自动生化分析仪AU5800检测血浆HBP。
3.2真空采血系统采集患者治疗前及抗菌治疗1~2 w后静脉血3 mL于促凝管内,2 h内离心(2 000 r/min,10 min)分离出血清。使用美国贝克曼库尔特全自动生化分析仪AU5800检测血清CRP。
3.3用真空采血系统采集患者治疗前及抗菌治疗1~2 w后静脉血2 mL加入EDTA-K2抗凝管内,混匀后使用深圳迈瑞全自动血液分析仪CAL8000测定WBC。
3.4采集患者治疗前及抗菌治疗1~2 w后静脉血1.6 mL,加入血沉管内混匀后使用全自动血沉仪monitor100检测ESR。
3.5RA疾病活动度(DAS28)的评价:基于RA患者28个关节的压痛数、肿胀数、ESR、患者疼痛视觉模拟标尺法(VAS)。DAS28<2.6为疾病缓解,2.6≤DAS28≤3.2为轻度疾病活动,3.2<DAS28≤5.1为中度疾病活动,DAS28>5.1为重度疾病活动。
4统计学处理 文中所有实验数据均采用SPSS22.0分析处理,数据的正态性采用Shapiro-wilk法进行检验,正态分布的计量资料以均值±标准差(D)表示,以中位数(四分位数)[M(P25~P75]表示偏态分布的计量资料,用Kruskal-Wallis H检验分析多组间数据。治疗前后数据采用Wilcoxon signed-rank检验。采用Spearman分析相关性。以P<0.05为差异有统计学意义。绘制受试者工作特征曲线(ROC曲线)并计算曲线下面积(AUC)、临界值、敏感性和特异性。
结果
1单纯细菌感染组、RA合并细菌感染组、RA活动期组、RA缓解期组和健康对照组结果分析 RA合并细菌感染组血浆HBP水平显著高于RA活动期组(P<0.01)、RA缓解期组(P<0.01)和健康对照组(P<0.01),与单纯细菌感染组比较差异无统计学意义(P>0.05)。RA合并细菌感染组WBC高于RA活动期组(P<0.01)、RA缓解期组(P<0.01)和健康对照组(P<0.01),与单纯细菌感染组比较差异无统计学意义(P>0.05)。RA合并细菌感染组ESR水平高于RA活动期组(P<0.01)、RA缓解期组(P<0.01)和健康对照组(P<0.01),与单纯细菌感染组比较差异无统计学意义(P>0.05)。RA合并细菌感染组CRP水平高于RA活动期组(P<0.01)、稳定期组(P<0.01)和健康对照组(P<0.01),与单纯细菌感染组比较差异无统计学意义(P>0.05)。单纯细菌感染组和健康对照组比较差异有统计学意义(P<0.01)。见表1。

表1 各组HBP、WBC、ESR、CRP结果分析[M(P25~P75)]
2血浆HBP与WBC、ESR、CRP、DAS28的相关性分析 RA合并细菌感染组HBP水平与CRP呈正相关(r=0.332,P<0.05),与ESR、WBC无相关性(P>0.05)。RA活动期组HBP水平与CRP、DAS28呈正相关(r=0.582,P<0.01;r=0.461,P<0.05),与ESR、WBC无相关性(P>0.05)。见表2。

表2 血浆HBP与CRP、WBC、ESR、DAS28相关性
3RA合并细菌感染组治疗前后HBP、WBC、ESR、CRP结果分析 与治疗前相比,25例RA合并细菌感染组患者经1~2 w抗菌药物治疗后血浆HBP、CRP、ESR水平均有所下降,差异有统计学意义(Z=-4.372,P<0.001;Z=-4.372,P<0.001;Z=-4.171,P<0.001);治疗后WBC水平差异无统计学意义(Z=-0.135,P=0.893)。见表3。
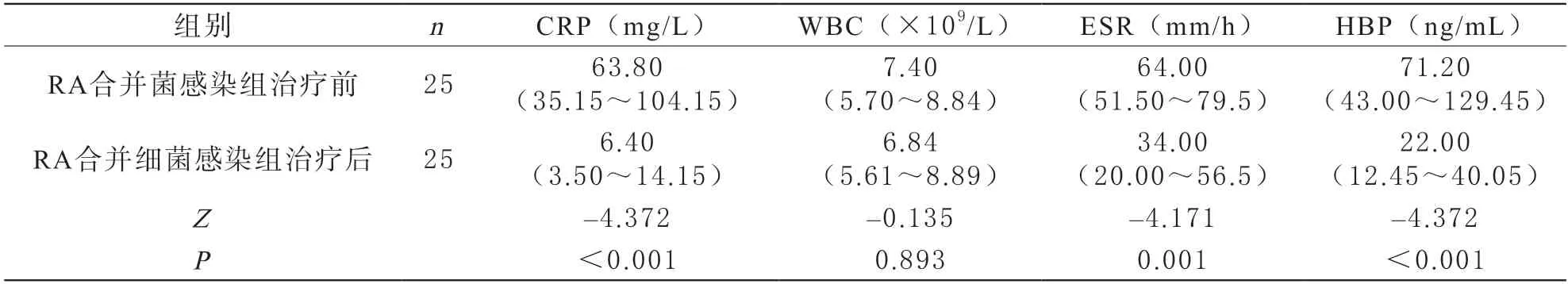
表3 细菌感染组治疗前后HBP、CRP、WBC、ESR结果分析[M(P25~P75)]
4RA合并细菌感染组革兰阴性菌与革兰阳性菌感染HBP比较 RA合并革兰阴性菌感染HBP水平为64.30 ng/mL(34.20~115.50)、革兰阳性菌感染HBP水平为60.75 ng/mL(35.05~137.09),RA合并革兰阴性菌感染与革兰阳性菌感染HBP水平比较差异无统计学意义(Z=-0.923,P>0.05)。见表4。
5血浆HBP鉴别RA合并细菌感染和活动期的诊断价值 选择约登指数为0.775时,血浆HBP水平24.55 ng/mL为最佳诊断临界值,ROC曲线下面积为0.949,诊断RA合并细菌感染敏感性为92.9%,特异性为84.6%。HBP鉴别RA合并细菌感染的AUC显著高于CRP、WBC、ESR,差异有统计学意义(Z=3.837,P=0.001;Z=5.662,P<0.001;Z=4.127,P<0.001)。见图1,表4。
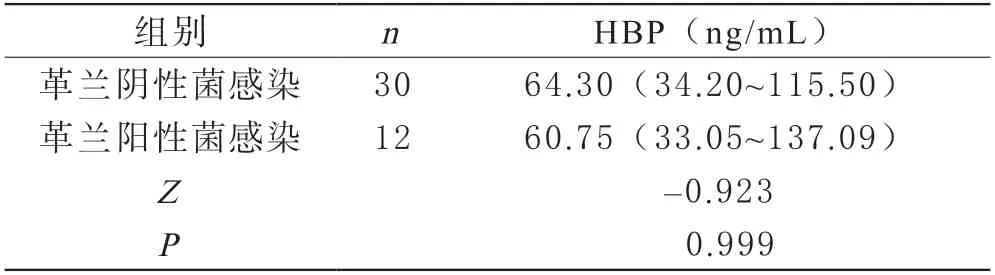
表4 RA合并细菌感染组革兰阴阳性细菌HBP结果分析[M(P25~P75)]
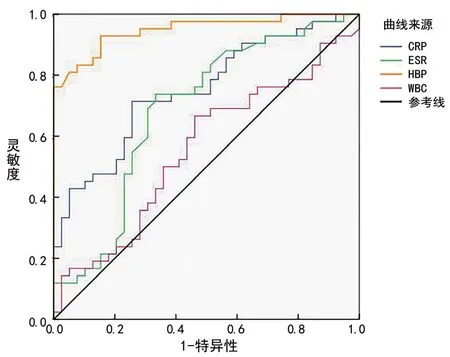
图1 血浆HBP鉴别诊断RA合并细菌感染和RA活动期的ROC曲线
讨论
RA是一种慢性进行性炎症性疾病,以滑膜炎、血管翳为病理基础,表现为多关节的对称性关节炎,可导致关节和关节周围结构损伤以及全身炎症[7]。感染是导致RA患者死亡的主要原因之一[4]。临床实验室常规炎症指标如WBC、CRP、ESR在诊断感染方面并不特异,可被多种因素影响,机体受到刺激、损伤或炎症后都可能升高。病原学的实验室检测如细菌培养、二代测序技术(NGS)存在耗时久、阳性率低、费用昂贵等局限性[10]。因此寻找能够早期鉴别诊断RA合并细菌感染的炎症标志物显得尤为重要。

表5 HBP、CRP、WBC、ESR鉴别RA合并细菌感染和活动期的诊断价值
HBP是由多形核中性粒细胞分泌的阳离子抗菌蛋白,其可诱导血管渗漏,调节单核-巨噬细胞、相关炎症反应以及细胞凋亡,在检测细菌感染方面具有高灵敏度和特异性[11]。健康人体内HBP含量极低,一般不超过10 ng/mL,细菌感染后外周血HBP水平快速升高[12]。HUANG等[13]纳入157名研究对象的研究表明HBP在重症社区获得性肺炎患儿中预测脓毒症的AUC高于CRP,与CRP相比特异性和阳性预测值较好。KATSAROS等[14]研究表明HBP可作为早期诊断脓毒症和早期死亡危险的一种炎症标志物。局部细菌感染如颅内感染[15]、呼吸系统感染[16-17]、泌尿系统感染[18-19]、细菌性腹膜炎[20]、盆腔炎[21]等均可致HBP水平明显升高,诸多研究证实其是诊断预测疾病进展、评估治疗效果的良好炎症标志物。
HBP有抗菌功能,对革兰阴性菌和部分革兰阳性菌有抗菌活性,细菌侵入机体后刺激中性粒细胞释放HBP,导致其快速升高[12]。与其他炎症标志物相比,HBP在检测细菌感染方面具有高灵敏度和特异性[9]。本研究发现,RA合并细菌感染和单纯细菌感染患者血浆HBP的表达水平与非细菌感染组相比显著升高,差异均有统计学意义(P<0.01),HBP的表达水平与细菌感染相关;RA合并细菌感染患者经1~2 w有效抗菌治疗,HBP水平显著下降,这表明HBP可用于RA合并细菌感染患者的诊断、疗效监测及预后评估[22]。HBP可以识别RA合并细菌感染,但不能区分RA合并革兰阴性菌感染与革兰阳性菌感染,这一结果与前人研究一致[23-24]。
本研究中相关性分析表明,RA合并细菌感染患者血浆HBP与CRP呈正相关,这与KATSAROS等[14]的一项多中心急诊科脓毒症的早期诊断和预后研究报道一致。RA活动期血浆HBP与CRP、DAS28呈正相关,这可能与HBP可参与炎症反应、诱导血管渗漏功能有关[6],可为RA活动期炎症反应的治疗提供新思路。相关性分析提示血浆HBP水平与RA活动度及感染状态有关,RA合并细菌感染组HBP水平显著高于RA活动期组,可用于鉴别RA合并细菌感染和活动期。绘制HBP等指标的ROC曲线显示,血浆HBP的AUC为0.949,显著高于WBC、ESR、CRP;血浆HBP诊断RA合并细菌感染和RA活动期的最佳阈值为24.55 ng/mL,其诊断RA合并细菌感染敏感性为92.9%,特异性为84.6%。与实验室常规检测的传统炎症标志物如WBC、ESR、CRP等相比,HBP具有显著优势,可为RA合并细菌感染的早期诊断提供有力证据。
本研究另有诸多局限之处,如RA合并细菌感染及活动期患者发病病程对血浆HBP水平可能有一定影响,进一步的研究尚需证实血浆HBP水平与发病病程的相关性;RA患者长期使用糖皮质激素、细胞因子拮抗剂、免疫抑制剂等药物,此类药物对血浆HBP的影响尚不明确,需进一步进行大样本量研究。本研究样本量有限,期待后续能由多中心提供更大样本量进行深入研究。
综上所述,血浆HBP可作为RA合并细菌感染与RA活动期鉴别诊断的新型炎症标志物,也可作为RA合并感染抗生素治疗的疗效评估依据。
利益冲突所有作者均声明不存在利益冲突
