连作西洋参根际土壤化感物质筛选及化感效应分析
2022-11-02蒋景龙董艳鑫
李 丽,蒋景龙,董艳鑫,舒 瑜
(1.陕西省催化基础与应用重点实验室,陕西理工大学 化学与环境科学学院,陕西汉中 723001;2.陕西理工大学 生物科学与工程学院,陕西汉中 723001)
连作障碍是一种普遍现象,在农作物和药用植物的种植中普遍存在[1-2]。西洋参(Panax quinquefoliusL.)与人参(Panax ginsengC.A.Mey.)、三七(Panax notoginseng(Burk.)F.H.Chen)同为五加科人参属药用植物,是中国传统的中药材,具有非常重要的医药产业价值[3-4]。西洋参野生资源少,目前医药所用大多是栽培获得的,然而,连作障碍导致药材品质退化,长期制约着西洋参产业的发展[5]。根系分泌的化感物质对植株产生的毒害作用可能是连作障碍的主要成因,董艳鑫等[6]研究发现,重茬土壤浸提液和西洋参水提液能够改变新土土壤的理化性质和酶活性,同时能够抑制西洋参幼苗的存活率,对西洋参幼苗的生长和生理也有显著影响,但对其产生影响的重要成分尚不明确,而重茬土壤浸提液中哪些物质是西洋参分泌的同样不明确,自毒物质对西洋参产生毒害作用的调控机制目前并不清楚。
代谢组学可对生物体内或特定条件下的样本中所有代谢物进行全面、无偏性的高覆盖检测,可寻找和鉴定出不同样品的差异代谢物,从而实现代谢特征的比较[7]。本研究用4 a生西洋参根水提液及其根际土壤浸提液浇灌新土栽培的西洋参幼苗,模拟西洋参重茬环境。采用液质联用(LCMS)的非靶向代谢组学技术对西洋参水提液及其根际土壤浸提液处理的西洋参土壤成分进行全面鉴定,同时对所测得的数据进行QC质控分析和统计学分析,筛选差异代谢物,以期寻找引起西洋参连作障碍发生的潜在化感物质,为西洋参连作障碍提供理论基础,并为今后缓解西洋参连作障碍方面的研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 4 a生西洋参及其根际土壤于2019年11月5日采自陕西省汉中市留坝县火烧店,4 a生西洋参及其根际土壤采集、西洋参水提液(GT)及其根际土壤浸提液(ST)制备参照董艳鑫等[6]方法。
1.1.2 仪器及试剂 质谱仪(Q ExactiveTMHFX,Thermo Fisher),色谱仪(Vanquish UHPLC,Thermo Fisher),高效液相色谱仪(Waters e2695,Waters),低温离心机(D3024R,Scilogex),甲醇、乙腈、甲酸、乙酸铵、二氯甲烷均为色谱纯,氨水和磷酸为分析纯。Ginsenoside Rg3、Ginsenoside Rg2、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin和Cytisine标准品均购自上海源叶生物科技有限公司;Senecionine标准品购自成都德斯特生物有限公司。
1.2 方法
1.2.1 西洋参幼苗栽培处理 挑选大小均一、已露白2 mm的西洋参种子,将其播种到已灭菌的营养土中,每40粒1盘(31.5×24.5×9.5 cm)(5 kg土壤/盘),设置蒸馏水对照组(CK),西洋参根水提液(GT)处理组和土壤浸提液(ST)处理组,每组3个重复。在昼/夜温度为24℃/21℃,光照条件为光照12 h/黑暗12 h的培养室进行培养,1周浇灌2~3次,每次300 m L,处理90 d时分别收取西洋参幼苗栽培土,过1 mm筛,土壤样品用液氮淬灭后分成两份,一份用于代谢组学分析,另一份用于高效液相色谱验证。营养土购自申之北有机土店,为长白山营养有机土,质量为10 kg±0.1 kg,有机质≥30%,p H为4.8~6.5,执行标准为Q/SZB001-2018。白菜种子购自汉中市特优蔬菜种子公司。
1.2.2 代谢物的提取 分别称取100 mg土壤样本,用液氮研磨,加入500μL含0.1%甲酸的80%甲醇溶液,震荡均匀后冰浴5 min,15 000 r/min、4℃离心10 min,取上清加质谱级水稀释至甲醇含量为53%,于4℃、15 000 r/min、离心10 min,吸取上清液,进样,进行LC-MS分析[8]。从每个试验样本中取等体积样本混匀作为数据质量控制(quality control,QC)样本,用于评估LCMS系统的再现性与可靠性,并进行上机检测分析。
1.2.3 LC-MS检测 采用LC-MS技术分析蒸馏水(CK),4 a生西洋参水提液(GT)及其根际土壤浸提液(ST)浇灌的西洋参幼苗栽培土代谢谱。色谱柱:Hypesil Gold column(C18),在正离子模式(Posion mode,POS)下,流动相为0.1%甲酸(A)和甲醇(B)为流动相;在负离子模式(negion mode,NEG)下,流动相为p H 9.0,5 mmol/L乙酸铵(A)和甲醇(B)为流动相。电喷雾离子源(electrosprayionization,ESI)参数设置如下:喷雾电压,3.2 k V;鞘气流速40 arb;辅助气流速10 arb;320℃;扫描范围70~1 050 m/z。
1.2.4 高效液相条件 分别取蒸馏水(CK),4 a生西洋参水提液(GT)及其根际土壤浸提液(ST)浇灌的西洋参幼苗栽培土土壤2 g,分别加入2.0 m L色谱甲醇,超声提取30 min,提取2次,合并滤液,12 000 r/min离心5 min,上清液浓缩后定容至1 m L,过0.22μm滤膜,为Ginsenoside Rg3、Ginsenoside Rg2和Methyl indole-3-acetate、Indole-3-acetic acid、Senecionine和Marmesin供试液。3个组分别取土壤2 g,分别加入5.0 m L二氯甲烷和40%氨水混合液(V∶V=25∶1),超声提取2 h后浸提过夜,12 000 r/min离心5 min,上清液水浴挥干后定容至1 m L,过0.22μm滤膜,为Cytisine供试液。
分别精密称取Ginsenoside Rg3、Ginsenoside Rg2、Indole-3-acetic acid、Senecionine、Methyl indole-3-acetate、Marmesin、Cytisine标准品,加色谱甲醇配制成1.0 mg/m L的对照品标准单品溶液。取Ginsenoside Rg3、Ginsenoside Rg2、Senecionine、Cytisine单标溶液0.5 m L,色谱甲醇3.5 m L混合振荡摇匀,即为125μg/m L的母液,用色谱甲醇依次进行2倍稀释,共6次;Indole-3-acetic acid和Methyl indole-3-acetate同上述方法配制成125μg/m L对照品溶液,随后稀释7次;Marmesin配制成3.91μg/m L对照品溶液,随后稀释6次。
色谱条件见表1。进液量20μL。

表1 色谱条件Table 1 Chromatographic condition
1.2.5 化感作用验证 将白菜种子用75%酒精消毒10 s,随后冲洗干净。在40℃下,水浴10 min。将种子放入培养皿中,分别向培养皿中加入0.008 L 0.001 mg/m L、0.01 mg/m L和0.1 mg/m L的Ginsenoside Rg3、Ginsenoside Rg2、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin、Cytisine和Senecionine溶液,以蒸馏水为对照。置于(25±1)℃的培养间中培养,培养期间每隔12 h添加0.002 L提取液保持湿润,胚根露白0.002 m记为发芽。每隔12 h记录种子发芽数,一周后测量其根长和茎长。每皿20粒,每个处理3个重复。
1.2.6 数据处理与分析 下机数据简单筛选后,对峰面积进行定量分析。根据定量结果进行归一化处理,得到最终结果。使用MetaX软件对数据进行对数转换及标准化处理。将所有试验样本和QC样本提取得到的峰,经UV尺度化(univariate scaling,单变量标准化)处理后进行偏最小二乘判别分析(projection to latentstructures-discriminant analysis,PLS-DA)及模型验证。以PLS-DA模型第一主成分的变量投影重要度(variable importance in the projection,VIP)>1.4和P<0.001(t检验)为标准,进行差异代谢物的筛选。
发芽率=发芽数/种子总数×100%
利用Excel 2016软件处理数据,SPSS 22.0进行统计分析,Duncan氏法进行多重比较,Graph Pad Prism 5.01进行绘图。
2 结果与分析
2.1 QC质控分析
代谢组具有易受外界因素干扰且变化迅速的特点,因此,为了获得可靠且高质量的代谢组学数据,通常需进行质量控制(quality control,QC)。正负离子模式下,QC样本相关性均大于0.98(图1-A、图1-B),表明整个检测过程中,稳定性较好,数据质量较高,为后续代谢物分析结果的准确性提供可行性。在正离子模式下,3组样品在PC1和PC2维度上有较好分离(图1-C),在负离子模式下,3组样品在PC1和PC2维度上没有正离子模式下分离程度好(图1-D)。在正负离子模式下,3组样品以及QC样本均出现组内聚集现象,说明组内重复性比较好,数据具有可信度。此外,CK组与ST组分离程度较 低,而GT组 与CK组和ST组分离程度较高,说明CK组与ST组代谢物具有较高相似性,GT组与CK组和ST组代谢物具有较低相似性。
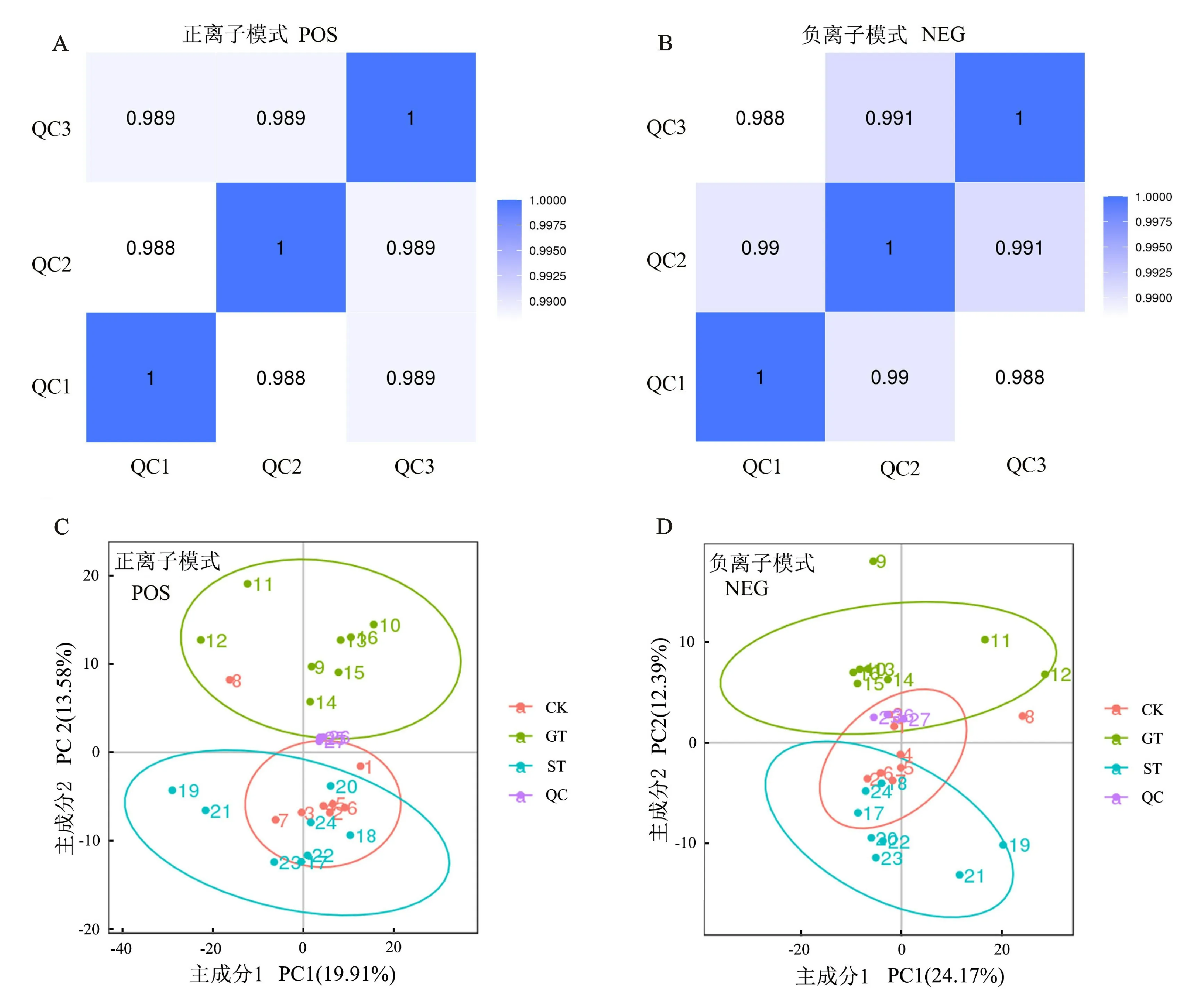
图1 检测数据质控分析Fig.1 Quality control analysis of test data
2.2 PLS-DA多元统计分析
建立PLS-DA模型(图2-A)进行样品类别的预测。各组均出现组内聚集现象,说明重复性较好,且在两种模式下,除CK与ST组距离较近外,CK组与GT组,GT组与ST组区分较为明显。PLS-DA模型经过七次循环交互验证,得到的R2(模型对分类变量Y的解释度)和Q2(模型的预测性)对模型有效性进行评判,在两种模式下,各组R2和Q2均接近1,说明建立的模型稳定可靠。为了判别模型质量好坏,对模型进行排序验证(图2-B),两种模式下R2均大于Q2,表明模型建立良好,不存在过拟合现象。
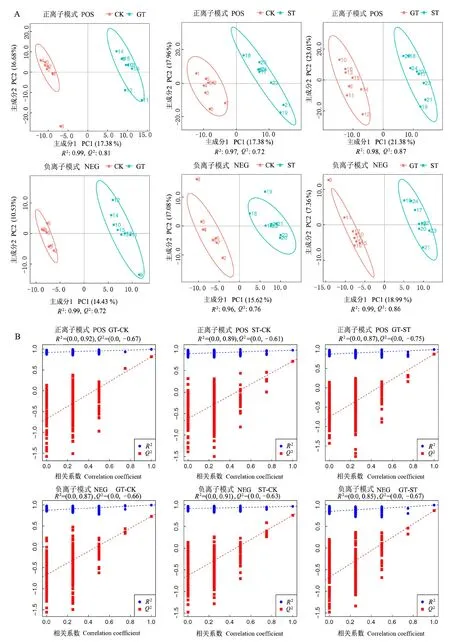
图2 PLS-DA得分散点图及排序验证图Fig.2 PLS-DA get scatter plot and sort verification plot
2.3 差异代谢物分析
设定阈值为VIP>1.0,FC>1.5或FC<0.667且P<0.05,筛选差异代谢物。在POS模式下,3组共检测到代谢物646种,差异代谢物共249种,其中,174种上调,75种下调;在NEG模式下,3组共检测到代谢物457种,差异代谢物共177种,其中,134种上调,43种下调(表2)。根据化合物特征及性质,POS模式下鉴定出差异代谢物24种,其中皂苷类为17%、生物碱类为17%、酮类及黄酮类为17%、有机酸类为17%、萜类为12%、醇类为4%、香豆素类为4%,其他化合物占12%(图3-A);NEG模式下鉴定出20种差异代谢物,其中酮类及类黄酮类占25%、脂类占20%、皂苷类占15%、萜类占10%、有机酸类占5%,其他化合物占25%(图3-B)。此外,3组共有差异代谢物3种,POS模式下2种(图3-C),为Genipin和Methyl indole-3-acetate;NEG模式下1种,为Indole-3-acetic acid(图3-D)。

图3 差异代谢物分类及统计Fig.3 Classification and statistics of differential metabolites

表2 差异代谢物统计分析Table 2 Statistical analysis of differential metabolites
以VIP>1.4和P<0.001的标准,在已鉴定的差异代谢物中筛选出22种,其中在POS模式下有13种,在NEG模式下有9种(表3)。与CK组相比,GT组中13种上调,2种下调;ST组中7种上调,1种下调;其中Methyl indole-3-acetate在GT组和ST组中均上调,Indole-3-acetic acid在GT组中上调,在ST组中下调。
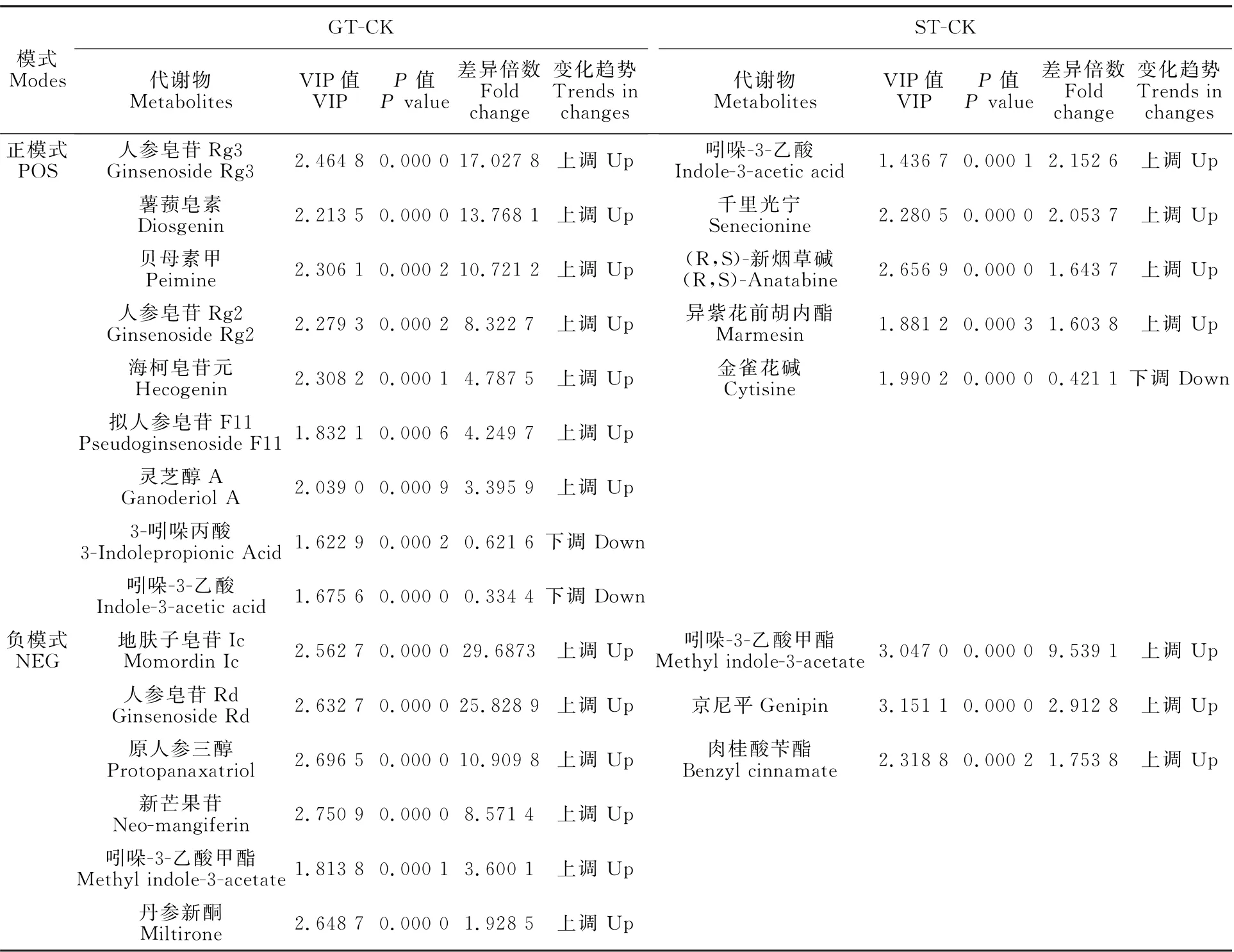
表3 GT-CK和ST-CK土壤差异代谢物Table 3 Different soil metabolites in GT-CK和ST-CK
2.4 HPLC验证差异代谢物
为了验证代谢组学的准确性和进一步验证差异代谢物的变化,分别对3个处理组的土壤Ginsenoside Rg2、Ginsenoside Rg3、Indole-3-acetic acid、Methyl indole-3-acetate、Senecionine、Marmesin和Cytisine进行HPLC检测(图4)。与CK组相比,GT组中Ginsenoside Rg3、Ginsenoside Rg2和Methyl indole-3-acetate含量显著增加,分别增加1.35、0.85和2.07倍,而Indole-3-acetic acid含量减少23%;ST组中Methyl indole-3-acetate、Indole-3-acetic acid、Senecionine和Marmesin含量显著增加,分别增加4.31、0.21、0.29和0.81倍,而Cytisine含 量 则 减 少18%。与ST组相比,GT组中Ginsenoside Rg3、Ginsenoside Rg2和Cytisine含量显著增加,分别增加1.28、0.73和0.29倍,而Methyl indole-3-acetate、Indole-3-acetic acid、Senecionine和Marmesin含量显著减少,分别减少42%、36%、22%和38%。此外,HPLC测定的7种差异代谢物与代谢组学结果呈正相关关系,R2为0.7101。总 体 上,GinsenosideRg2、Ginsenoside Rg3、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin、Cytisine和Senecionine含量变化与代谢组学的结果一致(图5)。

图4 高效液相色谱法检测代谢物色谱图Fig.4 HPLC chromatograms of various metabolite
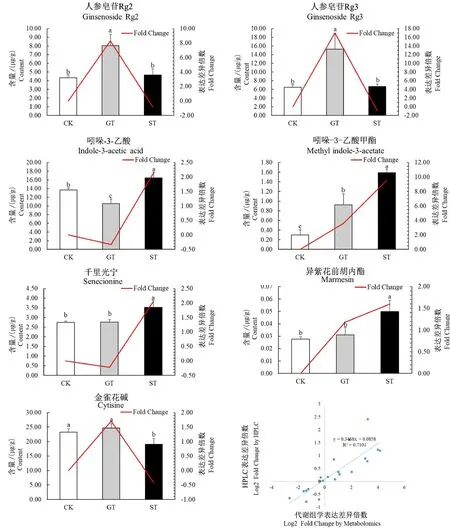
图5 差异代谢物与代谢组学相关分析Fig.5 Correlation analysis between differential metabolites and metabolomics
2.5 差异代谢物化感作用验证
以不同浓度的差异代谢物处理白菜种子,发现白菜种子的萌发受到明显影响(表4),与CK组相比,0.001 mg/m L和0.01 mg/m L Indole-3-acetic acid处理的白菜种子发芽率均表现出明显抑制作用,而Ginsenoside Rg3、Ginsenoside Rg2、Methyl indole-3-acetate、Marmesin、Cytisine和Senecionine处理的白菜种子萌发率则无显著变化;0.1 mg/m L Ginsenoside Rg3、Ginsenoside Rg2、Indole-3-acetic acid、Methyl indole-3-acetate和Senecionine处理的白菜种子萌发率均显著下降,分别降低18.33%、8.33%、26.67%、86.67%和23.33%,表明在0.1 mg/m L质量浓度下,这5种差异代谢物均能抑制白菜种子萌发。
表4 白菜种子萌发率及生长测定(±s)Table 4 Determination of germination rate and growth of cabbage seeds

表4 白菜种子萌发率及生长测定(±s)Table 4 Determination of germination rate and growth of cabbage seeds
注:不同小写字母表示处理间在P<0.05水平存在显著性差异。Note:Different small letters indicate significant difference among treatments at P<0.05 level.
指标Index质量浓度/(mg/m L)Mass concentration对照组CK人参皂苷Rg3 Ginsenoside Rg2人参皂苷Rg2 Ginsenoside Rg3异紫花前胡内酯Marmesin金雀花碱Cytisine千里光宁Senecionine吲哚-3-乙酸Indole-3-acetic acid吲哚-3-乙酸甲酯Methyl indole-3-acetate发芽率/% 0.001 100±0.00 a 98.33±2.89 a 98.33±2.89 a 100±0.00 a 98.33±2.89 a 100±0.00 a 86.67±2.89 b 95.00±5.00 a Germination rate 0.010 98.33±2.89 a 98.33±2.89 a 98.33±2.89 a 100±0.00 a 98.33±2.89 a 90.00±5.00 b 91.67±5.77 a 0.100 91.67±2.89 b 81.67±2.89 b 96.67±2.89 a 96.67±2.89 a 76.67±5.77 b 73.33±7.64 c 13.33±5.77 b根长/cm 0.001 5.17±0.37 a 2.37±0.13 b 3.02±0.31 b 0.63±0.03 c 5.93±0.39 A 3.35±0.18 b 4.08±0.25 b 4.47±0.29 b Root length 0.010 5.36±0.38 a 6.10±0.67 A 2.83±0.16 b 4.97±0.24 a 2.34±0.23 c 4.09±0.08 b 1.76±0.11 c 0.100 0.58±0.05 c 3.71±0.22 b 0.58±0.02 c 3.16±0.22 b 0.65±0.06 d 0.48±0.04 c 0.19±0.04 d茎长/cm 0.001 2.83±0.09 a 2.24±0.08 b 1.83±0.11 b 1.33±0.03 c 2.73±0.07 a 1.86±0.15 b 2.40±0.02 b 2.15±0.10 b Stem length 0.010 2.11±0.20 b 2.54±0.29 a 1.92±0.18 b 2.60±0.11 a 1.20±0.06 b 2.26±0.08 c 1.92±0.02 c 0.100 1.51±0.07 c 1.88±0.07 b 1.05±0.23 c 2.94±0.40 a 1.91±0.17 b 0.86±0.04 d 0.48±0.04 d
与CK组相比,0.001 mg/m L的Cytisine和0.01 mg/m L Ginsenoside Rg3处理能够促进白菜的根长增加,而0.1 mg/m L时,两种物质处理的白菜根长均被显著抑制,表现出明显的“低促高抑”现象。除0.01 mg/m L Ginsenoside Rg2无显著变化外,在3种质量浓度下,Ginsenoside Rg2、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin和Senecionine处理的白菜根长均被显著抑制,且质量浓度为0.1 mg/m L时,抑制效果最明显。此外,在3种质量浓度下,Ginsenoside Rg2、Ginsenoside Rg3、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin和Senecionine处理的白菜茎长均被显著抑制,只有0.01 mg/m L Ginsenoside Rg3和Cytisine无 显 著 变化。以上结果表明,7种差异代谢物对白菜的生长具有一定的化感抑制作用。
3 讨论
植物化感自毒作用是连作障碍产生的主要原因之一。西洋参代谢产物对植株产生的毒害作用可能是连作障碍的主要成因[9],西洋参在生长过程中通过根系向根际土壤中分泌次生代谢产物,这些代谢产物在土壤中不断积累,最终导致自毒作用的发生,重茬种植的自毒作用会更加严重。目前,研究发现这些代谢物质会引起土壤理化性质变化,进而引起微生物群落结构的变化;微生物群落可能会改变根系分泌物的降解并进一步影响土壤的理化性质,土壤性质的综合变化最终导致西洋参根病的发生[10-11]。连作西洋参根系分泌物、根际土壤微生物群落和土壤理化性质之间的作用关系需要进一步研究。要探明西洋参根系分泌物的自毒效应,首先必须对自毒物质进行提取分离与鉴定,在这个过程中,化感物质的活性会随着研究技术和操作过程的不同而变化,采用代谢组学筛选土壤差异代谢物,实现更全面、无偏性的高覆盖检测。
采用LC-MS非靶向代谢组学技术对蒸馏水、4 a生西洋参水提液及其根际土浸提液浇灌的西洋参幼苗栽培土进行分析,初步筛选出主要差异代谢物44种。这些差异代谢物大多为西洋参的次生代谢产物包括皂苷、生物碱、酮及黄酮、有机酸、萜、醇和香豆素等。通过HPLC对3个处理组的7种差异代谢物Ginsenoside Rg3、Ginsenoside Rg2、Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin、Cytisine和Senecionine的含量进行分析,验证其含量变化,发现7种差异代谢物含量变化规律与代谢组学一致。
正负离子两种模式下,皂苷类占比较高,人参皂苷是西洋参的主要次生代谢产物,多积累于西洋参根的韧皮部和周皮部及叶片中[12-13]。西洋参在生长过程中通过根系向根际土壤中分泌少量人参皂苷,在1999年至2002年间的5个不同时间采集加拿大安大略省德里基地的3 a生西洋参根际土壤,发现土壤人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1和F11的含量为提取土壤干质量的0.02%~0.098%,还发现人参皂苷可以促进根茎中腐霉菌的生长,同时抑制拮抗性非致病菌的生长[14]。研究发现,不同浓度的外源人参皂苷混合物及单体皂苷对人参种子萌发、幼苗根生长及根系抗氧化系统均具有抑制作用[15]。从4 a生西洋参中提取人参总皂苷,发现不同质量浓度(25、50、100 mg/L)人参皂苷粗提液处理后,西洋参幼苗表现出不同程度的低促高抑现象,高浓度处理影响西洋参幼苗根长、根系活力及根尖细胞的结构,导致西洋参幼苗早期不能正常生长,西洋参的皂苷成分能够影响自身胚根和幼苗的生长[16-17]。人参总皂苷对人参灰霉菌和人参黑斑菌的生长具有明显的促进作用[18]。3种不同的三萜皂苷单体对三七的种子萌发和幼苗生长均有不同程度的抑制作用[19]。三七通过残体腐解、根系分泌向土壤中释放皂苷等化感物质使三七根系组织死亡[20]。当地种植西洋参多采用和玉米轮作的方式来缓解连作障碍,卢玉秋等[21]采用HPLC检测玉米根际土壤中19种植物激素含量,测定Indole-3-acetic acid和Methyl indole-3-acetate的含量为1.85 ng/g和0.55 ng/g。本研究中西洋参栽培土壤的Indole-3-acetic acid和Methyl indole-3-acetate含量分别为10.50~16.48μg/g和0.30~1.59 μg/g,其含量较高可能是由于植物种类不同,所产生激素含量不同,也可能是由于西洋参土壤中某些微生物代谢产生,相反,连作西洋参土壤中Indole-3-acetic acid和Methyl indole-3-acetate的积累是否影响土壤微生物群落。从人参栽培土壤中分离出一种名为DCY116T的新型菌株,菌株DCY116T产生Indole-3-acetic acid、铁载体,并且能够溶解磷酸盐作为潜在的植物生长促进细菌[22]。从人参组织中分离出的细菌内生菌具有产生人参皂苷和生物活性代谢物的潜力,人参组织细菌内生菌通过Indole-3-acetic acid和铁载体产生,具有产生人参皂苷和生物活性代谢物的潜力,对人参的生长产生显著影响[23]。香豆素类是植物化感物质之一,Marmesin是香豆素类化合物,在前胡、当归和草药隔山香中均检测到了Marmesin[24]。本研究中,ST组的Marmesin含量显著高于对照组,且显著抑制白菜根和茎的生长,可能是西洋参连作障碍发生的潜在化感自毒物质。Cytisine是能够调节植物生长的生物碱。早期研究发现,苦豆草生物碱Cytisine等是一类植物次生代谢物质,对杨树生长具一定的促进作用。但是其作用与植物激素的作用有一定差异[25-26]。本研究中,ST组Cytisine含量显著下降,可能因此影响西洋参根的生长,进而导致西洋参幼苗死亡率升高。Senecionine为吡咯里西啶类生物碱,是一种天然毒素。本研究中,重茬土浸提液处理组中Senecionine含量显著高于对照组,且显著抑制白菜根和茎的生长,0.1 mg/m L时显著抑制白菜萌发。本研究中的Indole-3-acetic acid、Methyl indole-3-acetate、Marmesin、Cytisine和Senecionine在植物连作障碍研究中未见报道,后期需进一步深入研究。
综上所述,西洋参在重茬过程中通过根系分泌等方式导致土壤次生代谢物质积累,这些代谢物通过化感作用直接影响西洋参的生长,还会导致土壤理化性质和微生物群落改变进而影响西洋参的生长,这些差异代谢物可能是导致西洋参连作障碍发生的潜在化感物质,研究结果为西洋参及人参属的中药材乃至其他存在连作障碍的作物的相关研究提供参考。
