百合花香合成相关基因LiMCS的克隆、定位和表达特性研究
2022-11-02罗景琳王浩楠李迎迎冷平生胡增辉
张 茜,罗景琳,王浩楠,李迎迎,冷平生,胡增辉
(1.北京林木分子设计育种高精尖创新中心,北京 102206;2.北京农学院 园林学院,北京 102206)
释放花香是开花植物的重要特性。花香不仅在促进植物传粉和抵御外来侵害[1-2]等方面发挥着重要作用,而且作为植物重要的观赏性状之一,是评价植物观赏价值和经济价值的重要指标。花香由一系列低分子量次生代谢挥发物组成,主要包括萜烯类、脂肪族类、苯环类/苯丙烷类及一些含硫、含氮类等化合物[3-4]。深入了解花香合成调控机制能为开展植物花香育种及揭示花香生理生态功能提供理论支撑。
百合是世界著名的五大切花之一,因其气味芳香浓郁而具有极高的观赏和经济价值。百合花香的主要成分为萜烯类化合物,包括芳樟醇、罗勒烯和月桂烯等[5-6]。笔者的前期研究发现,不同品系百合的花香也存在明显差别[7],如浓香型的东方百合香气过于浓郁,而淡香型的亚洲百合的香味很弱,因此培育芳香适宜的百合新品种成为新的育种趋势。研究表明,萜烯合成途径活化水平不同是导致东方百合(浓香型)和亚洲百合(淡香型)香味差异的一个重要原因[8]。但目前对于百合萜烯合成调控机制尚未清楚解析。
萜类化合物是由异戊二烯(C5)基本单元组成,C5单元的合成前体物质为异戊二烯焦磷酸(isopentenyl pyrophosphate,IPP)。IPP的合成主要包括两条途径,分别是在细胞质中以倍半萜合成为主的甲羟戊酸(MVA)途径和在质体中以单萜合成为主的甲基赤藓糖醇磷酸(MEP)途径[9]。由于单萜类化合物是百合花香的主要成分,因此对MEP途径关键酶基因的功能解析成为实现百合花香合成调控的前提。近年来,对于MEP途径关键酶基因的研究越来越多,在金鱼草(Antirrhinum majus)[10]、百合、薰衣草(Lavandula angustifolia)[11]等植物中多个关键基因被克隆出来,并且部分基因也已被证明在单萜合成中起关键作用。在百合中,Li TPS、Li DXS、Li DXR、Li MCT等MEP途 径 基 因 已 被 克隆[12-14],表达模式和功能也逐渐被解析,但尚有多个基因未被鉴定。在MEP途径中,2-C-甲基赤藓糖醇-2,4-环焦磷酸合成酶(MCS)催化二磷酸胞苷-2-C-甲基-D-赤藻糖醇-2-磷酸(CDP-MEP)生成2-C-甲基-D-赤藻糖醇-2,4-环二磷酸(MEPcPP),是合成单萜的关键步骤。该基因已在长春花(Catharanthus roseus)[15]、盾叶薯蓣(Dioscoreazingiberensis)[16]、青 蒿(Artemisia annua)[17]等植物中相继被克隆出来,且在长春花、盾叶薯蓣和青蒿中都已被证明其对萜类物质合成具有重要作用。但MCS基因在百合中尚未被克隆,对其表达模式和功能还不清楚。
本研究选用东方百合‘西伯利亚’为材料,克隆Li MCS基因,通过生物信息学、荧光定量PCR(qRT-PCR)及亚细胞定位等,预测其特征及功能,并明确其表达模式,为揭示Li MCS基因在‘西伯利亚’百合单萜类物质合成中的作用和功能奠定基础。
1 材料与方法
1.1 试验材料
本试验选用的植物材料为‘西伯利亚’百合(Lilium‘Siberia’)实生苗,种球购自北京荷景良苑贸易有限公司,种植于北京农学院东大地(40°5′24″N,116°17′55″E)单坡面温室中。试验选取3株无病虫害、生长健壮、均高100 cm的植株,在不同的花期及在盛花期的不同器官和组织进行采样。采样分为花蕾期、半开期、盛开期和衰败期4个时期,在盛花期采集根、茎、叶、外花被片、内花被片、花药、子房、花柱、花丝的样品,每组样品设置3个重复。置于液氮中速冻,-80℃保存。
1.2 ‘西伯利亚’百合总RNA的提取及第一条链的合成
将样品在灭菌及用液氮遇冷过的研钵中进行研磨,直至样品研磨成粉末状。选用TransZol UP Plus RNA Kit试剂盒(TransGen Biotech,中国北京)提取‘西伯利亚’百合的总RNA。
用于基因克隆与q RT-PCR的cDNA第一条链合成分别选用TransScript One-Step gDNA Removal and cDNA Synthesis Super Mix(Trans-Gen Biotech,中国北京)与Evo M-MLV RT Premix for qPCR试剂盒(Accurate Biology,中国湖南),按照说明书进行,反应完成后将其置于-20℃冰箱中保存。
1.3 LiMCS基因的克隆及验证
基于前期测得‘西伯利亚’百合转录组数据[6],从中调取MCS基因,通过Snap Gene设计全长扩增引物(表1)。PCR扩增使用制备好的cDNA为模板进行,PCR反应体系为:上下游引物各1μL,cDNA模板1μL,2×A8 Fast HiFi PCR Master Mix 12.5μL,dd H2O 9.5μL,共25 μL的体系。PCR反应条件为:95℃预变性3 min,95℃变 性10 s,55℃退 火15 s,72℃延 伸20 s,进行35个循环,最后72℃延伸5 min。将扩增产物利用琼脂糖凝胶电泳实验进行验证。随后使用50μL体系进行PCR扩增,将产物使用Easy Pure Quick Gel Extraction Kit(TransGen Biotech,中国北京)进行回收纯化,纯化后的DNA片段置于-20℃冰箱中保存,备用。
将得到的目的片段连接至Pclone 007载体上,转化至大肠杆菌DH5α(Escherichia coli)菌株,挑取阳性克隆,扩大培养后,用菌液PCR的方式进行初步验证,选取符合要求的菌液送至华大基因公司进行测序。
1.4 LiMCS生信分析
使用生物信息学技术对‘西伯利亚’百合Li MCS相关生物信息进行分析预测(表2)。
表2 ‘西伯利亚’百合Li MCS基因生物信息预测软件及网站Table 2 Software and website for predicting the biological information of Li MCS
1.5 Li MCS的亚细胞定位
将LiMCS终止子去除后,使用Nimble Cloning[18]的通用接头序列设计引物G-Li MCS-F、G-LiMCS-R(表1),以LiMCS质粒为模板以50 μL体系进行PCR扩增,同时使用2×Seam Less Mix酶切载体p NC-Green-Sub N,将两个产物分别回收纯化后进行同源克隆,构建p NC-Green-Sub N-LiMCS载体,送华大基因测序。测序结果比对成功后将其转入农杆菌感受态GV3101中,使用注射法侵染烟草叶片,在激光共聚焦显微镜下进行观察。

表1 ‘西伯利亚’百合Li MCS基因克隆、亚细胞定位和表达分析引物序列Table 1 Primers for gene cloning,subcellular localization and expression analysis of Li MCS
1.6 LiMCS的时空表达分析
根据克隆得到的Li MCS基因,利用Snap-Gene设计该基因的荧光扩增引物(表1)。以90~100 ng用于qRT-PCR的cDNA作为反应模板配制反应溶液,再加入上下游引物各0.4μL,2×SYBR Green ProTaqHS Premix 10μL,最后使用RNase free water定容至至20μL,随后将配制好并混匀的反应溶液置于荧光PCR仪(Bio-Rad-iQ5)中进行qRT-PCR分析。将得到的数据依据 相 对 表 达 量 公 式2-ΔΔCt并 使 用iQ5、Microsoft Excel和SPSS等软件对Li MCS基因在‘西伯利亚’百合中时空表达的试验结果进行计算分析。
2 结果与分析
2.1 ‘西伯利亚’百合Li MCS的克隆
从全长Li MCS基因的电泳图(图1)可以看出,克隆的片段为500~750 bp,随后将其产物回收纯化,与Pclone007载体链接并转化到DH5α上,经菌落PCR验证后送往华大基因公司进行测序,将结果与转录组中的基因进行序列比对,以此确定Li MCS的最终序列。
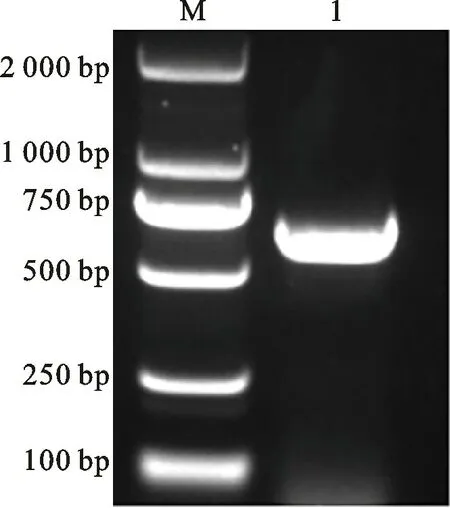
图1 ‘西伯利亚’百合Li MCS基因全长电泳扩增Fig.1 Agarose gel for amplification of full length of LiMCS gene
2.2 Li MCS核苷酸和氨基酸序列分析
2.2.1Li MCS核苷酸序列及其编码蛋白保守结构分析 使用NCBI网站中的Open Reading Frame Finder功能,确定Li MCS最大的开放阅读框为669 bp,利用DNAMAN软件将其翻译成氨基酸序列(图2)。LiMCS蛋白是由222个氨基酸构成,属于2-C-甲基-D-赤藻糖醇-2,4-环二磷酸 合 酶(2-C-methyl-D-erythritol-2,4-cyclodiphosphate synthase(MECDP))超家族(图3)。

图2 ‘西伯利亚’百合LiMCS基因核苷酸序列以及其氨基酸序列Fig.2 The nucleotide and amino acid sequence of Li MCS gene

图3 ‘西伯利亚’百合LiMCS蛋白保守结构Fig.3 The conserved domains of Li MCS
2.2.2 LiMCS氨基酸序列同源性比对及系统进化树构建分析 使用NCBI中的Blast和DNAMAN软件将LiMCS与其他植物MCS氨基酸序列的同源性进行比对,发现其与盾叶薯蓣DiMCS的相似度极高,与芝麻(Sesamum indicum)Se MCS、海枣(Phoenix dactylifera)Ph MCS、毛果杨(Populus trichocarpa)Po MCS、椰子(Cocos nucifera)Co MCS、油 棕(Elaeisguineensis)Ela MCS、香蕉(Musa acuminata)Mu MCS、荸荠(Eleocharis dulcis)Ele MCS等植物MCS蛋白的相似度较高(图4)。为了进一步研究‘西伯利亚’百合Li MCS与其他植物的MCS同源基因的系统进化关系,使用MEGA7.0软件构建LiMCS与其他植物的MCS氨基酸序列的进化树(图5),发现其与盾叶薯蓣同源性最高并形成一个小亚群,和荸荠、香蕉、海枣、椰子和油棕等植物的亲缘性较近。

图4 LiMCS基因编码的氨基酸序列与其他植物同源性比对Fig.4 The homology comparison between amino acid sequences encoded by Li MCS gene and MCS in other plants
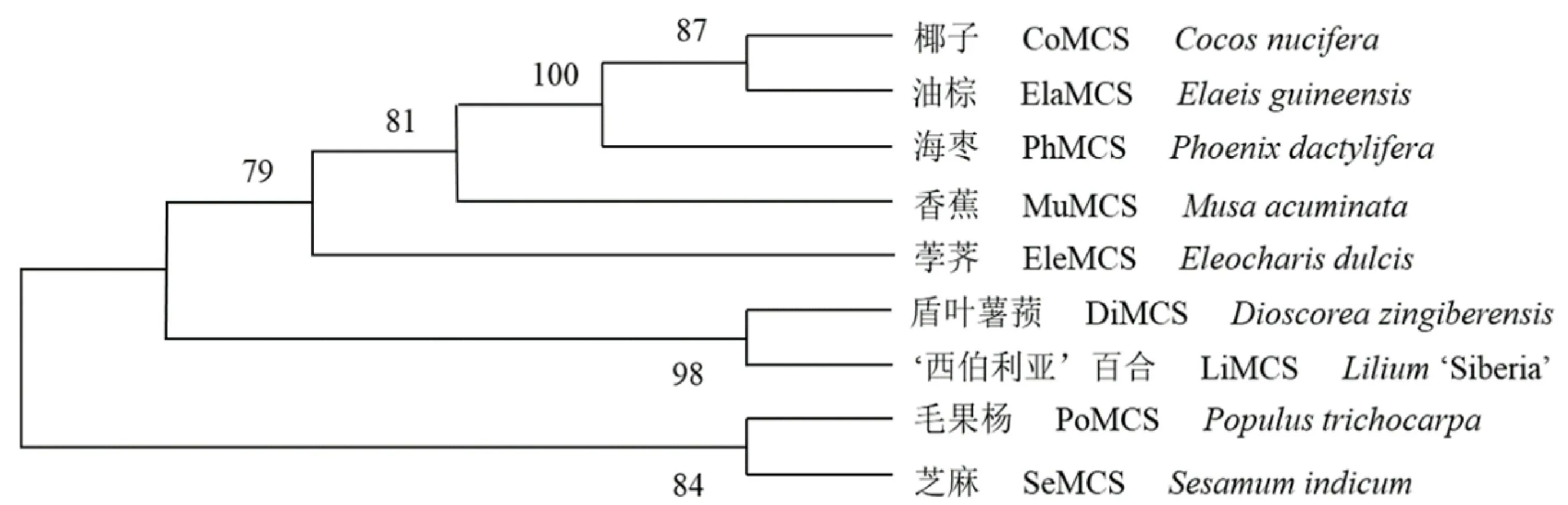
图5 ‘西伯利亚’百合Li MCS基因编码氨基酸序列的系统进化树Fig.5 Phylogenetic tree of amino acid sequence encoded by LiMCS gene
2.2.3 ‘西伯利亚’百合LiMCS蛋白理化性质利用Ex PASy-ProtParam在线工具对Li MCS蛋白的理化性质进行预测,该基因共编码222个氨基酸,其中含量最高的为亮氨酸(Leu),占13.5%;其次是丙氨酸(Ala)、脯氨酸(Pro)和丝氨酸(Ser),分别为11.3%、11.3%和9.0%,其正电残基数(Asp+Glu)与负点残基数(Arg+Lys)分别为21和23,为亲水性不稳定蛋白(表3)。

表3 ‘西伯利亚’百合Li MCS蛋白理化性质分析Table 3 Physical and chemical properties of Li MCS protein
2.2.4 LiMCS二级和三级结构分析 利用NPSA-PRABI在线软件对LiMCS蛋白二级结构进行预测,发现其由70个α-螺旋(alpha helix,Hh)、28个 延 伸 链(extended strand,Ee)、9个β-转角(beta turn,Tt)及115个无规卷曲(random coil,Cc)组成(图6)。由二级结构卷曲折叠形成Li MCS的三级结构模型,以2pmp.1.A(拟南芥异戊二烯生物合成途径中2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶的结构)为模板,二者相似度高达89.31%,相似度大于60%被认为非常准确,其中序列覆盖率为72%,C-β相互作用值为2.54(图7)。
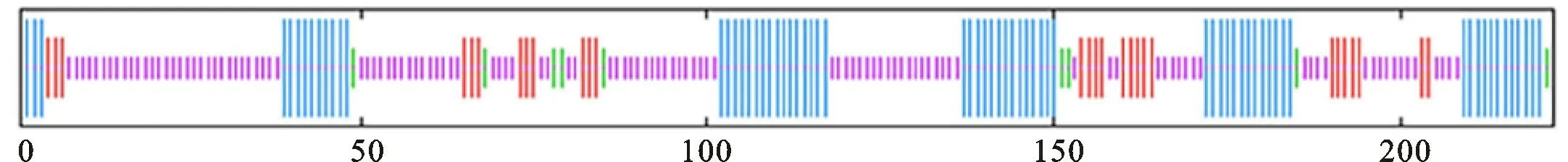
图6 ‘西伯利亚’百合LiMCS蛋白质二级结构的预测Fig.6 Prediction of secondary structure of Li MCS
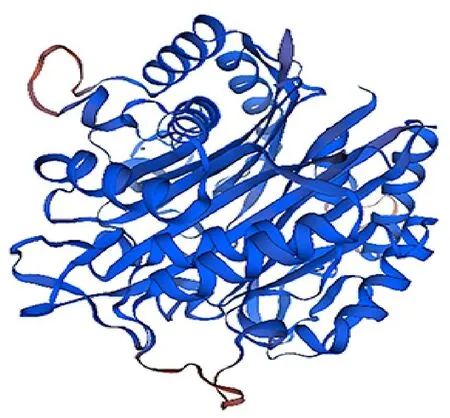
图7 ‘西伯利亚’百合LiMCS蛋白质三级结构的预测Fig.7 The prediction of tertiary structure of Li MCS
2.2.5 Li MCS蛋白信号肽和跨膜结构预测分析
利用信号肽预测网站对LiMCS进行蛋白质信号肽的预测,发现该蛋白不含信号肽(图8)。随后,又使用跨膜信息预测网站预测该蛋白的跨膜结构,发现该蛋白不含跨膜结构(图9)。由以上结果推断,该蛋白不属于信号蛋白。2.2.6 Li MCS蛋白磷酸化位点预测分析 通过在线软件Net Phos 3.1 Server对‘西伯利亚’百合Li MCS蛋白磷酸化位点进行预测,发现该蛋白可能含有20个丝氨酸、4个苏氨酸和1个酪氨酸(图10)。
图8 ‘西伯利亚’百合LiMCS蛋白质信号肽预测Fig.8 Protein signal peptide prediction of LiMCS
图9 ‘西伯利亚’百合LiMCS蛋白质跨膜螺旋预测Fig.9 Transmembrane prediction of LiMCS
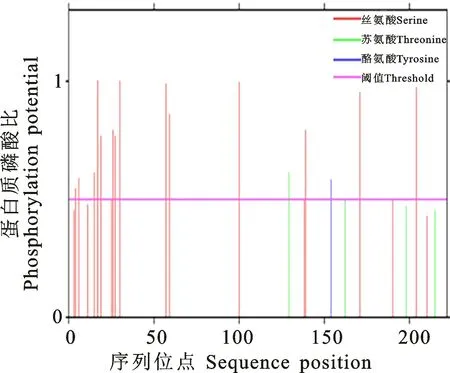
图10 ‘西伯利亚’百合LiMCS蛋白磷酸化位点预测Fig.10 Prediction of protein phosphorylation sites of Li MCS
2.3 Li MCS亚细胞定位分析
图11显示LiMCS亚细胞定位的结果,通过激光共聚焦显微镜观察发现融合蛋白与叶绿体荧光场重合,说明其蛋白特异性定位于叶绿体中。
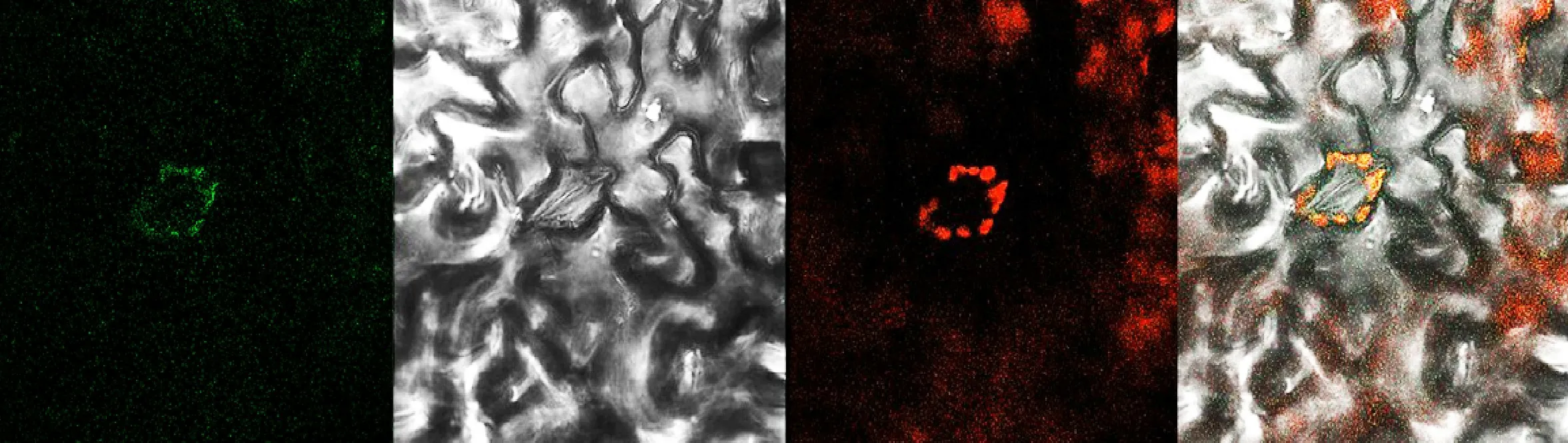
图11 ‘西伯利亚’百合LiMCS亚细胞定位Fig.11 Subcellular localization of Li MCS
2.4 LiMCS时空表达模式分析
Li MCS在百合中的时空表达模式显示(图12),Li MCS的表达量随着百合花的发育整体呈现先升高后降低的规律。在半开期Li MCS基因的表达量达到顶峰,其次为盛开期与衰败期,花蕾期表达量最低,仅为半开期的1/3。
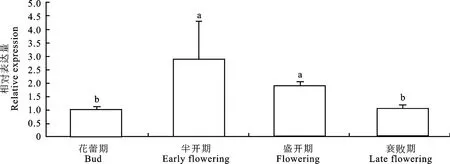
图12 ‘西伯利亚’百合Li MCS在不同花期的表达分析Fig.12 Expression analysis at different flowering stages of Li MCS
‘西伯利亚’百合Li MCS基因在不同器官和组织中的表达量也不相同(图13)。Li MCS基因在花器官中的表达总和远远大于根、茎、叶,占总量的4/5,而花瓣中的表达量占总量的1/2。Li MCS在外瓣中表达量最高,内瓣其次,叶中表达量仅次于花瓣。
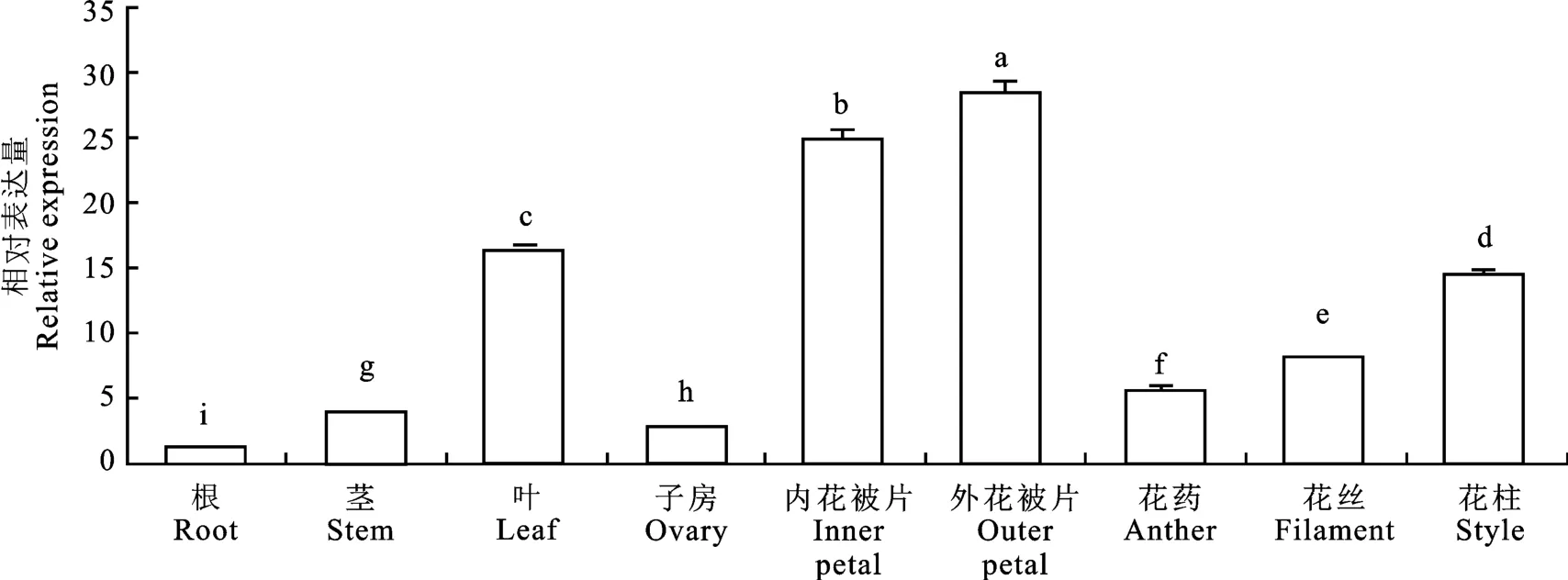
图13 ‘西伯利亚’百合盛开期Li MCS在不同器官和组织的表达分析Fig.13 Expression analysis in different plant organs and tissues of LiMCS in the flowering stage
3 讨论
单萜类化合物是‘西伯利亚’百合花香的主要组成物质。MCS是植物单萜物质合成途径中催化第五步反应所需的酶,该途径的产物可以催化生成单萜类化合物的合成前体物质IPP。因此,MCS基因的克隆及其功能的挖掘,能为‘西伯利亚’百合花香单萜类挥发物的合成及调控机制的研究提供依据。通过对一系列结构基因的克隆,不断深入花香调节机制的研究,从而实现花香的人为调控及后续的育种工作。本研究克隆出了‘西伯利亚’百合中的Li MCS基因,并通过生物信息学技术对其编码蛋白的理化性质、结构功能进行了预测和分析,同时明确了其表达位置及表达模式。
通过氨基酸序列比对分析,得知LiMCS与盾叶薯蓣dz MCS具有较高的同源性。在盾叶薯蓣中,通过构建dz MCS基因的大肠杆菌表达载体,最终加强了大肠杆菌的MEP途径,尤其促进了胡萝卜素的合成与积累[16]。同时,Li MCS具有保守结构域,表明该基因编码的蛋白是具有生物功能的蛋白,为Li MCS基因的功能研究提供了理论依据。Li MCS基因编码的蛋白质定位于烟草叶片表皮细胞的叶绿体中,这与单萜在质体中经MEP途径合成相一致。‘西伯利亚’百合花香由花蕾期开始积累,在盛开期达到顶峰[19],而Li MCS基因主要在半开期表达量最高,推测该基因作为MEP途径上游基因,在半开期进行了大量的转录积累,逐步合成下游单萜产物,最终在盛花期花香得到大量释放。该基因主要在花瓣中发挥作用,这与‘西伯利亚’百合MEP途径中上游Li DXS基因、Li DXR基因和下游单萜合酶Li TPS基因的表达模式基本吻合[12-13]。目前,MCS基因在部分植物中已有研究。长春花MCS基因的过表达,增加了单萜吲哚生物碱的含量,这表明增加MCS基因的表达将有助于代谢向下游流动[15]。将青蒿Aa MCS基因在拟南芥中超表达,类胡萝卜素、叶绿素a和叶绿素b含量显著增加[17]。这些研究都表明MCS基因在萜烯类物质合成中起重要作用。
Li MCS基因的克隆不仅扩充了百合的基因库,为今后花香调控相关的基因工程研究提供目的基因,还为萜烯类合成释放分子机制的深入探究奠定了基础。但本研究仅阐述了该基因相关的理化性质和表达模式,缺乏关于Li MCS基因调节‘西伯利亚’百合花香合成机制的研究,后续将会使用病毒诱导的基因沉默(VIGS)、瞬时过表达、启动子克隆等分子生物学技术对Li MCS基因的功能展开更深入的探究,最终明确Li MCS基因在‘西伯利亚’百合花香合成中的作用机制。
