ASIP基因编辑细毛羊自然突变和编辑基因型的遗传研究
2022-11-02张雪梅蒋晓梅刘明军
张雪梅,韩 冰,蒋晓梅,刘明军
(新疆畜牧科学院 生物技术研究所,农业农村部草食家畜遗传育种与繁殖重点实验室,新疆动物生物技术重点实验室,乌鲁木齐 830026)
在绵羊品种改良和遗传育种进程中,毛色作为品种的重要特征,在确定杂交组合、品种纯度及亲缘关系鉴定等方面发挥着重要作用。动物毛色遗传研究是动物表型变化遗传机理研究的最好模型[1]。哺乳动物毛色由多个基因决定,不仅单个基因在发生突变后可影响毛色形成;而且多个基因通过相互作用也能控制毛色形成[2],最终由控制毛色的各个候选基因共同作用形成各种单色毛和复色毛。
自第一个毛色基因TYRP1在小鼠中被克隆到现在[3],已被发现有170多个毛色相关基因在不同发育阶段调控毛色的产生。在哺乳动物中,黑色素形成的调控机制比较复杂,从黑色素细胞的分化、成熟到黑色素合成、转运过程需要多个基因参与调控[4]。毛发和皮肤的基本毛色是由真黑色素和褐黑素的比例和分布决定的[5]。Agouti基因作为控制动物毛色的重要基因之一,通过竞争性结合α-促黑色素细胞激素,抑制酪氨酸酶相关基因表达,导致真黑色素合成减少,褐黑色素合成增加,抑制或减少ASIP基因表达能够逆转真黑素和褐黑素比例从而改变动物毛色[6]。绵羊具有白色、红棕色、灰色、黑色等多种毛色[7]。以往的研究表明,绵羊显性白色表型与ASIP基因拷贝数变异和ASIP基因表达下调相关。在一些绵羊品种中,白色被毛是由于ASIP基因的190 kb串联重复,如澳大利亚美利奴羊。在美利奴羊中,ASIP基因本身存在的自然缺失突变类型很早就有记载。ASIP基因外显子2上5 bp碱基的缺失导致转录框移码随后在第63位氨基酸翻译提前终止,这被认为是黑色被毛羊的隐性突变[8]。同样地,ASIP基因外显子2上9 bp碱基的缺失导致三肽丢失,可能影响转运前导序列的功能,这被认为是黑色被毛羊的一个因果突变[9]。
随着近几年分子遗传学和生物新技术的蓬勃发展,新技术、新成果在绵羊育种领域也得到广泛应用,不仅突破了传统育种无法解决的遗传难题,而且实现了对特定性状的改变,大大提高了绵羊品种遗传改良的速度[10]。在动物个体上利用新型基因编辑技术进行分子育种,可在较短时间获得基因修饰动物个体,再利用纯合子动物个体进行人工授精或自然交配实现群体逐步扩繁,通过短短2~3代就可以建立起一定规模的稳定遗传家系,与杂交育种相比能够极大地缩短育种时间,降低育种成本[11]。目前报道的关于哺乳动物毛色遗传学和生物学方面的研究,主要聚焦于全基因组学或编码区上的SNP突变位点遗传标记方面的研究[12],但对于ASIP基因自然缺失突变和编辑修饰的遗传学研究尚未见深入报道,因此本研究以F0、F1代ASIP基因编辑细毛羊为研究对象,开展ASIP基因编辑羊自然突变和编辑基因型遗传特征和规律的研究,为加速新疆细毛羊毛色性状的选择进程、加快细毛羊毛色育种进展提供一定的理论依据。
1 材料与方法
1.1 样品采集
在新疆畜牧科学院中-澳绵羊繁育基地选取具有不同毛色的ASIP基因编辑细毛羊包括F0代(6只)和F1代(23只)个体,用无菌剪刀、镊子剪取羔羊小块尾部皮肤组织放入离心管投于液氮罐带回实验室,置于-20℃低温冰箱保存,以备基因组DNA的提取。
1.2 杂交亲本与杂交模式
课题组前期利用CRISPR/Cas9基因编辑技术对中国美利奴细毛羊ASIP基因进行编辑修饰后,获得了具有不同毛色表型的F0代基因编辑羊,分别将具有深棕色毛色表型的F0代基因编辑公羊与19只白色表型野生型母羊、具有深色斑点表型的2只F0代基因编辑母羊与白色野生型公羊配种,分别获得具有白色和深棕色毛色表型的后代21只、2只,共计23只F1代个体。
1.3 毛色记录
记录亲本毛色和各杂交组合的后代毛色,大致分以下几种毛色类型,分别为周身黑而头顶白、周身棕腹部浅、黑白花、棕白花、全白,因具有黑/棕白花等毛色个体数量较少,故文章中将上述毛色分为两大类:白色(全白)和非白色(全白色以外的其他毛色)。
1.4 主要试剂
组织DNA提取试剂盒、RNase、PCR产物纯化试剂盒均购自北京天根生化科技有限公司;p MD19-T载 体、T4连 接 酶、150 bp、1 000 bp DNA marker均购自宝生物工程(大连)有限公司;2×EasyTaqPCR Super Mix购自北京全式金生物技术有限公司;琼脂糖购自Life Technologies公司。
1.5 试验方法
1.5.1 引物设计与合成 按照NCBI数据库中
发布的绵羊ASIP基因序列(登录号为:NC_019470),采用Oligo 7.0软件针对绵羊ASIP基因外显子2序列设计特异性引物用于扩增ASIP基因426 bp长度的编码区,引物相关信息详见表1,引物由生工生物工程(上海)股份有限公司合成。
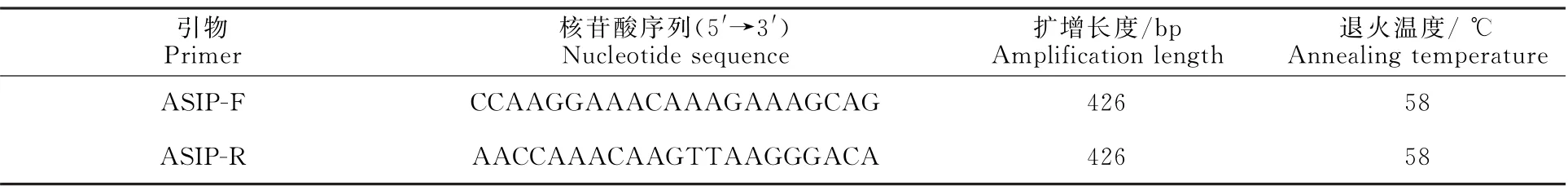
表1 引物名称、引物序列、扩增片段大小和最佳退火温度Table 1 Primer,sequence,amplified fragment size and optimum annealing temperature
1.5.2 基因组DNA提取 用TIANamp Genomic DNA Kit试剂盒(北京天根)提取绵羊尾组织基因组DNA,实验操作严格按照说明书进行,提取好的DNA用0.8%的琼脂糖凝胶电泳检测,Nanodrop超微量分光光度计测定DNA浓度,将检测合格的DNA稀释至100 ng/μL,存于-20℃低温冰箱。
1.5.3 PCR扩增与DNA测序 PCR反应总体系为50μL,包括2×PCR Master Mix 25μL,模板DNA 100 ng,上、下游引物(浓度10μmol/L)各1μL,灭菌超纯水补足至50μL。PCR扩增条件如下:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环;最后72℃延伸10 min。PCR产物经2%琼脂糖电泳检测合格后送生工生物工程(上海)股份有限公司测序。
1.5.4 序列比对和同源性分析 样品测序结果用Chromas和Clustalx软件进行序列比对分析,用Primer Premier 5.0软件翻译编码区氨基酸。1.5.5 克隆测序 根据DNA测序比对结果,将具有重叠峰样本的PCR扩增产物与p MD19-T载体连接,转化DH5α感受态细胞,挑取克隆摇菌进行单克隆测序。每个样本随机选取至少50个菌落,用M13引物进行测序,最后将样品测序结果与野生型序列进行比对鉴定确定发生编辑的情况。
2 结果与分析
2.1 F0、F1代个体编辑位点的检测和编辑基因型分析
根据上述设计的引物分别对6只F0代、23只F1代羔羊基因组进行扩增,经2%琼脂糖凝胶120 V电泳10 min检测显示在约426 bp处出现清晰条带,电泳示意结果见图1-A,B。
将PCR产物纯化后送测序,通过Sanger测序法分析F0代个体以及由F0代公羊与野生型母羊配种获得的F1代不同毛色绵羊个体的基因型,将测序结果进行比对,结合Chromas软件观察测序的峰图,确定基因的插入、缺失和删除情况。结果显示5只F0代、17只F1代共计22只个体的测序峰图在PAM序列附近都出现了杂乱的双/套峰且序列紊乱无序,其余7只个体的测序峰图均为单一峰,序列有序且与野生型序列一致。将发生双/套峰样品经3%琼脂糖凝胶90V电泳50 min后显示在目的条带附近出现2~3条带,说明靶点DNA序列存在突变,表明上述22只绵羊发生了ASIP基因编辑(图1-C)。
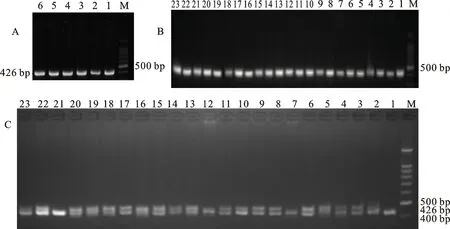
图1 ASIP基 因PCR扩增结果Fig.1 Result of PCR amplification of ASIP gene
PCR测序结合T-A克隆测序结果表明,5只F0代非白色毛色绵羊中共鉴定出11种插入/缺失编辑形式,主要的编辑基因型有5种,其中F0代4只母羊主要有2种基因型:4 bp(~153-156,TATC)碱基缺失和2 bp(~154-155/155-156,AT/TC)碱基缺失,2种基因型在F0代4只母羊中所占比例分别为45%和29.5%;F0代仅有的1只公羊TG110主要有3种基因型:4 bp(~153-156,TATC)碱基缺失、27 bp(~136-160且跨越3个内含子ATTTCCCTTCTGTCTCTATCGTGGGTA))碱基缺失和5 bp,12 bp(~153-154,TCCTC;~154-155,TGTTCCCTTCTG)碱基插入,3种基因型在F0代公羊中所占比例分别为29%、29%和24%。而且,每只编辑绵羊至少发生了2种修饰,即使是具有相似编辑修饰的羔羊,也表现出不同的毛色图案。
获得的17只F1代基因编辑羊个体中有5只个体的基因型为4 bp碱基缺失;有5只个体的基因型为27 bp碱基缺失和1 bp碱基插入;有3只个体的基因型为5 bp,12 bp碱基插入;有2只个体的基因型为21 bp(~142-160且跨越3个内含子,CTTCTGTCTCTATCGTGGGTA)碱基缺失和+2 bp(~154-155,AA)碱基插入(表2)。由F0代母羊与野生公羊配种获得的2只F1代不同毛色基因编辑羊个体的基因型均为2 bp(~154-155,AT)碱基缺失。综上所述,F1代基因编辑羊主要有4种基因型,分别是4 bp碱基缺失、5 bp,12 bp碱基插入、27 bp碱基缺失伴随1 bp碱基插入及2 bp碱基缺失为主要编辑类型,在F1代个体中所占比例分别为42.80%、36.00%、23.33%和37.00%,上述4种主要基因型测序结果见图2。总体来说,F0代的几种主要基因型基本稳定遗传给F1代个体。
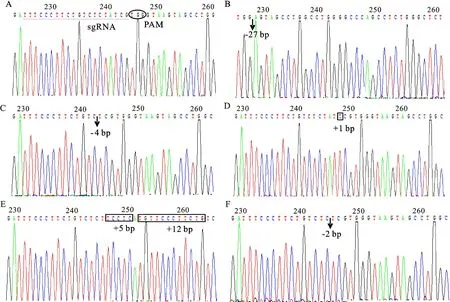
图2 ASIP基因编辑基因型分析Fig.2 ASIP gene editing genotype analysis
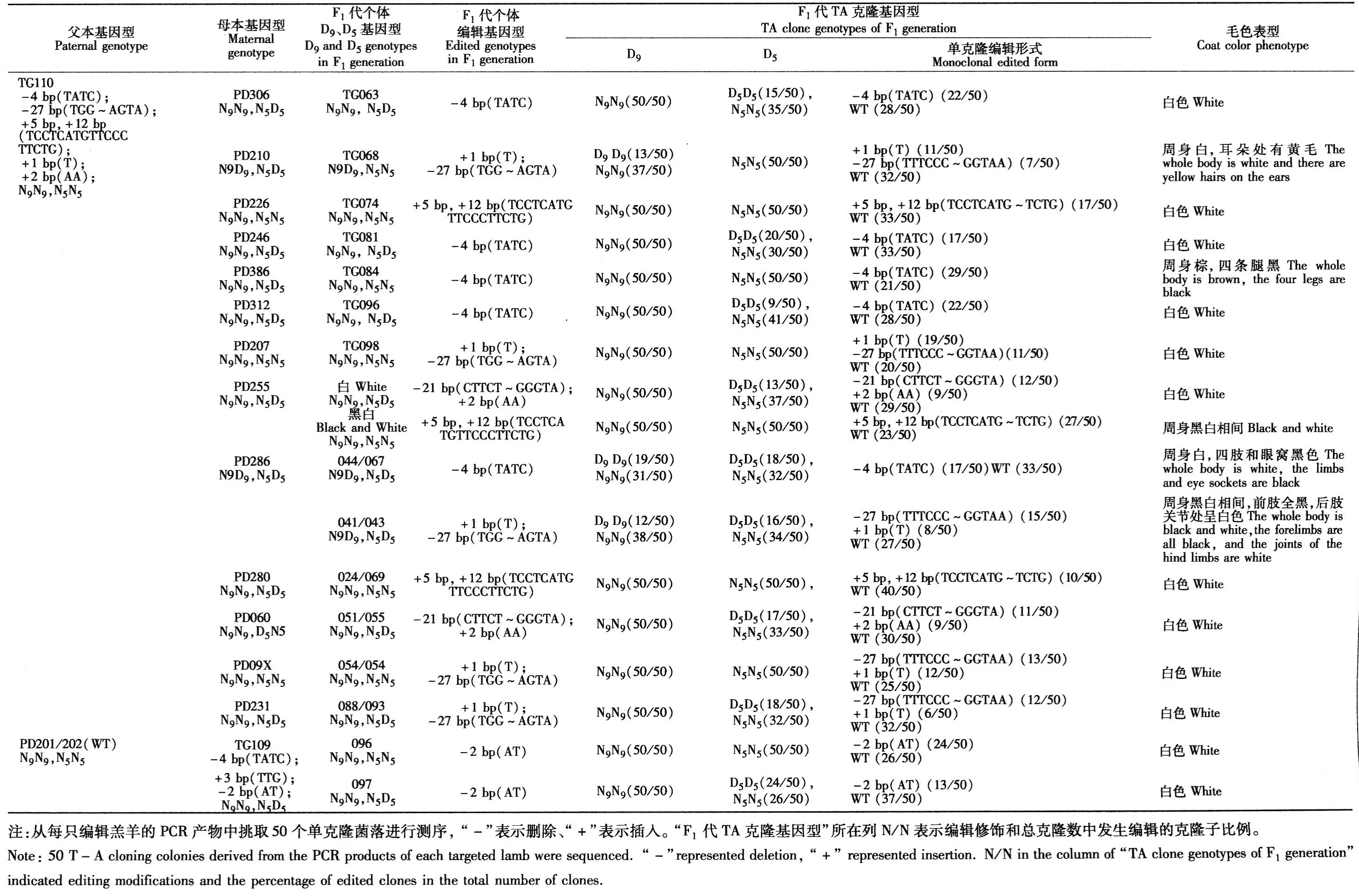
表2 F1 代基因编辑羊基因型和毛色表型结果Table 2 The results of sheep genotypes and coat color phenotypes in F1 gene edited sheep
进一步分析发现,4 bp碱基缺失、2 bp碱基插入、5 bp,12 bp碱基插入、2 bp碱基缺失和1 bp碱基插入导致读码框分别在第54位、56位、61位、65位和66位氨基酸处发生提前终止,导致产生一个个被截短的ASIP蛋白。而27 bp碱基缺失和21 bp碱基缺失发生在exon2和intron2的外显子/内含子交界处,可能会破坏ASIP转录的剪接(图3)。

图3 F1代基因编辑羊的自然突变和sgRNA/Cas9靶向修饰示意图Fig.3 Natural mutation and Schematic diagram of targeted modification of sgRNA/Cas9 in F1 gene edited sheep
2.2 F0、F1代个体自然突变(D9和D5)的基因分型及与毛色关系研究
由图4可知,PCR产物测序在鉴定编辑基因型的同时也检测到ASIP基因外显子2区域的2个缺失突变,9 bp碱基缺失的2个等位基因分别标记为N9(g.10-18/AGCCGCCTC)和D9(deletion);5 bp碱基缺失的2个等位基因分别命名为N5(g.100-104/AGGAA)和D5(deletion)。由于自然突变造成的D9、D5自然突变在sg RNA靶点之前,以及绵羊ASIP基因组上190 kb的串联重复造成的ASIP基因重复,仅对PCR产物进行测序很难确定CRISPR/Cas9编辑的准确基因型,因此需要进一步通过T-A克隆测序验证。
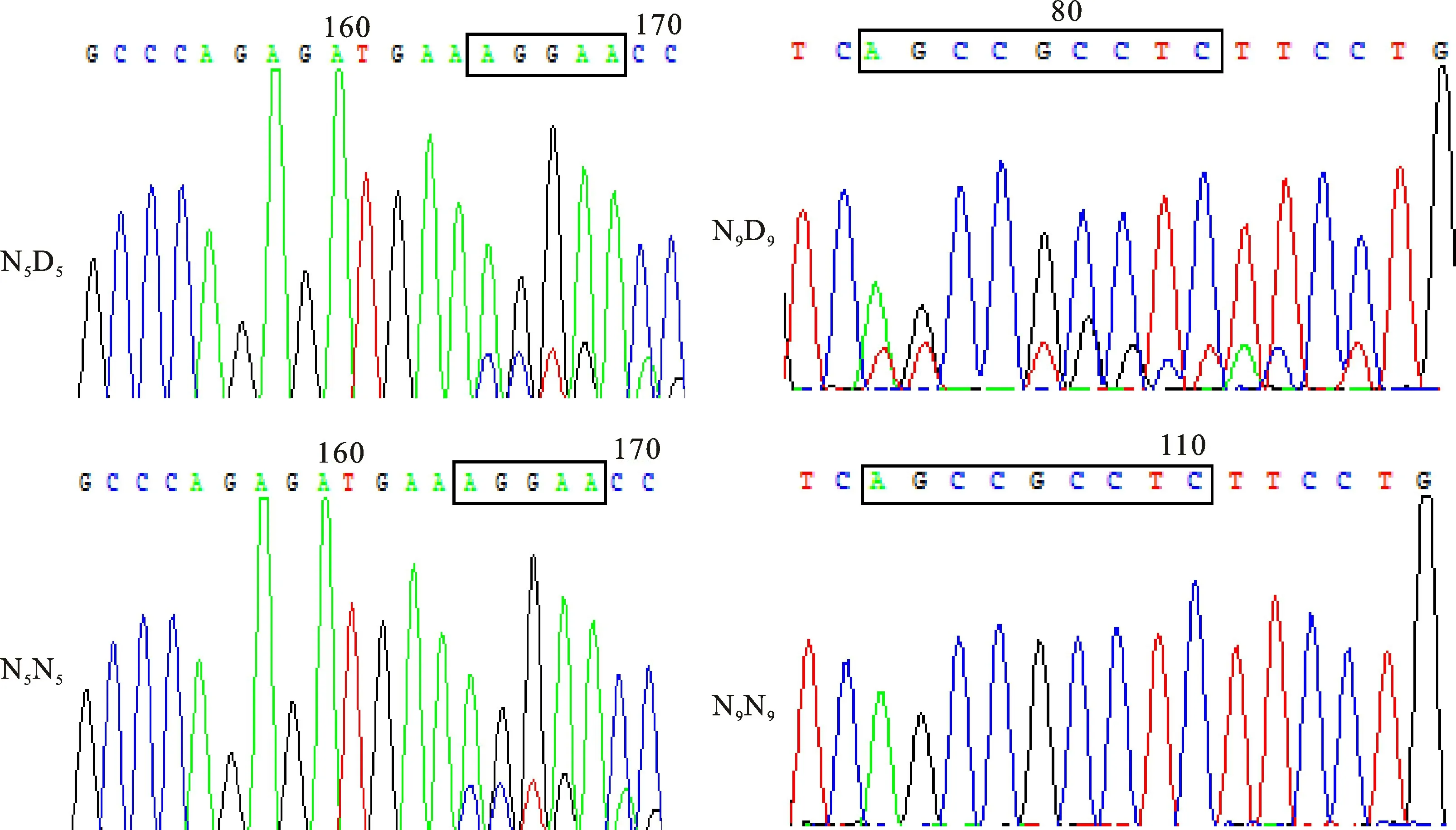
图4 ASIP基因第2外显子自然缺失突变测序结果Fig.4 Sequencing results of natural deletion mutation in exon 2 of ASIP gene
以往的研究发现,在一些绵羊品种中D9和/或D5的自发突变频率较高[5]。因此,通过对基因编辑羊个体进行D9和D5缺失(D为突变,N为野生型)突变的基因型分析,结果表明F0、F1代基因编辑羊都存在D5和D9缺失突变等位基因。5 bp碱基缺失突变位点内,5只F0代基因编辑羊个体中3只具有N5D5杂合基因型,2只具有N5N5纯合基因型;17只F1代基因编辑羊个体中9只具有N5D5杂合基因型,8只具有N5N5纯合基因型。9 bp碱基缺失突变位点内,5只F0代基因编辑羊个体中1只具有N9D9杂合基因型,4只具有N9N9纯合基因型;17只F1代基因编辑羊个体中3只具有N9D9杂合基因型,14只具有N9N9纯合基因型(表3)。总体来说,F0、F1代基因编辑羊在2个缺失突变位点上仅存在纯合基因型(包括N5N5,N9N9)和杂合基因型(包括N5D5,N9D9),未检测到2个缺失突变位点同时存在的个体。正如张恒等[6]先前报道的结果,在D9或D5中,白色美利奴羊的这2种缺失都不是纯合的。
本试验同时筛查了基因编辑羊的母本、父本及F1代本身的缺失突变基因型,发现父母本的缺失突变基因型发生分离且稳定遗传给了F1代。此外,F0代、F1代基因编辑羊和F1代母本(野生母羊)的ASIP基因第2外显子9 bp碱基缺失突变位点内,都以纯合基因型N9N9为优势基因型;5 bp碱基缺失突变位点内,F1代母本(野生母羊)以杂合基因型N5D5为优势基因型,而F0代、F1代基因编辑羊个体的纯合基因型N5N5和杂合基因型N5D5数量相差不大(表3)。
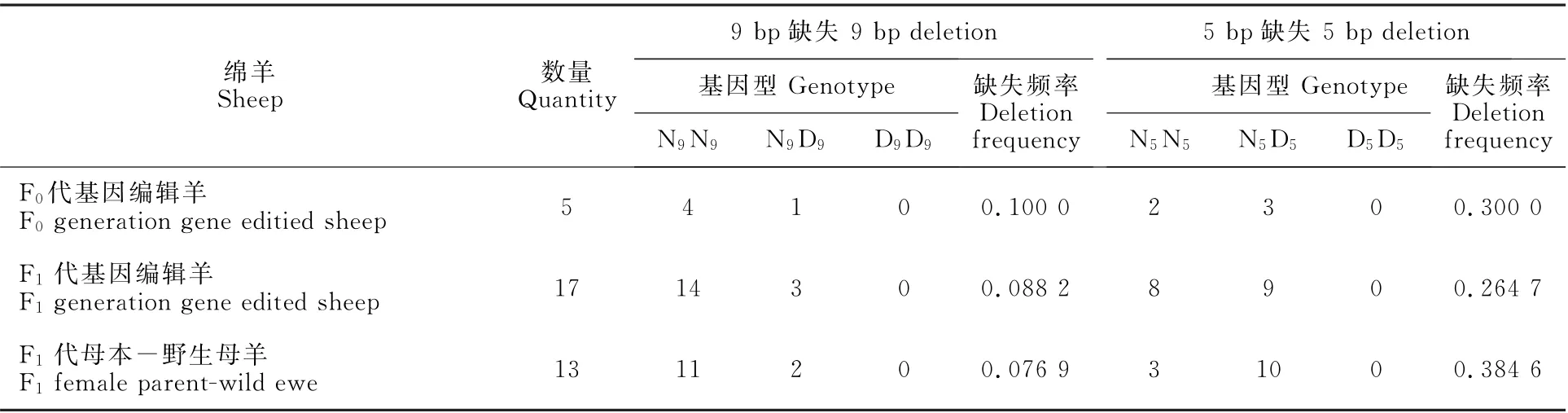
表3 ASIP基因自然缺失突变在F0、F1代 基因编辑细毛羊的基因型和频率Table 3 Genotypes and frequencies of natural deletion mutations of ASIP gene in F0 and F1 gene edited sheep
2.3 ASIP基因突变与毛色表型的相关性分析
在6只出生的羔羊中,5只羔羊鉴定出11种插入/缺失编辑形式。每只编辑羔羊至少发生2种修饰,并且发生多种修饰的编辑羔羊也呈现不同的毛色图案,其中主要编辑形式4 bp碱基缺失的3只羔羊中,2只羔羊毛色图案为周身黑色,头顶部有白色斑点;另一只羔羊毛色为周身棕色、腹部浅色的图案。另2只黑白斑点图案的羔羊其编辑形式主要为2 bp碱基缺失。
由表4可知,将具有毛色表型的F0代公羊与野生型母羊配种,获得了15只杂交F1代基因编辑羊,10只均为周身白色。其中1只周身白,耳朵处有杂毛,2只后代黑白相间,1只后代周身棕、蹄黑、头部白,1只个体后代四肢黑色,周身白,眼窝黑色。上述有毛色表型的杂交F1代个体与F0代公羊表型相似度较高,而且F1代同窝个体也并不一定具有相同基因型和毛色。将具有毛色表型的F0代母羊与野生公羊配种,获得2只杂交F1代基因编辑羊,均为白色(表2,图1)。总体来看,获得杂交F1代个体以白色为主(71%,12/17),29%(5/17)个体具有毛色表型。

表4 F1代毛色分离的性别差异Table 4 Gender differences of coat color separation in F1 generation
3 讨论与结论
ASIP基因在控制哺乳动物色素转变过程中起着十分重要的作用[13]。绵羊的ASIP基因位于13号染色体,该基因在绵羊基因组中存在多个拷贝和多个等位基因。研究发现,不同品种绵羊ASIP基因SNP位点具有差异性:藏羊的ASIP基因外显子2仅存在5 bp碱基缺失,只有D5N5和N5N52种基因型[14];澳大利亚美利奴羊[9]、哈萨克羊[15]外显子2同时存在5 bp和9 bp碱基缺失。研究表明,美利奴羊的白色是由于ASIP基因的一段190 kb基因组串联片段决定,由于拷贝数变异使有功能的ASIP编码序列受到多个与之邻近ITCH位点的起调控作用启动区的作用,引起位于下游的ASIP基因表达,导致显性白色表型,而黑色绵羊ASIP基因不表达。Gratten等[16]发现ASIP基因第2外显子上5 bp碱基缺失和第4外显子g.5172T>A非同义突变影响了野生索厄羊的黑色被毛表型。Li等[17]的研究确定了ASIP基因是造成芬兰羊白色与非白色毛色变异的主要候选基因。孟浩浩等[18]研究发现阿勒泰羊ASIP基因的5 bp碱基缺失与被毛毛色不相关(P>0.05),而新疆细毛羊的ASIP基因的5 bp碱基缺失与被毛毛色极显著相关(P<0.01)。在本试验中,基因编辑细毛羊ASIP基因外显子2仅存在纯合基因型(包括N5N5,N9N9)和杂合基因型(包括N5D5,N9D9),未检测到2个缺失突变位点同时存在的个体。
根据之前的研究[9],所有的白色美利奴羊有多个拷贝ASIP等位基因,而所有的隐性黑色美利奴羊只有一个单拷贝等位基因。对于由CRISPR/Cas9介导的非同源末端连接,在任何靶向等位基因可能随机发生修饰,每个等位基因可能有不同的修饰。因此,CRISPR/Cas9在多个拷贝基因中进行的修饰也具有多态性。在本试验中,由于ASIP基因的多拷贝性,相同编辑类型的基因编辑羊也呈现不同毛色表型。如编辑基因型均为4 bp碱基缺失,自然突变均为D5N5杂合基因型的个体,其毛色有的呈现白色,有的呈现周身白,四肢和眼窝黑的图案,很可能是发生编辑的位置在不同的拷贝上,不同编辑类型在不同拷贝上的位置也可能导致同一编辑类型在不同个体出现多种毛色表型。因此,推测可能是由于ASIP基因的自然突变、不同的编辑修饰和ASIP多拷贝基因的串联重复三者共同作用使ASIP基因编辑羊的基因型和表型遗传呈现多样性。
随着新型基因组编辑技术的不断发展,有望从细胞或个体水平深入研究毛色候选基因的不同突变类型在细胞或个体水平造成的细胞色素化或毛色差异。而利用遗传修饰技术在绵羊中进行分子育种比传统的育种方式具有更大的优势,可以使用多种策略直接对性状进行快速改良,加快育种进程,必将会在家畜育种新材料创制和疾病防控等方面发挥重要作用,同时也为揭示人类某些重大遗传疾病的致病机理提供理论依据。
